- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Расстановка коэффициентов в ОВР с участием органических веществ методом кислородного баланса
Содержание
- 1. Презентация Расстановка коэффициентов в ОВР с участием органических веществ методом кислородного баланса
- 2. Цель работы: научить учащихся расстановке коэффициентов
- 3. Рассмотрим кислородный способ расстановки коэффициентов на примере
- 4. Пример №1. Нейтральная (00С) или слабощелочная
- 5. I. Нейтральная (00С) или слабощелочная среда –
- 6. I. Нейтральная (00С) или слабощелочная среда –
- 7. Пример № 2. Кислая среда (жесткое окисление)
- 8. Пример № 3. Сильнощелочная или нейтральная
- 9. Пример № 4. Окисление ацетилена в нейтральной
- 10. Пример № 4. Окисление ацетилена в нейтральной
- 11. Задание № 1.Расставить коэффициенты методом кислородного баланса
- 12. Задание № 1.Расставить коэффициенты методом кислородного баланса
- 13. Задание № 2.Расставить коэффициенты методом кислородного баланса
- 14. Задание № 2.Расставить коэффициенты методом кислородного баланса
- 15. Задание № 3 Преобразуйте схемы в уравнения
- 16. Литература и интернет-ресурсы1.Асанова Л.И. Организация подготовки к
Слайд 1
Расстановка
коэффициентов в ОВР
с участием органических веществ методом кислородного баланса
Чугайнова
учитель химии высшей категории
МАОУ СОШ № 11 г. Березники
Слайд 2
Цель работы:
научить учащихся расстановке коэффициентов в уравнениях окислительно-восстановительных
реакций
органических веществ
методом кислородного баланса.
Слайд 3
Рассмотрим кислородный способ расстановки коэффициентов на примере реакции окисления пропена перманганатом
Слайд 4 Пример №1. Нейтральная (00С) или слабощелочная среда – образование диолов
00С
СН2=СН-СН3 + KMnO4 + Н2О → СН2-СН-СН3 + MnO2+ КОН
│ │
ОН ОН
В уравнениях полуреакций окисления и восстановления записываем исходные вещества и продукты реакций в молекулярном виде:
С3Н6 → С3Н8О2 (органические вещества)
КMnO4 + Н2О → MnO2+ КОН (неорганические вещества)
Слайд 5I. Нейтральная (00С) или слабощелочная среда – образование диолов.
СН2=СН-СН3 + KMnO4
│ │
ОН ОН
2. В органических веществах уравниваем число атомов водорода молекулами воды. Подсчитываем число атомов кислорода
С3Н6 → С3Н8О2 (органические вещества)
+ Н2О
+ 1[O]
В неорганических веществах уравниваем число всех атомов элементов, начиная с атомов водорода. Подсчитываем число атомов кислорода
КMnO4 + Н2О → MnO2 + КОН
(неорганические вещества)
2
2
2
– 3[O]
Слайд 6I. Нейтральная (00С) или слабощелочная среда – образование диолов.
4. Складываем 2
С3Н6 + Н2О + 1[O] → С3Н8О2 1 3
2КMnO4 + Н2О – 3 [O] → 2MnO2+ 2КОН 3 1
3 СН2=СН-СН3 +2 KMnO4 + 4Н2О → 3СН2-СН-СН3 + 2MnO2+
│ │ 2КОН
ОН ОН
Слайд 7Пример № 2. Кислая среда (жесткое окисление) – образование кислоты и
СН2=СН-СН3+ KMnO4+ Н2SО4 → СO2 + СН3-COOH +
MnSO4+ К2SО4 + Н2О
В уравнениях полуреакций окисления и восстановления записываем исходные вещества и продукты реакций в молекулярном виде. Уравниваем число всех атомов элементов и подсчитываем число атомов кислорода. Складываем два уравнения полуреакций.
С3Н6 → СО2 + С2Н4О2
КMnO4 + Н2SО4 → MnSO4 + К2SО4 + Н2О
+ Н2О
+ 5[O]
2
2
3
3
- 5[O]
3
2
2
4
Слайд 8 Пример № 3. Сильнощелочная или нейтральная среда
(t0
калия.
СН2=СН-СН3 + KMnO4 + KOН → СН3 - СООК + К2СO3 + К2MnO4+ Н20
С3Н6 → С2Н3О2К + К2СO3
КMnO4 → К2MnO4 + Н2O
+ КОН
+ 3Н2O
+ 3КОН
+ 5[O]
2
- 1[O]
5
1
1
5
СН2=СН-СН3 + KMnO4 + KOН → СН3 - СООК +
К2СO3 + К2MnO4+ Н2O
________________________________________________________
2
2
10
13
10
8
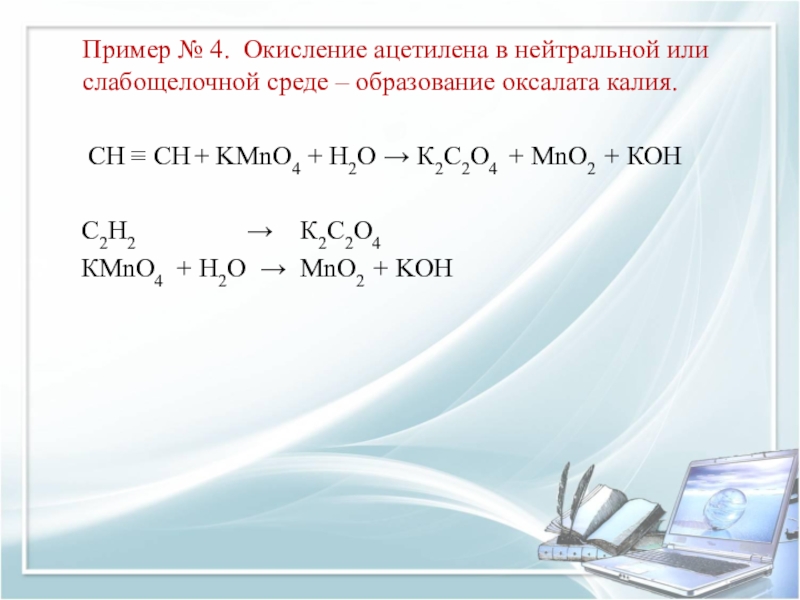
Слайд 9Пример № 4. Окисление ацетилена в нейтральной или слабощелочной среде –
СН ≡ СН + KMnO4 + Н2O → К2С2O4 + MnO2 + КОН
С2Н2 → К2С2O4
КMnO4 + Н2O → MnO2 + KOH
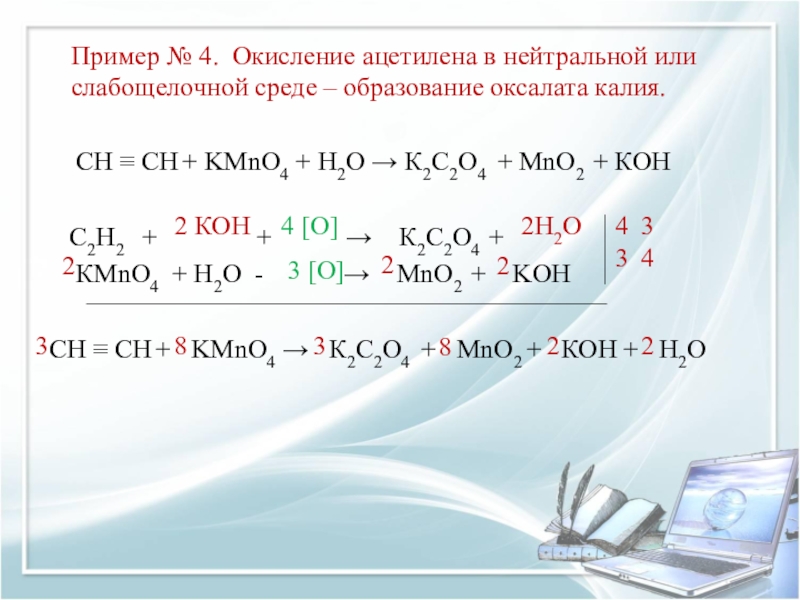
Слайд 10Пример № 4. Окисление ацетилена в нейтральной или слабощелочной среде –
СН ≡ СН + KMnO4 + Н2O → К2С2O4 + MnO2 + КОН
С2Н2 + + → К2С2O4 +
КMnO4 + Н2O - → MnO2 + KOH
СН ≡ СН + KMnO4 → К2С2O4 + MnO2 + КОН + Н2O
2 КОН
2Н2O
4 [O]
2
2
2
3 [O]
4
3
3
4
____________________________________________________
3
8
2
3
8
2
Слайд 11Задание № 1.
Расставить коэффициенты методом кислородного баланса в следующем уравнении реакции:
1. СН2=С-СН3 + KMnO4+ Н2SО4→СН3–С- СН3 + СO2 +MnSO4 + К2SО4+ Н2О
СН3 О
Слайд 12Задание № 1.
Расставить коэффициенты методом кислородного баланса в следующем уравнении реакции:
1. СН2=С-СН3 + KMnO4+ Н2SО4→СН3–С- СН3 + СO2 +MnSO4 + К2SО4+ Н2О
СН3 О
С4Н8 + 4 [O] → С3Н6О + СO2 + Н2O 4 5
2 КMnO4 + 3 H2SO4 - 5[O] → 2 MnSO4 + К2SO4 + 3Н2O 5 4
_________________________________________________
5СН2=С-СН3 + 8KMnO4+12Н2SО4→5СН3–СO-СН3 + 5СO2 +
СН3 +8 MnSO4 + 4К2SО4+ 17Н2О
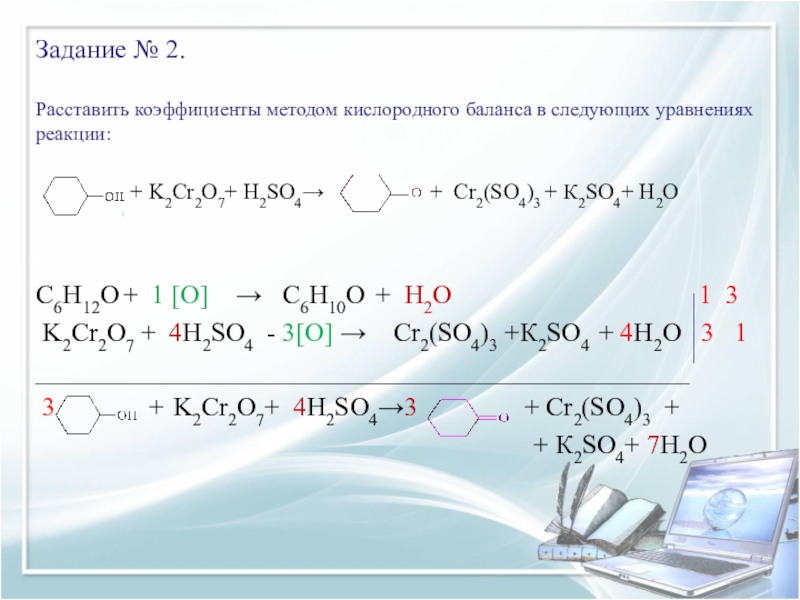
Слайд 13Задание № 2.
Расставить коэффициенты методом кислородного баланса в следующих уравнениях реакции:
+ K2Cr2O7+ Н2SО4→ + Cr2(SO4)3 + К2SО4+ Н2О
Слайд 14Задание № 2.
Расставить коэффициенты методом кислородного баланса в следующих уравнениях реакции:
+ K2Cr2O7+ Н2SО4→ + Cr2(SO4)3 + К2SО4+ Н2О
С6Н12O + 1 [O] → С6Н10О + Н2O 1 3
K2Cr2O7 + 4H2SO4 - 3[O] → Cr2(SO4)3 +К2SO4 + 4Н2O 3 1
_________________________________________________
3 + K2Cr2O7+ 4Н2SО4→3 + Cr2(SO4)3 +
+ К2SО4+ 7Н2О
Слайд 15Задание № 3
Преобразуйте схемы в уравнения реакций. Расставьте коэффициенты методом
СН3 – С (СН3) = СН2 + KMnO4+ Н2О→
СН3 – С (СН3) = С (СН3) - СН3 + KMnO4+ Н2SО4→
C6H5 – C(O)H + K2Cr2O7 + Н2SО4→
C6H5 – C ≡ СН + KMnO4+ Н2О →
C6H5 – CН = СН2 + KMnO4+ Н2О (00С)→
6. 1,2,4,5 – тетраметилбензол + KMnO4+ Н2SО4→
(дурол)
Слайд 16Литература и интернет-ресурсы
1.Асанова Л.И. Организация подготовки к ЕГЭ по химии: окислительно-восстановительные
2. Способы расстановки коэффициентов в реакциях окисления органических веществ. Мартынюк К.П. conf.stu-kras.ru.
3. Oкислительно-восстановительные реакции с участием органических веществ. Лекция 2
youtube.ru.