- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Углеводороды
Содержание
- 1. Презентация по теме Углеводороды
- 2. АлканыСnH2n+2
- 3. Гомологический ряд алкановCH4- метанC3H8-пропанC4H10-бутанC5H12-пентанCH3-метилC2H5-этилC3H7-пропилC4H9-бутилС5H11-амилC2H6-этан
- 4. Строение атома углерода2p2s…*c+4SP3 гибридизация
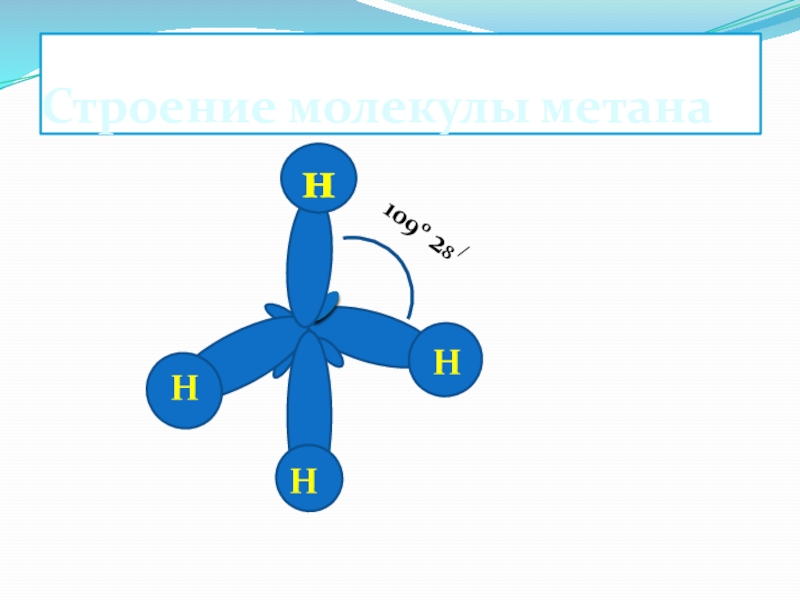
- 5. Строение молекулы метана1090 28 /НННн
- 6. Слайд 6
- 7. CCCCCCCCCCCCCCC
- 8. Слайд 8
- 9. Изомерия алканов С-С-С-С-СС-С-С-С-С-С-СС-С-С-С-СС- С-С-С-СС-С- С-С-С-СС--С
- 10. 53-метилпентан?
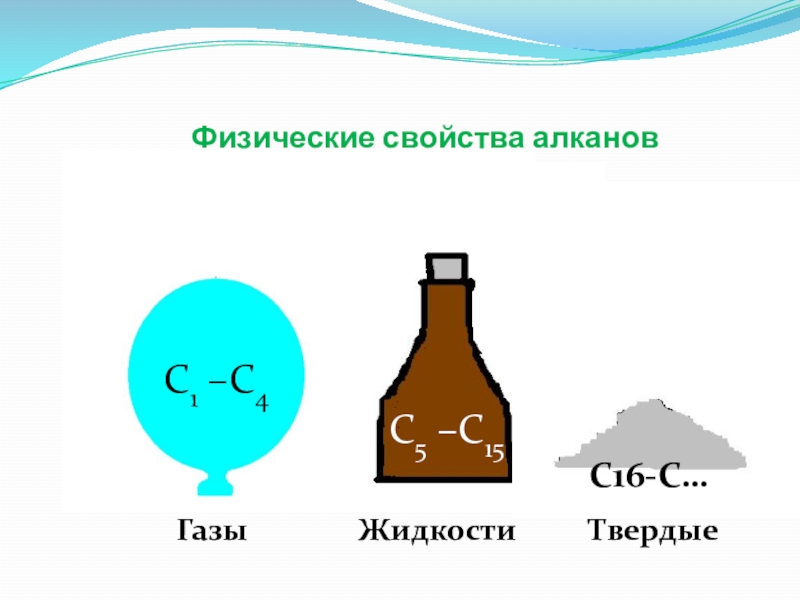
- 11. Физические свойства алканов С1 –С4С5 –С15ГазыЖидкостиС16-С…Твердые
- 12. Слайд 12
- 13. Химические свойстваРеакции радикального замещения
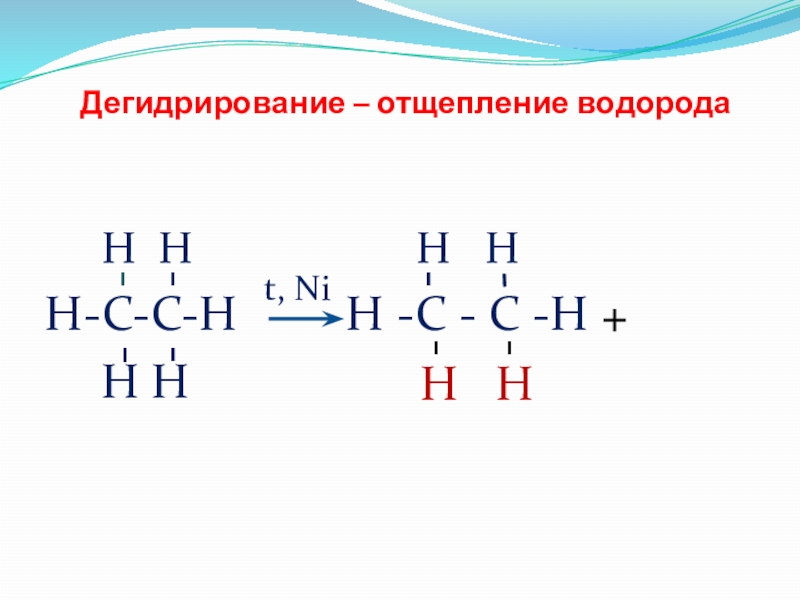
- 14. Дегидрирование – отщепление водорода
- 15. Реакции окисленияа) Горение ( полное окисление
- 16. Пиролиз 2СН4 =С 2Н2 +3Н2Крекинг С 6Н14 = С 3Н8 + С3Н6 Изомеризация
- 17. Механизм реакции замещения 1.Инициирование цепи
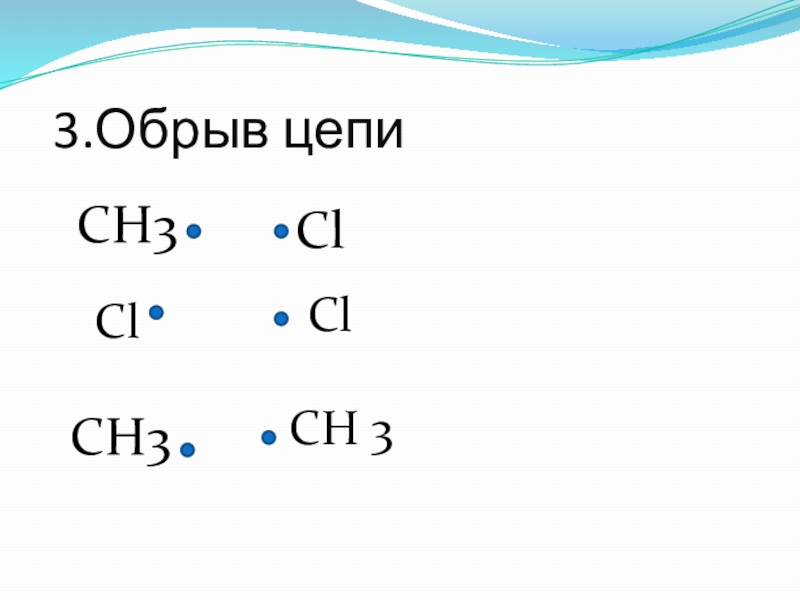
- 18. 3.Обрыв цепиСН3ClClClCH3CH 3
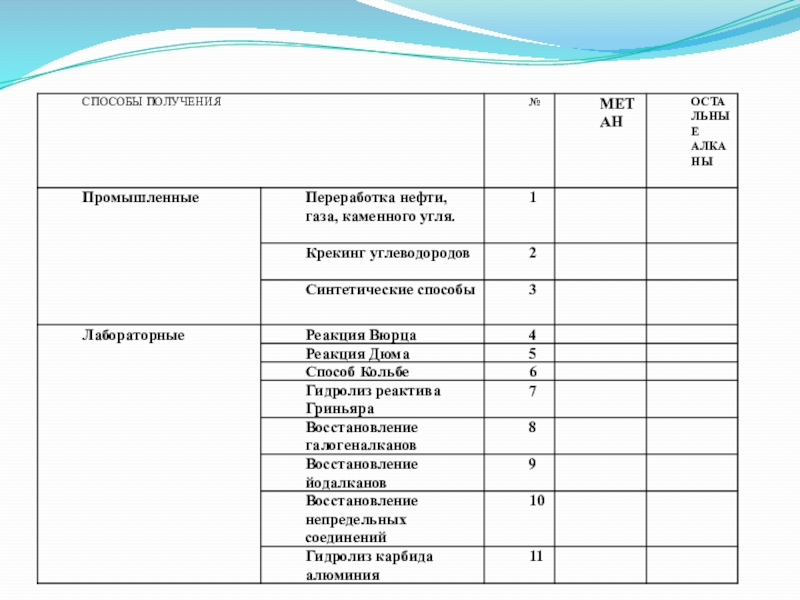
- 19. Способы получения алкановПолучение из природных источников: а)
- 20. Способы получения алканов Гидрирование угля: nC+(n+1)H2 =
- 21. Способы получения алкановСинтез Фишера-Тропша, на основе синтез-газа
- 22. Способы получения алканов
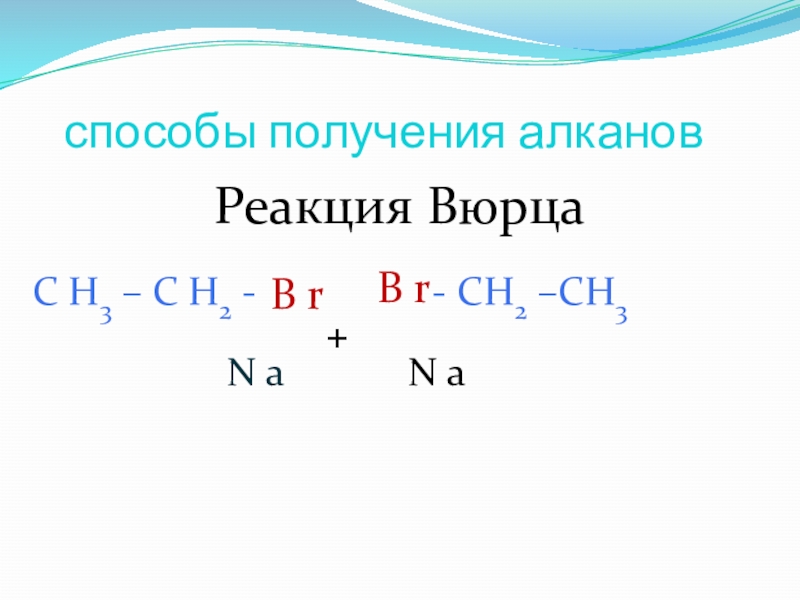
- 23. способы получения алкановРеакция Вюрца
- 24. Способы получения алкановСинтез Вюрца (Шарль Адольф Вюрц):
- 25. СН3-СН2-СН2-СН2-СН2- СН2-СН2-СН2-СН2-СН3 = СН3-СН2-СН2-СН2-СН3 +
- 26. Способ Кольбе - электролиз расплавов или растворов
- 27. Пиролиз солей карбоновых кислот C Н3
- 28. Впервые метан был получен из сероуглерода, при
- 29. Слайд 29
- 30. Метан Сажа Резина Каучук Топливо Растворите Синтез-газ Хладоагентыли
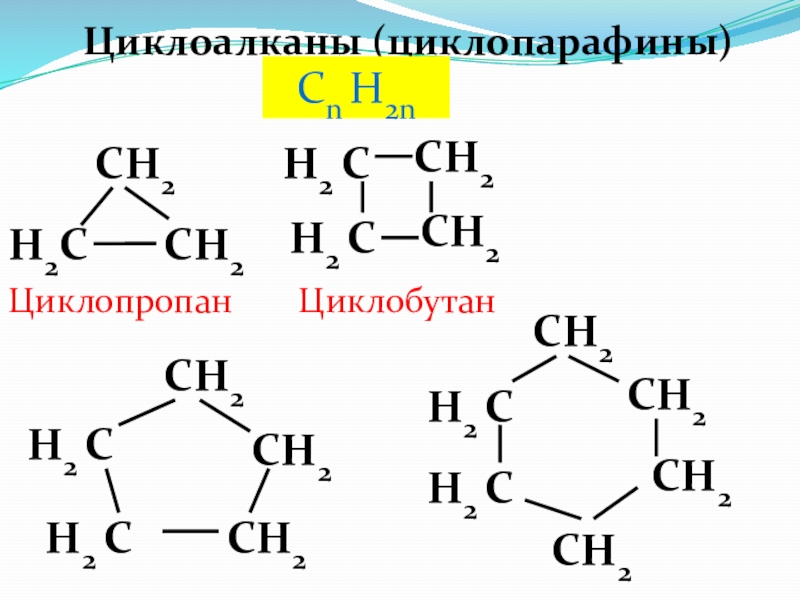
- 31. Циклоалканы (циклопарафины)Сn H2nH2CCH2H2 CCH2CH2CH2H2 CH2 CH2 CCH2H2 CH2 CCH2CH2Циклопропан ЦиклобутанCH2CH2CH2CH2
- 32. Слайд 32
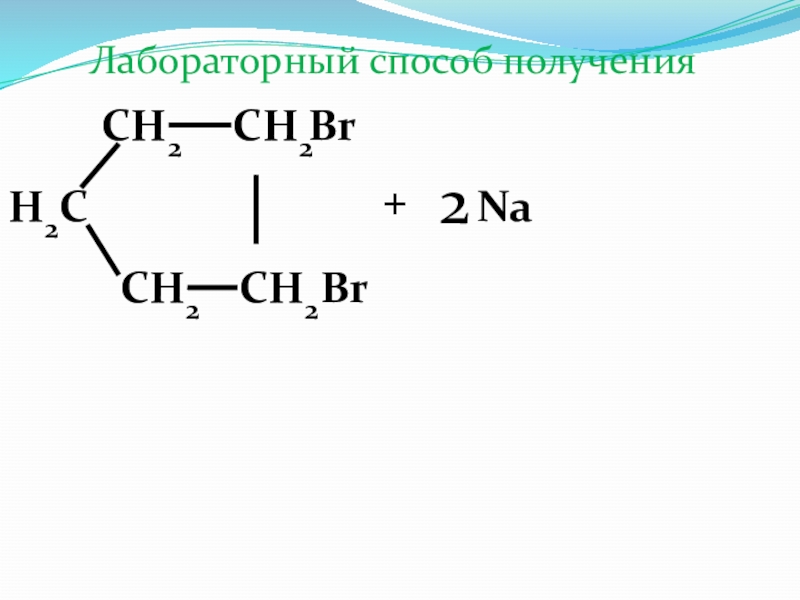
- 33. СН2СН2СН2СН2Н2СBrBr+2NaЛабораторный способ получения
- 34. Химические свойства циклоалкановРеакции присоединенияСН2СН2СН2СН3 +Н2 t , PtСН3 СН2Реакции замещения+СНClСН2СН2СН2СН2СН2СН2Н2ССН2Н2СCl2Н2СН2С+HCl
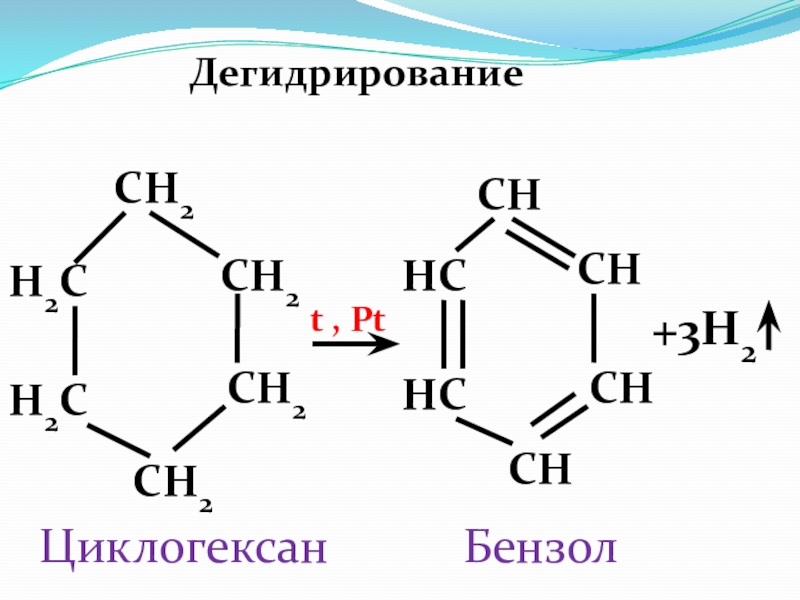
- 35. Дегидрирование CH2CH2CH2CH2H2CH2CHCHC t , PtCHCHCHCH+3H2 Циклогексан Бензол
- 36. А л к е н ыСnH2n
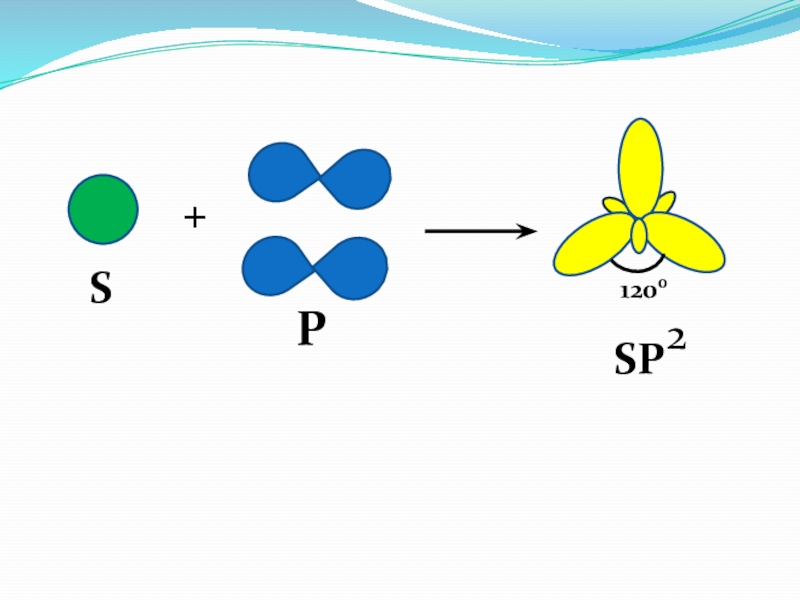
- 37. SP+1200SP2
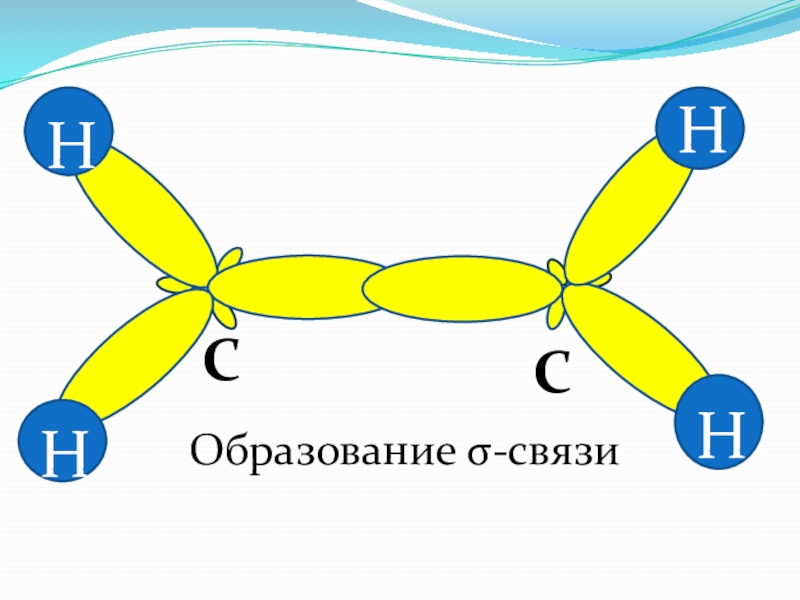
- 38. H HH HCCОбразование σ-связи
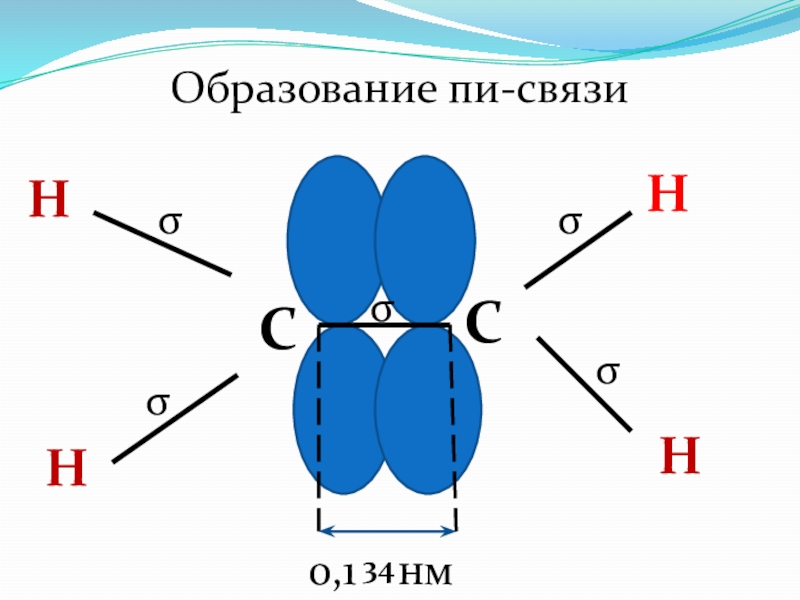
- 39. CCННННОбразование пи-связиσσσσσ0,1 нм34
- 40. Гомологический ряд алкеновC 2H4C 4H8C 3H6C 5H10Этен
- 41. 1 . Изомерия углеродного скелетаСН 2 =
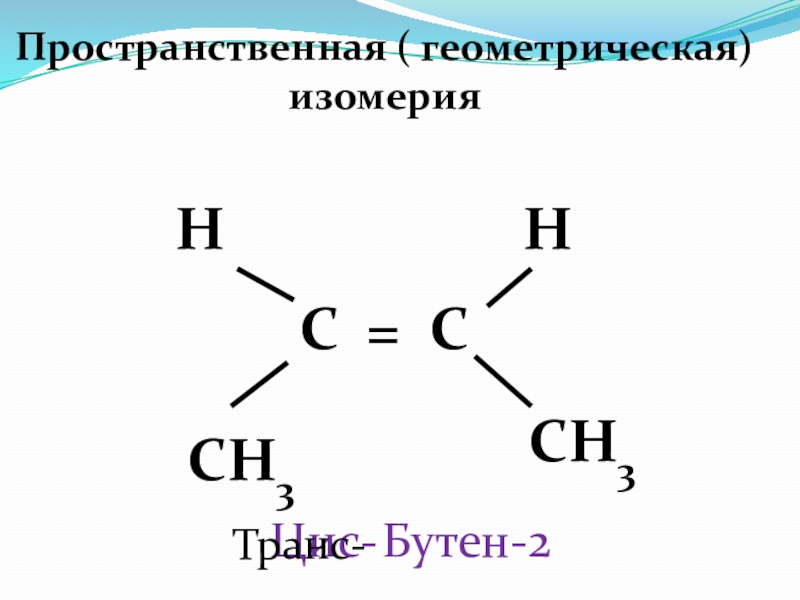
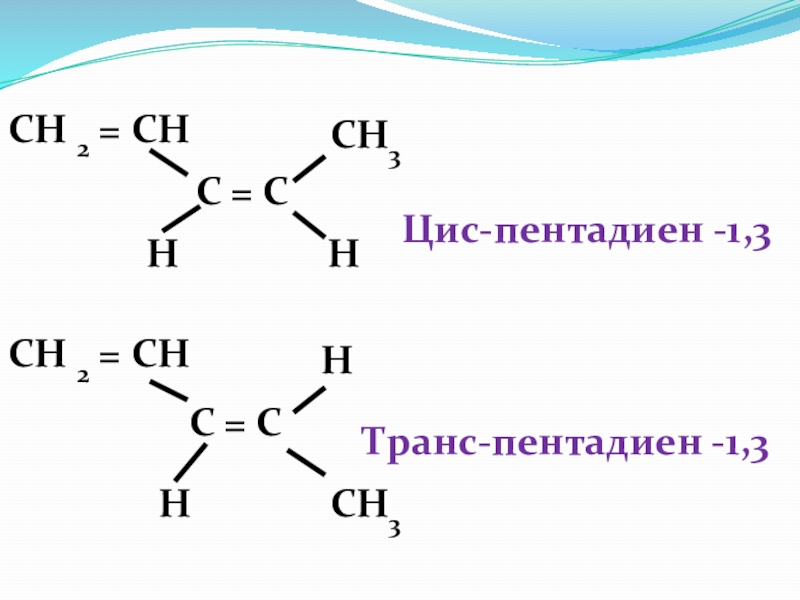
- 42. Пространственная ( геометрическая) изомерия С = С
- 43. Лабораторные способы получения Дегидрирование алканов –
- 44. H Химические свойства алкенов Реакции присоединенияСН
- 45. CC HC H OСН
- 46. Br CC Реакция присоединения
- 47. Реакция присоединения водородаCCC
- 48. Реакция полимеризацииСН 2 = СН2
- 49. nСН 2 = СН2
- 50. Реакция горения 3СН 2 = СН2+2KMnO4+4H2O
- 51. А л к а д и е н ы
- 52. СnH2n-2
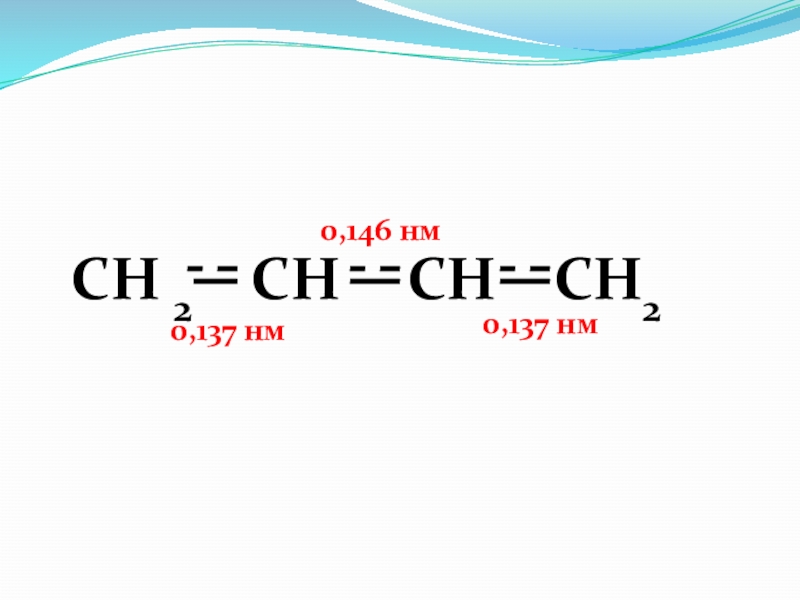
- 53. СН 2 = СН - CH2 –
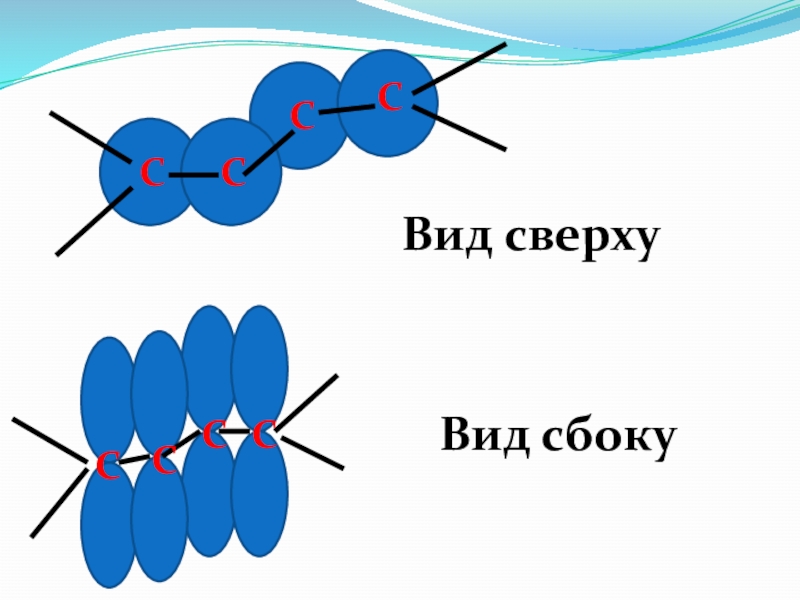
- 54. ССССССССВид сверхуВид сбоку
- 55. СН 2 СН CH
- 56. С = С
- 57. Алкины
- 58. СnH2n-2
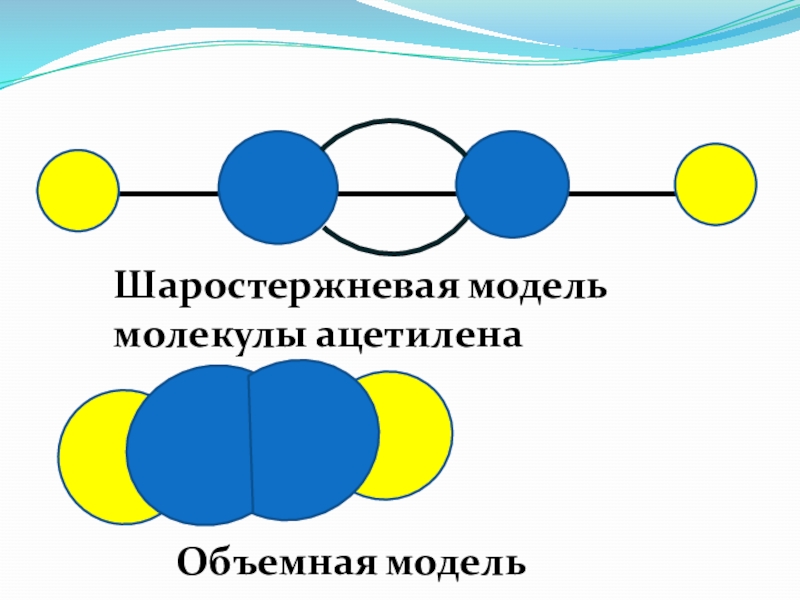
- 59. Шаростержневая модель молекулы ацетилена Объемная модель
- 60. СН = СН СН
- 61. Способы получения алкинов1. Пиролиз метана2CH4
- 62. Химические свойства алкинов1. Реакции присоединенияСН =
- 63. Кислотные свойства алкиновHC = CH +2[Ag(NH3)2]OHAg C
- 64. Окисление алкинов5HC = CH+8KMnO4+12H2SO4→
- 65. Полимеризация алкинов1.Димеризация ацетиленаHC =
- 66. АреныCnH2n -6
- 67. Ароматическими углеводородами называются вещества,в молекулах которых содержится
- 68. Способы получения1.Дегидрирование циклогексанаPt, tH2+ 32.Ароматизация алкановCH3 – CH2 – CH2 – CH2 – CH2 – CH3+4H2
- 69. С6Н6 + СН3Сl
- 70. Химические свойства аренов1.ГалогенированиеC6H6 + Cl2
Слайд 1Углеводороды
Выполнила Домрачева Л.Г. , учитель химии МБОУ Шарангская средняя общеобразовательная школа
Слайд 3Гомологический ряд алканов
CH4- метан
C3H8-пропан
C4H10-бутан
C5H12-пентан
CH3-метил
C2H5-этил
C3H7-пропил
C4H9-бутил
С5H11-амил
C2H6-этан
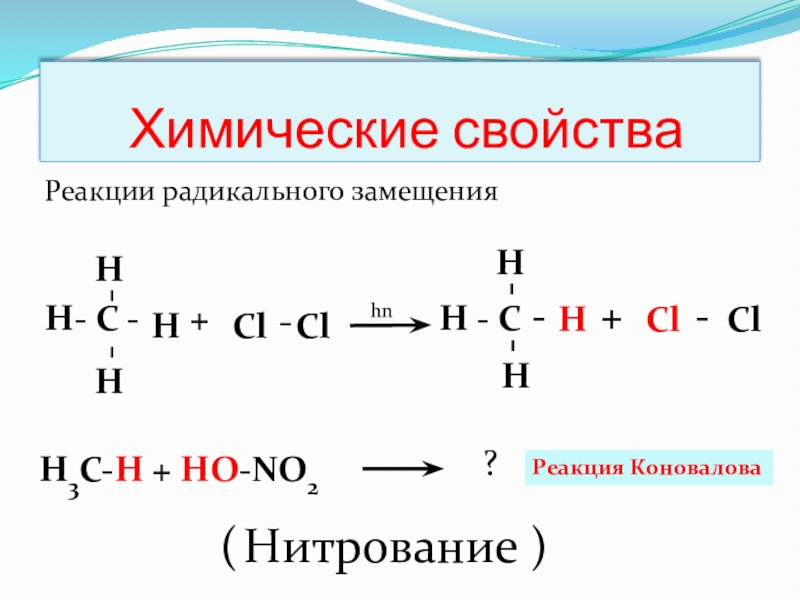
Слайд 13 Химические свойства
Реакции радикального замещения
Н- С - + H - C
Н
Н
Н
-
-
Cl
-
Cl
hn
Cl
Cl
Н
Н
Н
-
-
-
+
-
Реакция Коновалова
( Нитрование )
H3C-H + HO-NO2
?
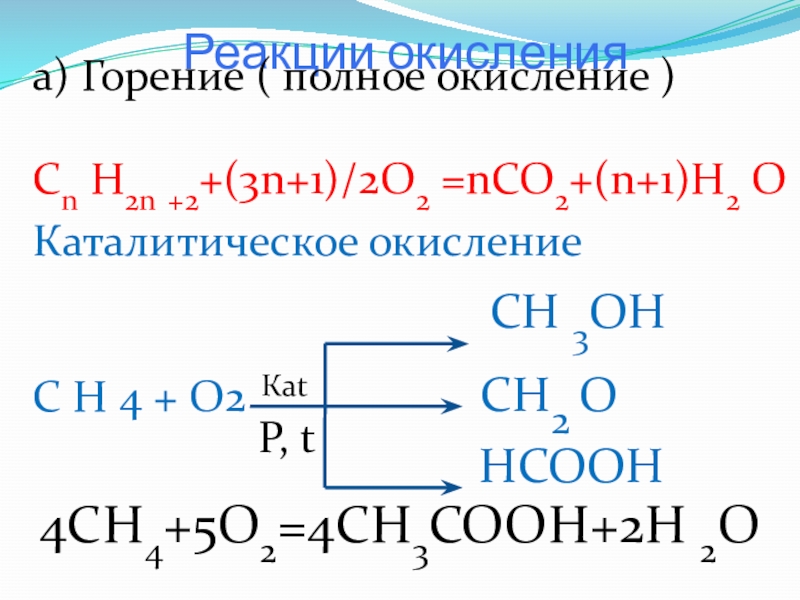
Слайд 15 Реакции окисления
а) Горение ( полное окисление )
Cn H2n +2+(3n+1)/2O2
Каталитическое окисление
СН 3ОН
С Н 4 + О2 СН2 О
НСООН
Каt
P, t
4CH4+5O2=4CH3COOH+2H 2O
Слайд 19Способы получения алканов
Получение из природных источников:
а) метан, этан, пропан, бутан
б) Алканы от С5 до С11 выделяют из бензиновой фракции нефти
в) алканы от С12 до С16 из средней фракции нефти
г) высшие алканы, от С16 и выше, получают вакуумной перегонкой неперегоняемого остатка нефти.
Слайд 20Способы получения алканов
Гидрирование угля:
nC+(n+1)H2 = CnH(2n+2), где n –
Например:
С + 2H2 = CH4 – частный случай для метана
Слайд 21Способы получения алканов
Синтез Фишера-Тропша, на основе синтез-газа (CO + H2):
nCO+(2n+1)H2 =
Kat = Ni или Co и t= 200 градусов Цельсия, Например:
3CO + 7H2=C3H8 + 3H2O – частный случай для пропана.
Слайд 22Способы
получения алканов
Восстановление
R-CH=CH2 + H2 → R-CH2-CH3,
при условии, что t=200 градусов Цельсия и Kat = Ni.
Например:
CH2=CH2 + H2 → СH3–CH3
Слайд 24Способы получения алканов
Синтез Вюрца (Шарль Адольф Вюрц):
Rahal + 2Na + R'Hal → RR' + 2NaHal
2R-Br + 2Na = R-R + 2 NaBr, данная реакция идет только в гексане, который как известно является жидкостью…. В данном случае «R» - радикал, причем он слева и справа один и тот же.
Пример: 2CH3-Br + 2Na = CH3-CH3 + NaBr, продукт этой реакции – этан.
Или 2CH3-CH2Br + 2Na = CH3-CH2-CH2-CH3 + 2NaBr, продукт этой реакции – бутан…
Очевидно, что напрямую через синтез Вюрца невозможно получить алканы с нечетным количеством атомов углерода.
C2H5Br + Na =
C3H7I +Na =
Слайд 25СН3-СН2-СН2-СН2-СН2- СН2-СН2-СН2-СН2-СН3 =
СН3-СН2-СН2-СН2-СН3 +
С16Н34 =
С18Н38 =
Крекинг нефтепродуктов
Слайд 26Способ Кольбе - электролиз расплавов или растворов солей карбоновых кислот
2RCOONa → R-R + 2CO2 + 2Na (расплав)
2RCOONa + 2H2O = R-R + 2CO2 +H2 + 2 NaOH
Гидролиз реактива Гриньяра.
Гриньяр – французский химик
RHal + Mg → RMgHal RMgHal + HCl → RH + MgClHal
Слайд 27 Пиролиз солей карбоновых кислот
C Н3
COONa + NaO
= CH4+Na2CO3
H
C2H5 COONa +NaOH=
C2H6 + Na2CO3
Гидролиз карбида алюминия
Al4C3 + 12H2O =4 Al(OH)3 + 3 CH4
Al4C3 + 12HCl =4 AlCl3 + 3 CH4
Реакция Дюма
французский химик
Слайд 28Впервые метан был получен из сероуглерода, при пропускании его вместе с
На МКС запущено новое оборудование, которое будет поддерживать систему восстановления воды на МКС. СO2 + 4H2 → CH4 + 2H2O Система на основе реакции Сабатье может производить до 2 тыс. л. воды в год из побочных продуктов систем производства кислорода и удаления углекислого газа на станции. Процесс назван в честь Поля Сабатье, нобелевского лауреата по химии 1912 года
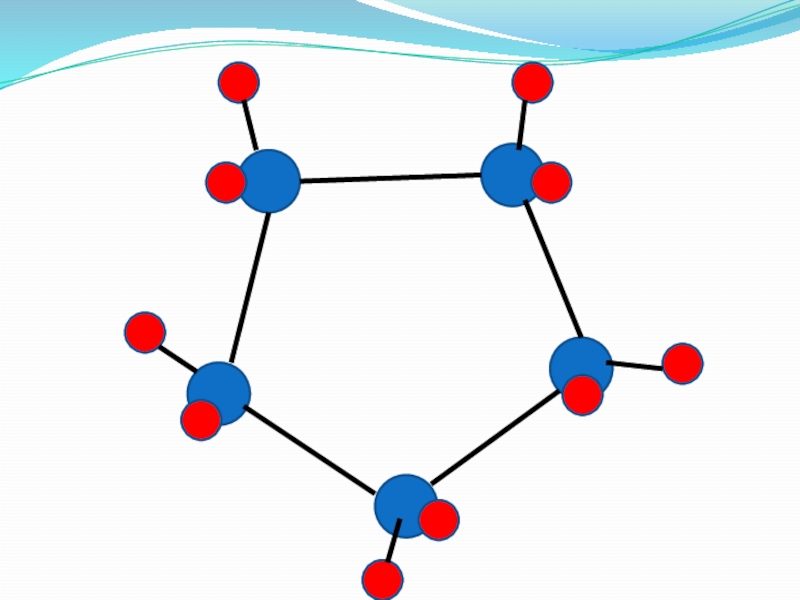
Слайд 31Циклоалканы (циклопарафины)
Сn H2n
H2C
CH2
H2 C
CH2
CH2
CH2
H2 C
H2 C
H2 C
CH2
H2 C
H2 C
CH2
CH2
Циклопропан
Циклобутан
CH2
CH2
CH2
CH2
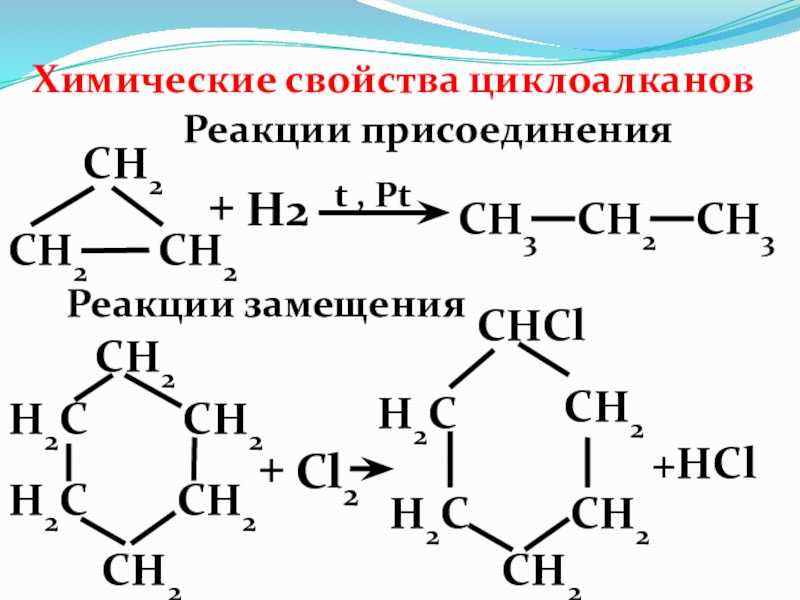
Слайд 34Химические свойства циклоалканов
Реакции присоединения
СН2
СН2
СН2
СН3
+
Н2
t , Pt
СН3
СН2
Реакции замещения
+
СНCl
СН2
СН2
СН2
СН2
СН2
СН2
Н2С
СН2
Н2С
Cl2
Н2С
Н2С
+HCl
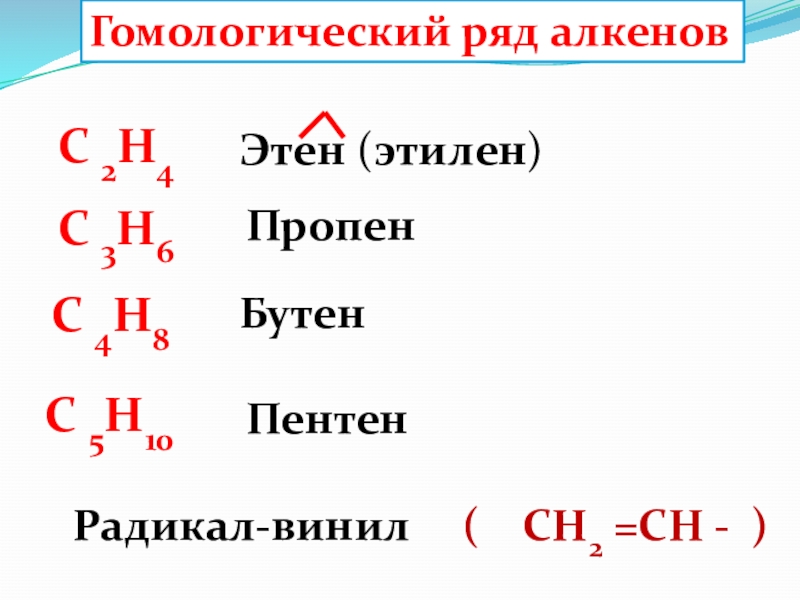
Слайд 40Гомологический ряд алкенов
C 2H4
C 4H8
C 3H6
C 5H10
Этен (этилен)
Пропен
Бутен
Пентен
Радикал-винил
Слайд 411 . Изомерия углеродного скелета
СН 2 = СН – СН 2
СН 3 - СН = СН - СН3 БУТЕН - 2
СН 2 = С– СН3 2–метилпропен
СН3
–
2. Изомерия положения « = » связи
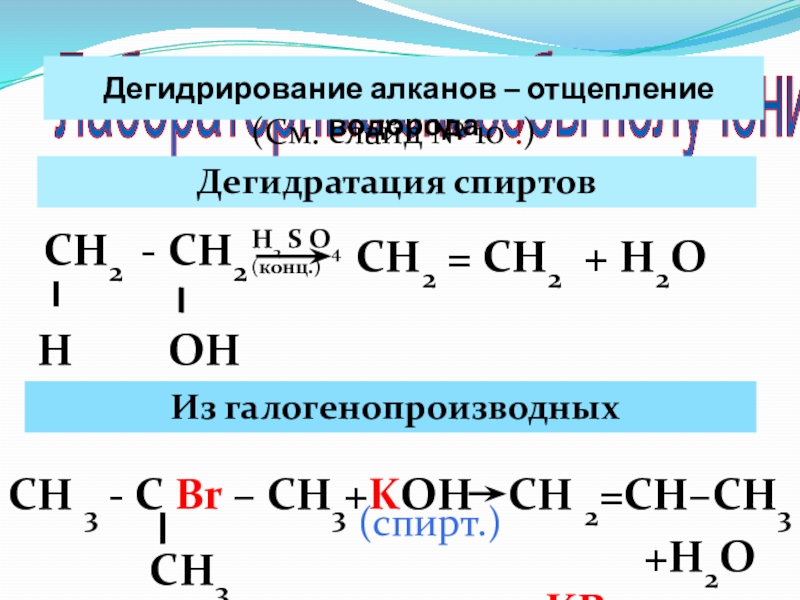
Слайд 43 Лабораторные способы получения
Дегидрирование алканов – отщепление водорода
(См. слайд №
Дегидратация спиртов
СН2 - СН2
Н
ОН
Н2 S O4 (конц.)
Из галогенопроизводных
СН2 = СН2 + Н2О
СН 3 - С Br – СН3
СН3
СН 2=СН–СН3
+KOH
+KBr
+H2O
(спирт.)
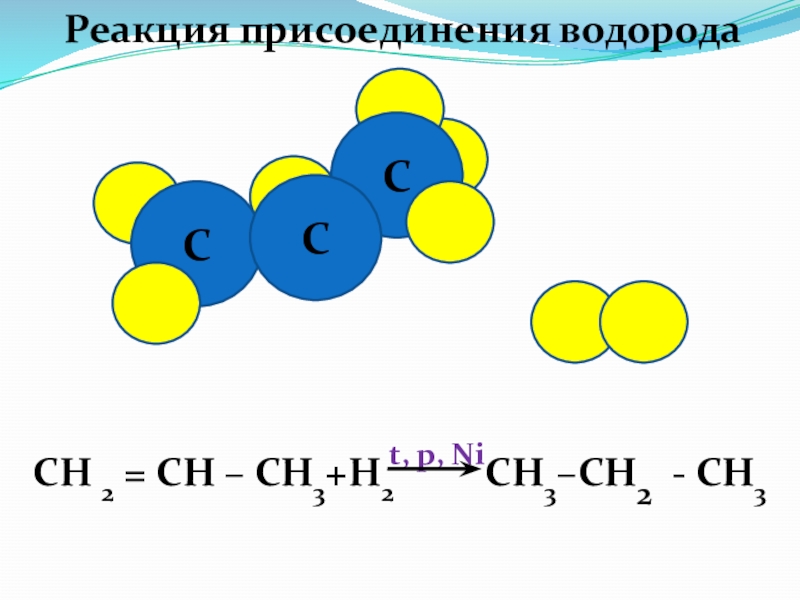
Слайд 44
H
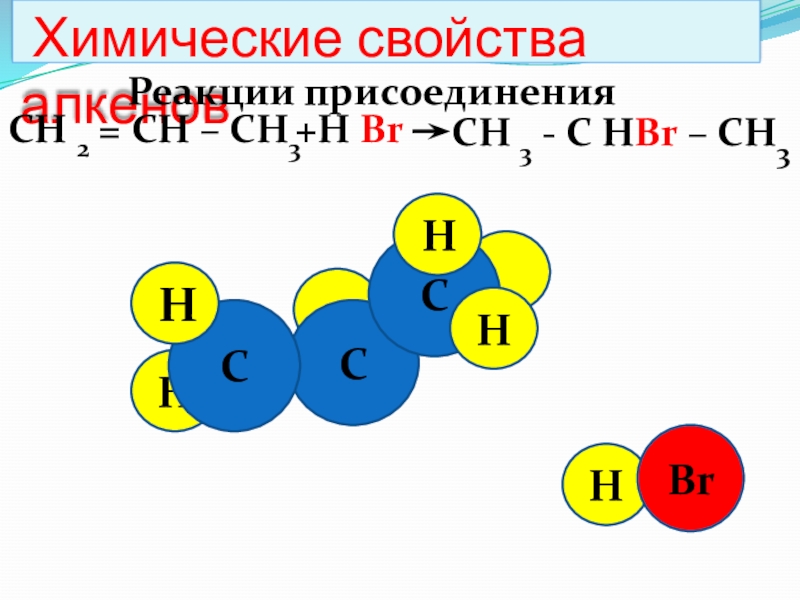
Химические свойства алкенов
Реакции присоединения
СН 2 = СН
СН 3 - С НBr – СН3
+Н Br
C
C
C
H
H
H
H
Br
Слайд 46 Br
C
C
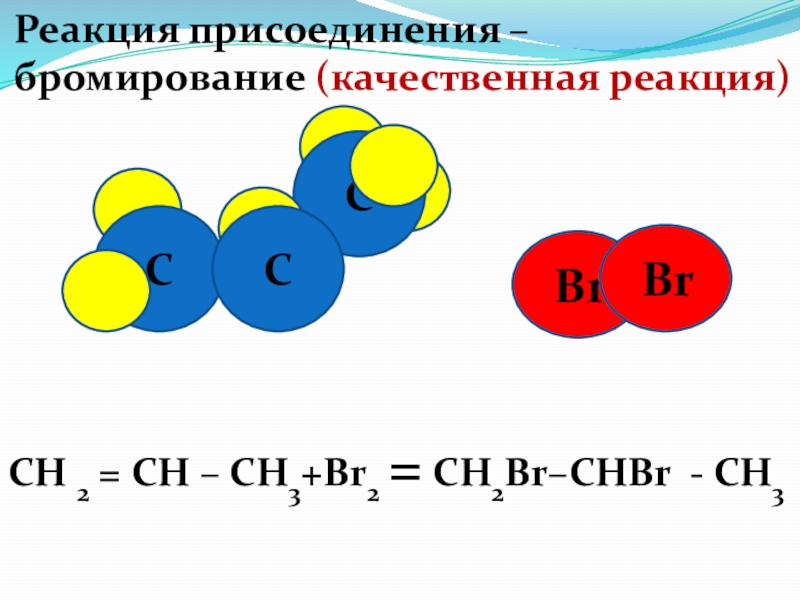
Реакция присоединения – бромирование
C
Br
СН 2 = СН – СН3+Br2 = CH2Br–CHBr - CH3
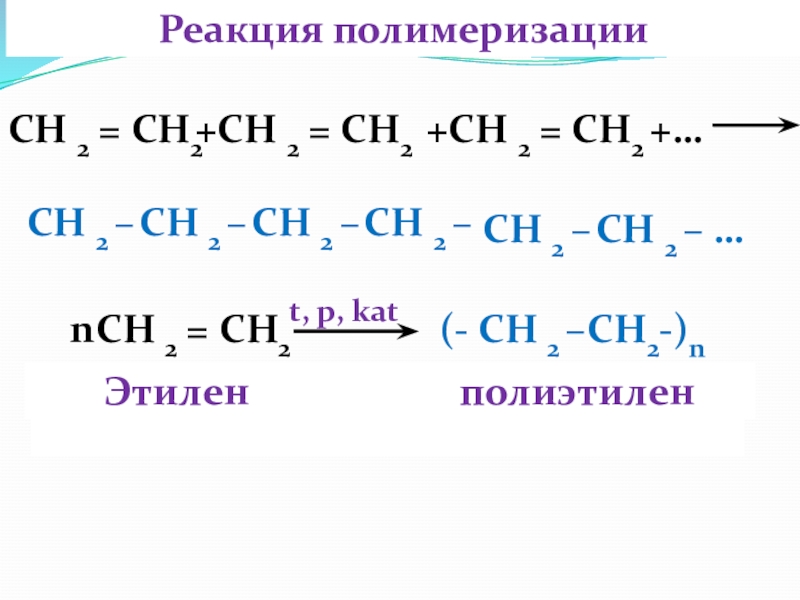
Слайд 48Реакция полимеризации
СН 2 = СН2
+СН 2 =
+СН 2 = СН2 +…
СН 2 –
СН 2 –
СН 2 –
СН 2 –
СН 2 –
СН 2 – …
t, p, kat
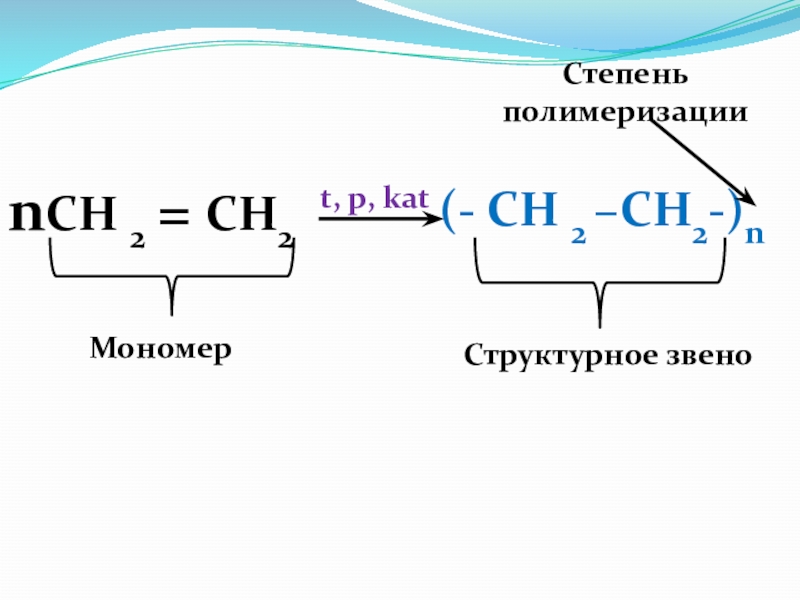
nСН 2 = СН2
(- СН 2 –CH2-)n
Этилен полиэтилен
Слайд 50Реакция горения
3СН 2 = СН2+2KMnO4+4H2O
C nH2n +3n/2O2 = nCO2 +nH2 O
Реакция Вагнера(качественная реакция!)
2СН 2 = СН2
Каталитическое окисление
2СН 3 - С
2СН 2 = СН2
+О 2
+О 2
О
2СН 2 – С Н2
О
Н
Pd2+/Cu2+
t, Ag
Слайд 53СН 2 = СН - CH2 – CH = CH2
СН 2 = С = CH2
СН 2 = СН - CH = CH - CH3
Пентадиен-1,4 (изолированные связи)
Пропадиен -1,2 (кумулированные связи)
Пентадиен-1,3 (сопряженные связи)
Слайд 60СН = СН
СН = С – СН3
СН = С – СН2 - СН3
СН3 – С = С – СН3
СН = С – СН - СН3
СН3
Этин (ацетилен)
Пропин
Бутин-1
Бутин-2
3-метилбутин-1
Слайд 61 Способы получения алкинов
1. Пиролиз метана
2CH4
1500 с0
2. Карбидный метод
CaC2+2H2O C2H2+Ca(OH)2
3. Дегидрогалогенирование
C 2H4Br 2 +KOH=C 2H2 +? +?
(Спирт.)
Слайд 62 Химические свойства алкинов
1. Реакции присоединения
СН = СН
−
Н2
СН 2 = СН2
Н2
СН 3 - СН3
СН = СН
−
Br2
BrСН = СНBr
Br2
?
HC = C – CH3 +2HBr
H3C- CBr2–CH3
AlBr3
CH = CH + H2O
H3C - C
Hg2+
= O
- H
( реакция Кучерова)
Слайд 63Кислотные свойства алкинов
HC = CH +2[Ag(NH3)2]OH
Ag C = C Ag +
(серый)
HC = CH + 2[Cu(NH3)2 ]Cl →
(КРАСНЫЙ)
Ag – C = C – Ag + HCl →
CH = CH↑+2AgCl↓
Cu -С = C – Cu ↓ +2NH4Cl
Слайд 64 Окисление алкинов
5HC = CH+8KMnO4+12H2SO4→
−
На воздухе алкины горят коптящим пламенем, в кислороде ацетилен горит бледно – голубым пламенем
2C2H2 +5O2 →4CO2 +2H2O
Слайд 65 Полимеризация алкинов
1.Димеризация ацетилена
HC = CH + HC =
H2C = CH – C = CH
На основе винилацетилена получают хлоропреновый каучук
2.Тримеризация ацетилена
3HC CH →C6H6
t
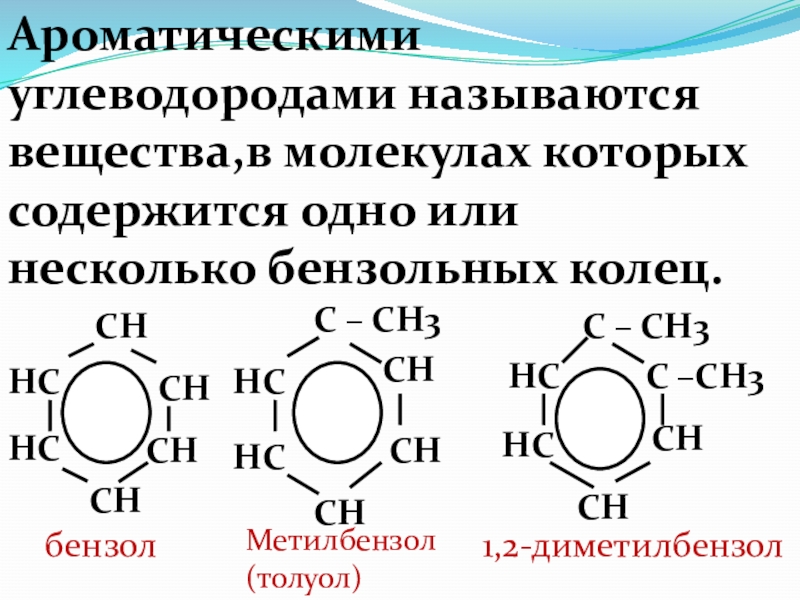
Слайд 67Ароматическими углеводородами называются вещества,в молекулах которых содержится одно или несколько бензольных
HC
HC
CH
CH
CH
CH
бензол
HC
HC
C – CH3
CH
C – CH3
CH
CH
CH
Метилбензол
(толуол)
C –CH3
HC
HC
CH
1,2-диметилбензол
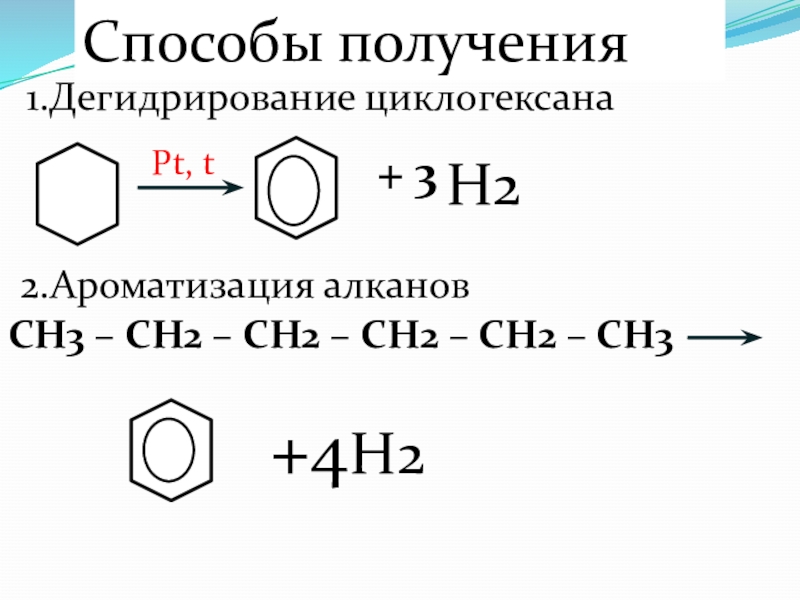
Слайд 68Способы получения
1.Дегидрирование циклогексана
Pt, t
H2
+ 3
2.Ароматизация алканов
CH3 – CH2 – CH2 –
+4H2
Слайд 69С6Н6 + СН3Сl C6H5CH3 + HCl
3.Тримеризация
3 С2Н2
600 С
0
С 6Н6
4. Пиролиз солей ароматических кислот
С6Н5СООК + KOH C6H6 + K2CO3
AlCl3
5.Алкилирование бензола
t
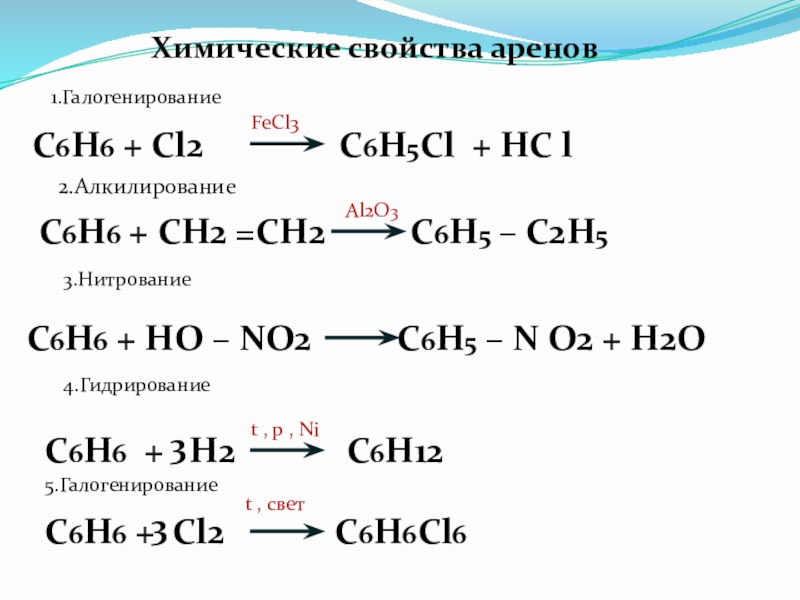
Слайд 70Химические свойства аренов
1.Галогенирование
C6H6 + Cl2
FeCl3
2.Алкилирование
C6H6 + СН2 =СН2 С6Н5 – С2Н5
Al2O3
3.Нитрование
C6H6 + HO – NO2 C6H5 – N O2 + H2O
4.Гидрирование
C6H6 + H2 C6H12
3
t , p , Ni
5.Галогенирование
C6H6 + Cl2 C6H6Cl6
3
t , свет





























![Презентация по теме Углеводороды Кислотные свойства алкиновHC = CH +2[Ag(NH3)2]OHAg C = C Ag + Кислотные свойства алкиновHC = CH +2[Ag(NH3)2]OHAg C = C Ag + + 4NH3 +2H2 O (серый)](/img/thumbs/c29efffa8b4f960c1aca7fbd49135e5c-800x.jpg)