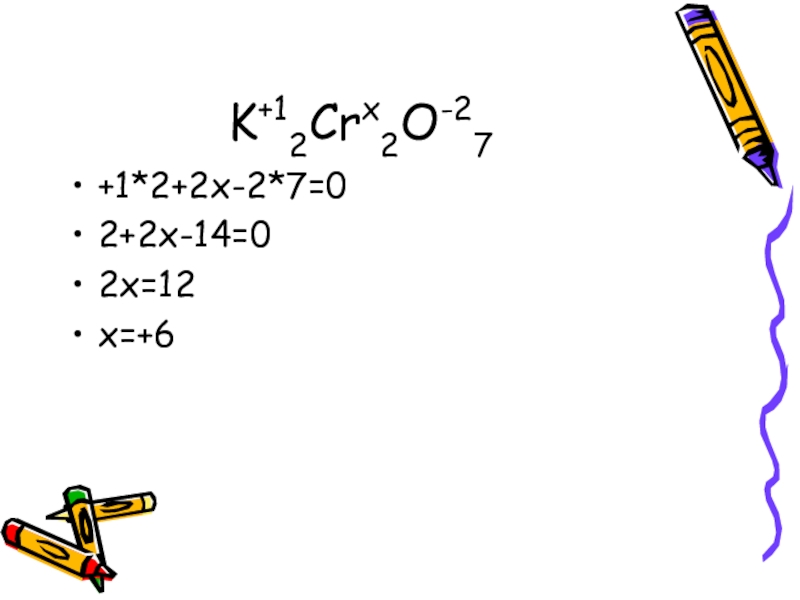- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Окислительно-восстановительные реакции
Содержание
- 1. Презентация по теме Окислительно-восстановительные реакции
- 2. ЗАДАЧИУЗНАТЬ ЧТО ТАКОЕ:ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ,ОКИСЛИТЕЛЬ, ВОССТАНОВИТЕЛЬ, ОКИСЛЕНИЕ, ВОССТАНОВЛЕНИЕ,СТЕПЕНЬ ОКИСЛЕНИЯ;
- 3. ЗАДАЧИНАУЧИТЬСЯ ОПРЕДЕЛЯТЬ СТЕПЕНЬ ОКИСЛЕНИЯ, ЧИСЛО ОТДАННЫХ ИЛИ ПРИНЯТЫХ ЭЛЕКТРОНОВ, ОКИСЛИТЕЛЬ И ВОССТАНОВИТЕЛЬ.СОСТАВЛЯТЬ ЭЛЕКТРОННЫЙ БАЛАНС,.
- 4. СТЕПЕНЬ ОКИСЛЕНИЯЭТО УСЛОВНЫЙ ЗАРЯД АТОМА В МОЛЕКУЛЕ, РАССЧИТАННЫЙ ИЗ ТОГО, ЧТО ВСЕ СВЯЗИ В МОЛЕКУЛЕ ИОННЫЕ.
- 5. ПРАВИЛА ДЛЯ ОПРЕДЕЛЕНИЯ СТЕПЕНЕЙ ОКИСЛЕНИЯСТЕПЕНЬ ОКИСЛЕНИЯ АТОМОВ
- 6. K+12Crx2O-27+1*2+2х-2*7=02+2х-14=02х=12х=+6
- 7. Определите степень окисления каждого элементаK2MnO4, Na2SO4, Ca(NO3)2
- 8. Любая ОВР – совокупность процессов отдачи и
- 9. Любая ОВР – совокупность процессов отдачи и
- 10. Алгоритм расстановки коэффициентов в ОВР:Поставить степень окисления
- 11. Алгоритм расстановки коэффициентов в ОВР:3. Выписать подчеркнутые
- 12. Алгоритм расстановки коэффициентов в ОВР:4. Определить НОК
- 13. Алгоритм расстановки коэффициентов в ОВР:5. Поставить коэффициенты,
- 14. Алгоритм расстановки коэффициентов в ОВР:6. Определить окислитель
- 15. Расставьте коэффициенты с помощью электронного баланса:SO2+O2
- 16. Установите соответствие между формулой веществ и степенью окисления азота А) HNO3Б) N2O4В) (NH4)2CO3Г) KNO2+2+3+4+5-2-3
- 17. Установите соответствие между схемой реакции и степенью
- 18. спасибо за внимание!
ЗАДАЧИУЗНАТЬ ЧТО ТАКОЕ:ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ,ОКИСЛИТЕЛЬ, ВОССТАНОВИТЕЛЬ, ОКИСЛЕНИЕ, ВОССТАНОВЛЕНИЕ,СТЕПЕНЬ ОКИСЛЕНИЯ;
Слайд 2ЗАДАЧИ
УЗНАТЬ ЧТО ТАКОЕ:ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ,
ОКИСЛИТЕЛЬ, ВОССТАНОВИТЕЛЬ,
ОКИСЛЕНИЕ, ВОССТАНОВЛЕНИЕ,
СТЕПЕНЬ ОКИСЛЕНИЯ;
Слайд 3ЗАДАЧИ
НАУЧИТЬСЯ ОПРЕДЕЛЯТЬ СТЕПЕНЬ ОКИСЛЕНИЯ,
ЧИСЛО ОТДАННЫХ ИЛИ ПРИНЯТЫХ ЭЛЕКТРОНОВ,
ОКИСЛИТЕЛЬ И
ВОССТАНОВИТЕЛЬ.
СОСТАВЛЯТЬ ЭЛЕКТРОННЫЙ БАЛАНС,.
СОСТАВЛЯТЬ ЭЛЕКТРОННЫЙ БАЛАНС,.
Слайд 4СТЕПЕНЬ ОКИСЛЕНИЯ
ЭТО УСЛОВНЫЙ ЗАРЯД АТОМА В МОЛЕКУЛЕ, РАССЧИТАННЫЙ ИЗ ТОГО, ЧТО
ВСЕ СВЯЗИ В МОЛЕКУЛЕ ИОННЫЕ.
Слайд 5ПРАВИЛА ДЛЯ ОПРЕДЕЛЕНИЯ СТЕПЕНЕЙ ОКИСЛЕНИЯ
СТЕПЕНЬ ОКИСЛЕНИЯ АТОМОВ ПРОСТЫХ ВЕЩЕСТВ РАВНА НУЛЮ;
СУММА
ВСЕХ СТЕПЕНЕЙ ОКИСЛЕНИЯ В СЛОЖНОМ ВЕЩЕСТВЕ РАВНА НУЛЮ;
СТЕПЕНЬ ОКИСЛЕНИЯ МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП РАВНА НОМЕРУ ГРУППЫ;
СТЕПЕНЬ ОКИСЛЕНИЯ ВОДОРОДА +1(ИСКЛЮЧЕНИЕ Na+1H-1);
степень окисления атомов кислорода -2 (исключение F-12O+2, H+12O-12)
СТЕПЕНЬ ОКИСЛЕНИЯ МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП РАВНА НОМЕРУ ГРУППЫ;
СТЕПЕНЬ ОКИСЛЕНИЯ ВОДОРОДА +1(ИСКЛЮЧЕНИЕ Na+1H-1);
степень окисления атомов кислорода -2 (исключение F-12O+2, H+12O-12)
Слайд 7Определите степень окисления каждого элемента
K2MnO4, Na2SO4, Ca(NO3)2 ;
NH4NO3, NH4Cl, K2CrO4;
K2Cr2O7 ,
Cr2(SO4)3 , CH4 ;
H2S, KClO3 , HNO2;
Pb(OH)2 , H3AsO4 , K2FeO4 .
H2S, KClO3 , HNO2;
Pb(OH)2 , H3AsO4 , K2FeO4 .
Слайд 8Любая ОВР – совокупность процессов отдачи и взятия электронов.
Процесс отдачи электронов
называют окислением.
Частицы, отдающие электроны – восстановителями.
Сколько электронов отдали атомы:
-3…+5; -2…+6; -1…+7; 0…+5; +2…+6; +4…+6; +2…+5; 0…+3; 0…+4.
Частицы, отдающие электроны – восстановителями.
Сколько электронов отдали атомы:
-3…+5; -2…+6; -1…+7; 0…+5; +2…+6; +4…+6; +2…+5; 0…+3; 0…+4.
Слайд 9Любая ОВР – совокупность процессов отдачи и взятия электронов.
Процесс взятия электронов
называют восстановлением.
Частицы, принимающие электроны – окислителями.
Сколько взяли атомы:
0…-3; 0…-4; +6…-2; +5…-3; +4…-4; +6…+4; +5…0; +3…0; +5…+3.
Частицы, принимающие электроны – окислителями.
Сколько взяли атомы:
0…-3; 0…-4; +6…-2; +5…-3; +4…-4; +6…+4; +5…0; +3…0; +5…+3.
Слайд 10Алгоритм расстановки коэффициентов в ОВР:
Поставить степень окисления каждого химического элемента.
H+12S-2+O02
S+4O-22+H+12O-2
2. Подчеркнуть элементы, изменившие степень окисления.
2. Подчеркнуть элементы, изменившие степень окисления.
Слайд 11Алгоритм расстановки коэффициентов в ОВР:
3. Выписать подчеркнутые элементы, определить число отданных
или принятых электронов:
S-2 -6e S+4
O2 0+4e 2O-2
S-2 -6e S+4
O2 0+4e 2O-2
Слайд 12Алгоритм расстановки коэффициентов в ОВР:
4. Определить НОК и поставить коэффициенты перед
атомами окислителя и восстановителя.
S-2 -6e S+4 \ 6 \ 2
O02+4e 2O-2 \ 4 \ 3
Слайд 13Алгоритм расстановки коэффициентов в ОВР:
5. Поставить коэффициенты, в последнюю очередь подсчитать
число атомов водорода и кислорода.
2H+12S-2+3O02 2S+4O-22+2H+12O-
2H+12S-2+3O02 2S+4O-22+2H+12O-
Слайд 14Алгоритм расстановки коэффициентов в ОВР:
6. Определить окислитель и восстановитель, процессы окисления
и восстановления.
восстановитель S-2 -6e S+4 \ 6 \ 2 окисление
Окислитель 002+4e 2O-2 \ 4 \ 3 восстановление
восстановитель S-2 -6e S+4 \ 6 \ 2 окисление
Окислитель 002+4e 2O-2 \ 4 \ 3 восстановление
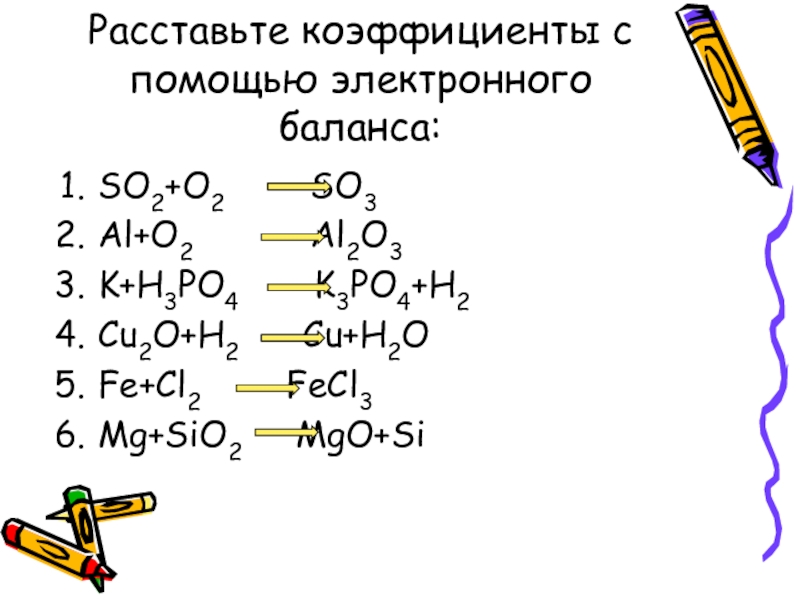
Слайд 15Расставьте коэффициенты с помощью электронного баланса:
SO2+O2 SO3
Al+O2
Al2O3
K+H3PO4 K3PO4+H2
Cu2O+H2 Cu+H2O
Fe+Cl2 FeCl3
Mg+SiO2 MgO+Si
K+H3PO4 K3PO4+H2
Cu2O+H2 Cu+H2O
Fe+Cl2 FeCl3
Mg+SiO2 MgO+Si
Слайд 16Установите соответствие между формулой веществ и степенью окисления азота
А) HNO3
Б)
N2O4
В) (NH4)2CO3
Г) KNO2
В) (NH4)2CO3
Г) KNO2
+2
+3
+4
+5
-2
-3
Слайд 17Установите соответствие между схемой реакции и степенью окисления окислителя
А) C+O2
CO2
Б) CO2+C CO
В) CuO+C Cu+CO
Г) CH4+H2O CO+H2
Б) CO2+C CO
В) CuO+C Cu+CO
Г) CH4+H2O CO+H2
-4
+2
+1
0
+4
-2