- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Соли 8 класс
Содержание
- 1. Презентация по химии Соли 8 класс
- 2. Соли - сложные вещества, состоящие из атомов металлов и кислотных остатков.MenAmnm
- 3. СОЛИСредниеNa2CO3КислыеNaHCO3ОсновныеАl(ОН)2Сl СмешанныеСаClBr ДвойныеKNaSO4 КомплексныеK4[Fe(CN)6] Классификация солей по составу
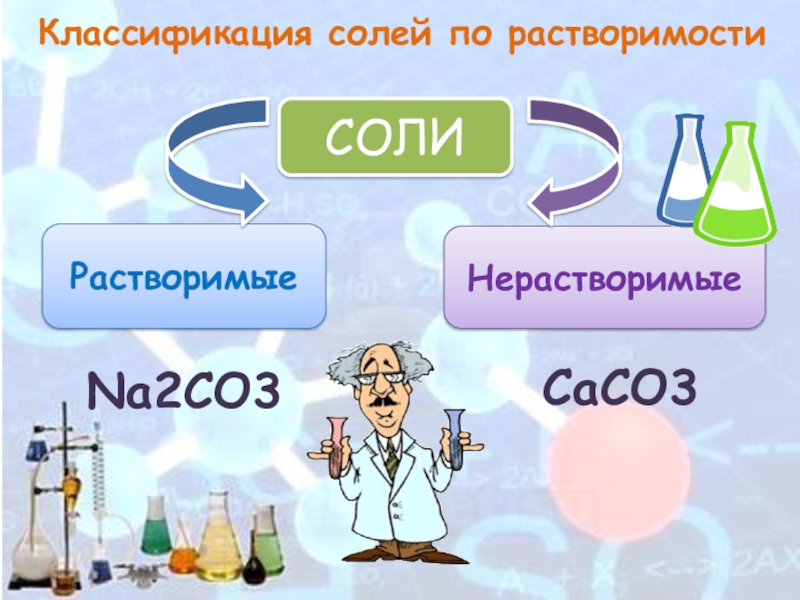
- 4. Классификация солей по растворимостиСОЛИРастворимыеНерастворимыеNa2CO3СаCO3
- 5. Названия солейДля средней соли - название кислотного
- 6. Получение солей1.кислота + основание = соль +
- 7. 5. металл + неметалл = сольПолучение солейFe + S = FeS6. металл1 + соль1 = металл2 + соль2Fe + CuCl2 = Cu + FeCl2
- 8. 8. кислотный оксид + щелочь = соль
- 9. Химические свойства солей1. металл1 + соль1 = металл2 + соль2Zn
- 10. Химические свойства солей3. кислота + соль =
- 11. Химические свойства солейNa2CO3 + SiO2 → Na2SiO3 + СО2 ↑ 5.
- 12. Слайд 12
Слайд 1СОЛИ
Учитель химии
Скиба О.Н.
Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа №2»
г. Новокузнецк, 2019
Слайд 3СОЛИ
Средние
Na2CO3
Кислые
NaHCO3
Основные
Аl(ОН)2Сl
Смешанные
СаClBr
Двойные
KNaSO4
Комплексные
K4[Fe(CN)6]
Классификация солей по составу
Слайд 5Названия солей
Для средней соли - название кислотного остатка + название металла
CuSO4- сульфат меди (II)
Na2SO4- сульфат натрия
Для кислой соли – «гидро» или «дигидро» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
Для основной соли – «гидроксо» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
NaHSO4 – гидросульфат натрия
Mg(OH)Cl - гидроксохлорид магния
NaH2PO4 – дигидроортофосфат натрия
Слайд 6Получение солей
1.кислота + основание = соль + вода
H2SO4 +2NaOH =
2.кислота + металл = соль + водород
2HCl +Zn = ZnCl2 + H2
3.кислота + основный оксид = соль + вода
2HCl + CuO = CuCl2 + H2O
4.кислота + соль = новая кислота + новая соль
H2SO4 + BaCl2 = 2HCl + BaSO4
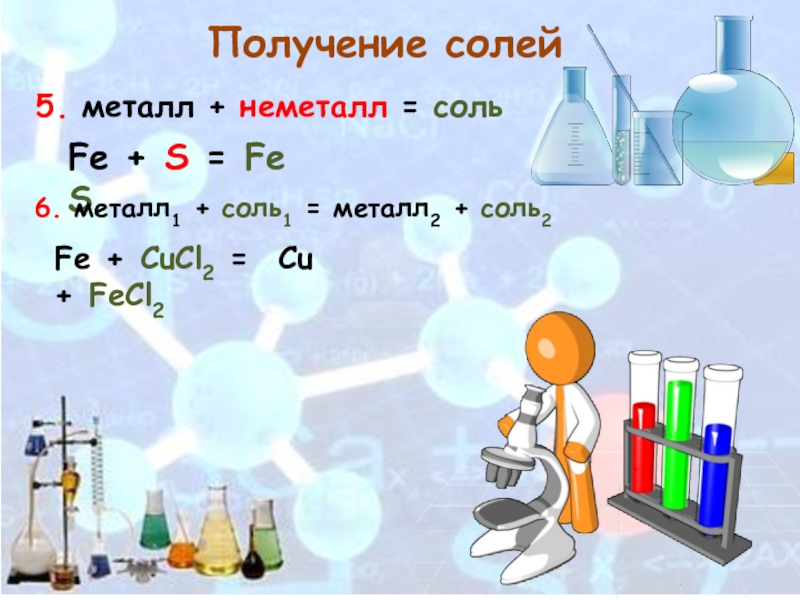
Слайд 75. металл + неметалл = соль
Получение солей
Fe + S = FeS
6. металл1 + соль1 = металл2 + соль2
Fe + CuCl2 =
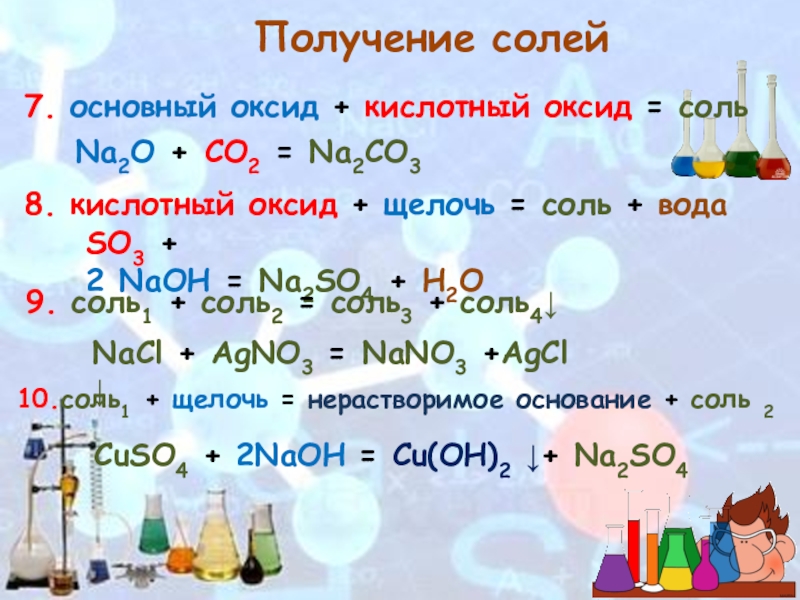
Слайд 88. кислотный оксид + щелочь = соль + вода
SO3 + 2 NaOH = Na2SO4 + H2O
7. основный
Na2O + CO2 = Na2CO3
Получение солей
9. соль1 + соль2 = соль3 + соль4↓
NaCl + AgNO3 = NaNO3 +AgCl ↓
10.соль1 + щелочь = нерастворимое основание + соль 2
CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4
Слайд 9Химические свойства солей
1. металл1 + соль1 = металл2 + соль2
Zn + FeSO4 = ZnSO4
Растворы солей взаимодействуют с металлами, расположенными в ряду напряжений левее, чем металл, входящий в состав соли.
2. соль1 + щелочь = нерастворимое основание + соль 2
FeSO4 + 2KOH = Fe(OH)2 + K2SO4
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
Слайд 10Химические свойства солей
3. кислота + соль = новая кислота + новая
Реакции обмена между кислотами и солями возможны, если в результате образуется практически нерастворимое в воде вещество (выпадает осадок), образуется летучее вещество (газ).
4. соль1 + соль2 = соль3 + соль4
BaCI2 + Na2SO4 = BaSO4 + 2NaCI
Реакции обмена между растворами солей возможны, если в результате образуется практически нерастворимое в воде вещество (выпадает осадок).
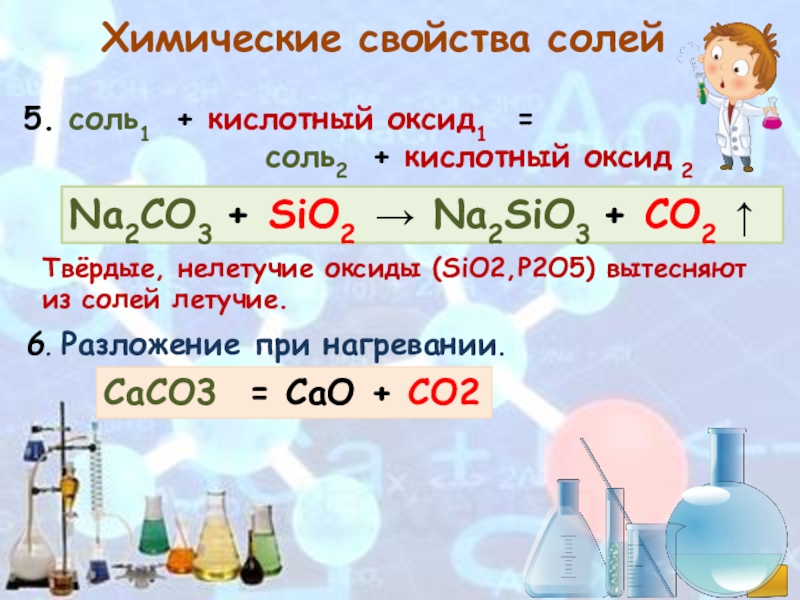
Слайд 11Химические свойства солей
Na2CO3 + SiO2 → Na2SiO3 + СО2 ↑
5. соль1 + кислотный оксид1
соль2 + кислотный оксид 2
Твёрдые, нелетучие оксиды (SiO2,P2O5) вытесняют из солей летучие.
6. Разложение при нагревании.
СаСO3 = СаO + СО2


![Презентация по химии Соли 8 класс СОЛИСредниеNa2CO3КислыеNaHCO3ОсновныеАl(ОН)2Сl СмешанныеСаClBr ДвойныеKNaSO4 КомплексныеK4[Fe(CN)6] Классификация солей по составу СОЛИСредниеNa2CO3КислыеNaHCO3ОсновныеАl(ОН)2Сl СмешанныеСаClBr ДвойныеKNaSO4 КомплексныеK4[Fe(CN)6] Классификация солей по составу](/img/thumbs/5c3c9afcc807abb230d2bd559ca3fa53-800x.jpg)