- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии по теме: Оксиды азота
Содержание
- 1. Презентация по химии по теме: Оксиды азота
- 2. Оксиды азота:Несолеобразующие:N₂O – оксид азота (I)NO –
- 3. N₂O – оксид азота (I) Физические свойства:
- 4. NO – оксид азота (II) Физические свойства:
- 5. NO – оксид азота (II)Химические свойства:На воздухе
- 6. NO₂ - оксид азота (IV) Физические свойства:Газ
- 7. NO₂ - оксид азота (IV)ПолучениеВ лаборатории:Cu +
- 8. N₂O₃ - оксид азота (III)Физические свойства:Темно-синяя
Оксиды азота:Несолеобразующие:N₂O – оксид азота (I)NO – оксид азота (II)Солеобразующие:N₂O₃ - оксид азота (III)NO₂ - оксид азота (IV)N₂O₄ - димер оксида азота (IV)N₂O₅ - оксид азота (V)Все оксиды азота, кроме N₂O, ядовитые вещества
Слайд 2Оксиды азота:
Несолеобразующие:
N₂O – оксид азота (I)
NO – оксид азота (II)
Солеобразующие:
N₂O₃ -
оксид азота (III)
NO₂ - оксид азота (IV)
N₂O₄ - димер оксида азота (IV)
N₂O₅ - оксид азота (V)
NO₂ - оксид азота (IV)
N₂O₄ - димер оксида азота (IV)
N₂O₅ - оксид азота (V)
Все оксиды азота, кроме N₂O, ядовитые вещества
Слайд 3N₂O – оксид азота (I)
Физические свойства:
Бесцветный газ со слабым запахом
и сладковатым вкусом, хорошо растворим в воде, но не взаимодействует с ней
Химические свойства:
При высокой температуре разлагается
N₂O → N₂ + O₂
Применение:
В смеси с кислородом N₂O используется в медицине для наркоза («веселящий газ»)
Химические свойства:
При высокой температуре разлагается
N₂O → N₂ + O₂
Применение:
В смеси с кислородом N₂O используется в медицине для наркоза («веселящий газ»)
Слайд 4NO – оксид азота (II)
Физические свойства:
Бесцветный газ, не имеет запаха.
В воде мало растворим.
Получение:
1) При высокой температуре: N₂ + O₂ → 2NO
2) В лаборатории:
Cu + HNO₃ (разб.) → Cu(NO₃)₂ + NO + H₂O
3) В промышленности: NH₃ + O₂ → NO + H₂O
Условия: температура, давление, катализатор
Получение:
1) При высокой температуре: N₂ + O₂ → 2NO
2) В лаборатории:
Cu + HNO₃ (разб.) → Cu(NO₃)₂ + NO + H₂O
3) В промышленности: NH₃ + O₂ → NO + H₂O
Условия: температура, давление, катализатор
Слайд 5NO – оксид азота (II)
Химические свойства:
На воздухе легко окисляется до оксида
азота (IV)
NO + O₂→ NO₂
Применение:
NO – оксид азота (II) используют в промышленности для получения азотной кислоты
NO + O₂→ NO₂
Применение:
NO – оксид азота (II) используют в промышленности для получения азотной кислоты
Слайд 6NO₂ - оксид азота (IV)
Физические свойства:
Газ бурого цвета, имеет характерный запах.
Хорошо растворяется в воде. NO₂ - смешанный оксид, ему соответствует 2 кислоты: азотистая HNO₂ и азотная HNO₃
Химические свойства:
С водой:
а) NO₂ + H₂O → HNO₂ + HNO₃
б) NO₂ + H₂O + O₂ → HNO₃
2) Со щелочью:
a) NO₂ + NaOH → NaNO₂ + NaNO₃ + H₂O
б) NO₂ + NaOH + O₂ → NaNO₃ + H₂O
Химические свойства:
С водой:
а) NO₂ + H₂O → HNO₂ + HNO₃
б) NO₂ + H₂O + O₂ → HNO₃
2) Со щелочью:
a) NO₂ + NaOH → NaNO₂ + NaNO₃ + H₂O
б) NO₂ + NaOH + O₂ → NaNO₃ + H₂O
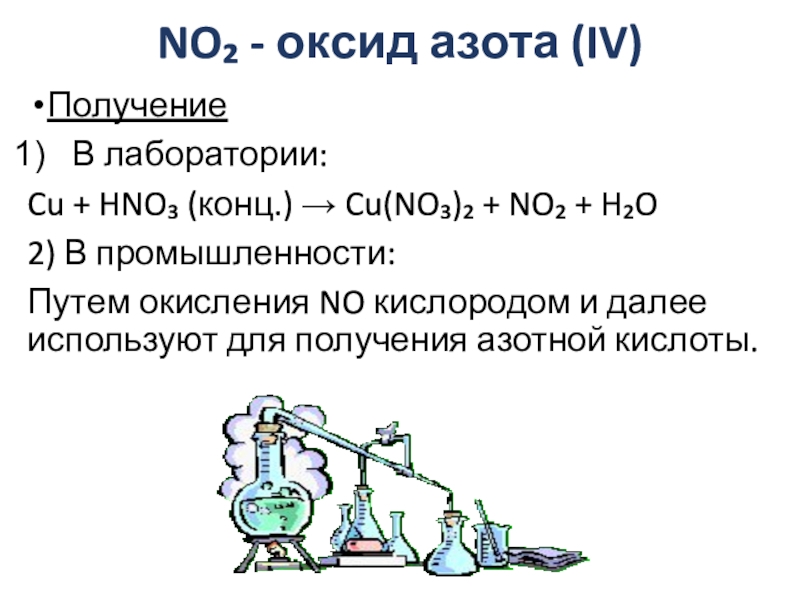
Слайд 7NO₂ - оксид азота (IV)
Получение
В лаборатории:
Cu + HNO₃ (конц.) → Cu(NO₃)₂
+ NO₂ + H₂O
2) В промышленности:
Путем окисления NO кислородом и далее используют для получения азотной кислоты.
2) В промышленности:
Путем окисления NO кислородом и далее используют для получения азотной кислоты.
Слайд 8
N₂O₃ - оксид азота (III)
Физические свойства:
Темно-синяя жидкость, является кислотным оксидом.
Химические
свойства:
При взаимодействии с водой образуется азотистая кислота
N₂O₅ - оксид азота (V)
Физические свойства:
Бесцветные кристаллы, хорошо растворимые в воде
Химические свойства:
При взаимодействии с водой образуется азотная кислота
При взаимодействии с водой образуется азотистая кислота
N₂O₅ - оксид азота (V)
Физические свойства:
Бесцветные кристаллы, хорошо растворимые в воде
Химические свойства:
При взаимодействии с водой образуется азотная кислота