- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Основания, их классификация и свойства
Содержание
- 1. Презентация по химии Основания, их классификация и свойства
- 2. Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид-ионов.
- 3. гироксид кальция Ca(OH)2гидроксид меди (II) Cu(OH)2 гидроксид
- 4. Единственное жидкое основание – гидроксид аммония NH4OH или водный раствор аммиака.гидроксид аммония NH4OH
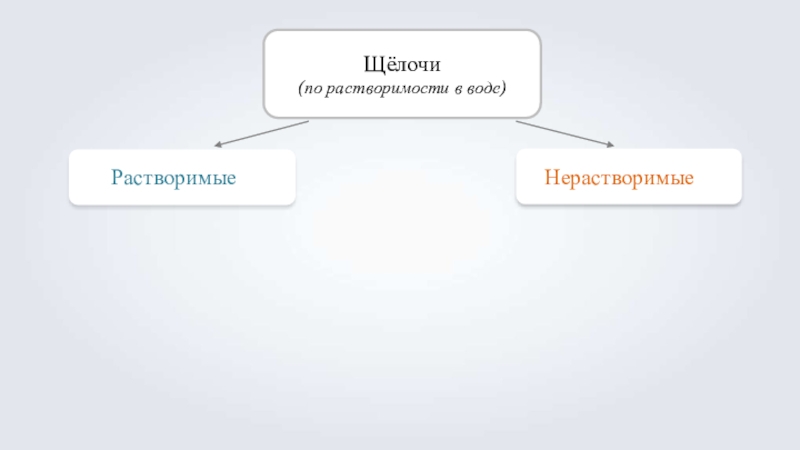
- 5. Щёлочи(по растворимости в воде)РастворимыеНерастворимые
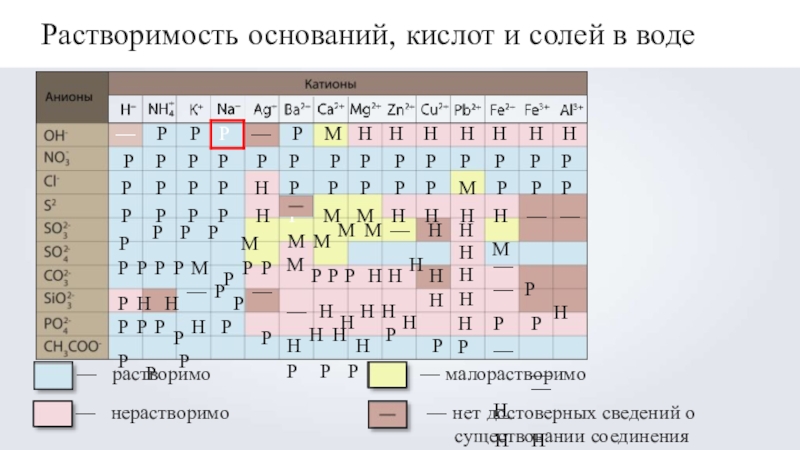
- 6. Растворимость оснований, кислот и солей в водерастворимонерастворимо—
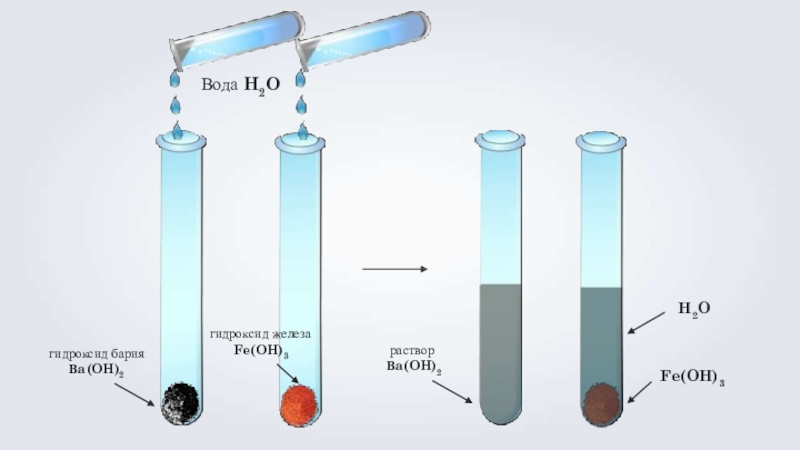
- 7. гидроксид барияВa(OH)2гидроксид железаFe(OH)3Вода H2OрастворВa(OH)2Fe(OH)3H2O
- 8. ОснованияРастворимыегидроксид лития LiOH гидроксид калия KOH гидроксид
- 9. Щёлочи(по степени электролитической диссоциации основания )Cильныев водных
- 10. ОН-изменение химические свойствамылкость на ощупьизменение окраскииндикаторов(лакмуса, метилового оранжевогои фенолфталеина)
- 11. Щёлочи(по степени электролитической диссоциации основания )Cильныев водных
- 12. ОснованияСильныегидроксид лития LiOH гидроксид калия KOH гидроксид натрия NaOHСлабыегидроксид аммония NH4OH
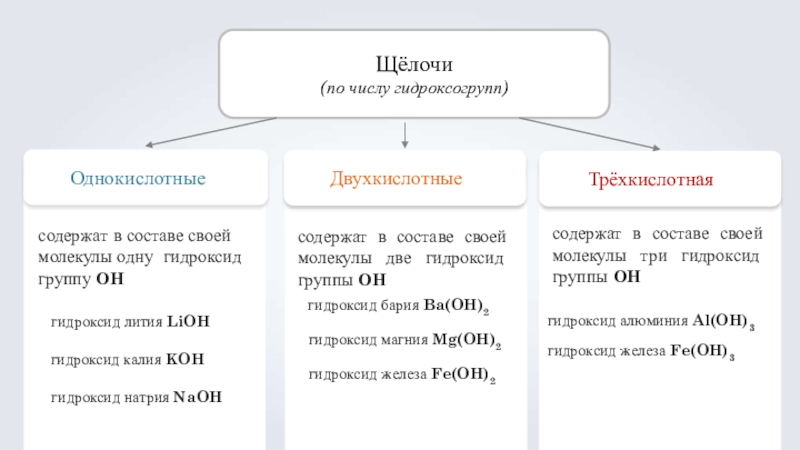
- 13. Щёлочи(по числу гидроксогрупп)Однокислотныесодержат в составе своей молекулы
- 14. При электролитической диссоциации основания диссоциируют на катионы металла и гидроксо-группы.NaOH → Na+ + OH-
- 15. Диссоциация однокислотных основанийLiOH =Li++OH-При диссоциации молекулы однокислотногооснования образуется один гидроксид-анион.
- 16. При диссоциации молекулы двухкислотногооснования образуется два гидроксид-аниона.Диссоциация двухкислотных основанийBa(OH)2 =Ba2++2OH-
- 17. При диссоциации молекулы трехкислотногооснования образуется три гидроксид-аниона.Диссоциация трёхкислотных основанийAl(OH)3 =Al3++3OH-
- 18. Классификация оснований основана на их:растворимости в воде,степени
Слайд 2Основания – это сложные вещества, состоящие из ионов металлов и связанных
Слайд 3гироксид кальция Ca(OH)2
гидроксид меди (II) Cu(OH)2 гидроксид никеля (II) Ni(OH)2 гидроксид
Все основания – это твердые вещества различные по окраске.
Слайд 4Единственное жидкое основание – гидроксид аммония NH4OH или водный раствор аммиака.
гидроксид
Слайд 6Растворимость оснований, кислот и солей в воде
растворимо
нерастворимо
— малорастворимо
— нет достоверных сведений
Н Н Н
Н Н Р
Р Р Р Р М
Р Р Р Р М Р Р Р Р Н Н — Р Р — Р Р Р Р Н Р Р Р Р Р
М М М М — Н М Р Р Р Н Н Н Н — Н Н Н Н Н Н Н Н Н Н Р Р Р Р Р
М — — Р Р Р Н — —
Н — —
Н Н Н
Р Р Р
Слайд 8Основания
Растворимые
гидроксид лития LiOH гидроксид калия KOH гидроксид натрия NaOH гидроксид аммония
Нерастворимые
гидроксид алюминия Al(OH)3 гидроксид магния Mg(OH)2 гидроксид железа (II) Fe(OH)2 гидроксид цинка (II) Zn(OH)2 гидроксид меди (II) Сu(OH)2
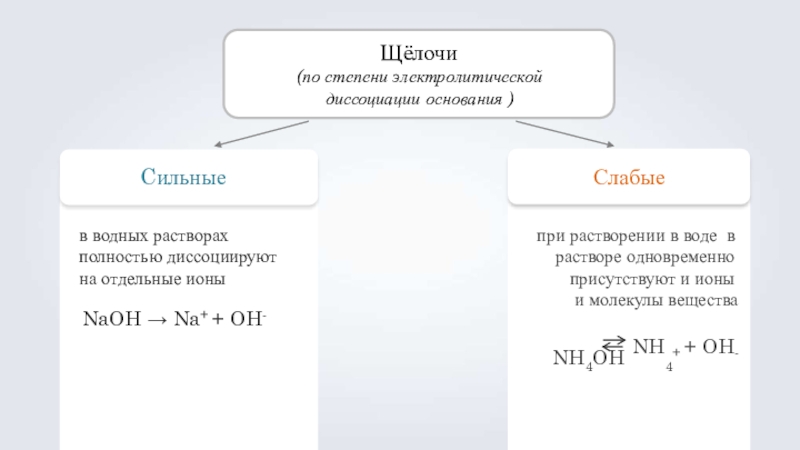
Слайд 9Щёлочи
(по степени электролитической диссоциации основания )
Cильные
в водных растворах полностью диссоциируют на
NaOH → Na+ + OH-
Слабые
при растворении в воде в растворе одновременно присутствуют и ионы
и молекулы вещества
NH4OH NH4+ + OH-
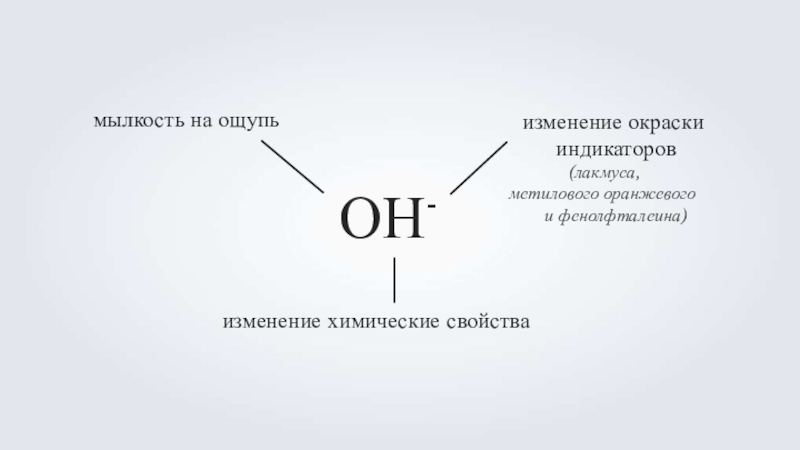
Слайд 10ОН-
изменение химические свойства
мылкость на ощупь
изменение окраски
индикаторов
(лакмуса, метилового оранжевого
и фенолфталеина)
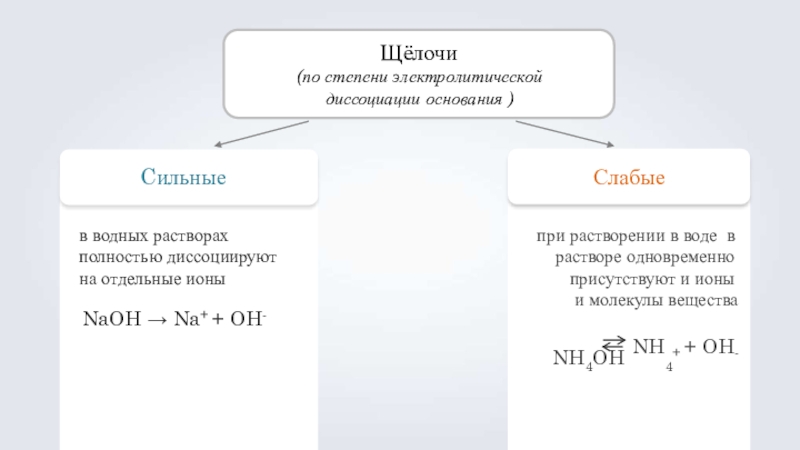
Слайд 11Щёлочи
(по степени электролитической диссоциации основания )
Cильные
в водных растворах полностью диссоциируют на
NaOH → Na+ + OH-
Слабые
при растворении в воде в растворе одновременно присутствуют и ионы
и молекулы вещества
NH4OH NH4+ + OH-
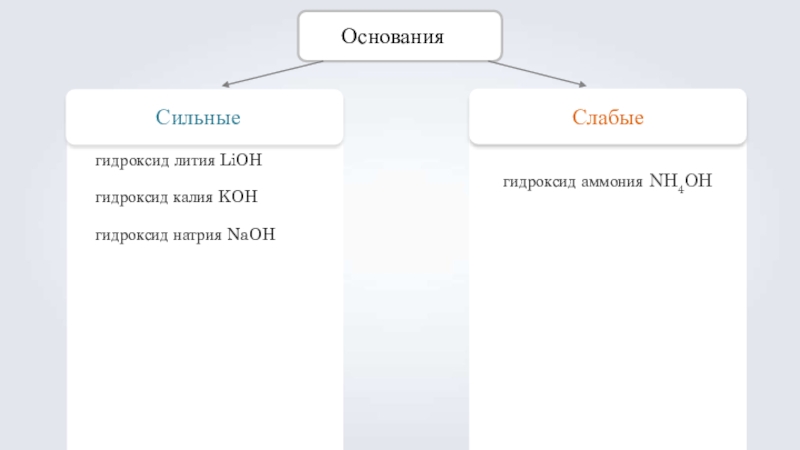
Слайд 12Основания
Сильные
гидроксид лития LiOH гидроксид калия KOH гидроксид натрия NaOH
Слабые
гидроксид аммония NH4OH
Слайд 13Щёлочи
(по числу гидроксогрупп)
Однокислотные
содержат в составе своей молекулы одну гидроксид группу ОН
Двухкислотные
Трёхкислотная
гидроксид
гидроксид калия KOH
гидроксид натрия NaOH
содержат в составе своей молекулы две гидроксид группы ОН
гидроксид бария Ba(OH)2 гидроксид магния Mg(OH)2 гидроксид железа Fe(OH)2
содержат в составе своей молекулы три гидроксид группы ОН
гидроксид алюминия Al(OH)3
гидроксид железа Fe(OH)3
Слайд 14При электролитической диссоциации основания диссоциируют на катионы металла и гидроксо-группы.
NaOH →
Слайд 15Диссоциация однокислотных оснований
LiOH =
Li+
+
OH-
При диссоциации молекулы однокислотного
основания образуется один гидроксид-анион.
Слайд 16При диссоциации молекулы двухкислотного
основания образуется два гидроксид-аниона.
Диссоциация двухкислотных оснований
Ba(OH)2 =
Ba2+
+
2OH-
Слайд 17При диссоциации молекулы трехкислотного
основания образуется три гидроксид-аниона.
Диссоциация трёхкислотных оснований
Al(OH)3 =
Al3+
+
3OH-
Слайд 18Классификация оснований основана на их:
растворимости в воде,
степени электролитической диссоциации и числе
Общие свойства оснований основаны на наличии гидроксогрупп ОН.