- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Строение атома
Содержание
- 1. Презентация по химии на тему: Строение атома
- 2. Возникновение понятия «атом»Понятие «атом» впервые появилось в
- 3. Экспериментальные данные, свидетельствующие о делимости атомаОткрытие электрона 1891г.Открытие явления радиоактивности 1896г.Опыт Эрнеста Резерфорда 1911г.
- 4. Ранние модели строения атома«Пудинг с изюмом» (1902-1904
- 5. Модель атома ТомсонаОдну из первых моделей атома
- 6. Планетарная модель атома Э. РезерфордаАтом состоит из
- 7. Квантовые постулаты Н. Бора 1913г.1. Электрон вращается
- 8. Протонно-нейтронная модель ядра1932 г. советские ученые Е.Н.
- 9. Современная модель атомаАтом – электронейтральная частицаЯдро атома
- 10. Атом - - Электронейтральная система взаимодействующих частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов.
- 11. Строение атомовАтомЯдросостоит из нуклонов (протонов и нейтронов).состоит из электронов. Электронная оболочкаОпределяет массу атома.m(ядра) ≈ m(атома).R(ядра)
- 12. Состав атома Атомы химических элементов состоят из трех
- 13. ИзотопыИзотопы – совокупность атомов, имеющих одинаковое число
- 14. Количественная характеристика атомовА – массовое число атомаZ
- 15. Опишите характеристики и состав атомовМасса атомов: 14
- 16. Важные понятияЭлектронное облако – пространство около ядра
- 17. Квантовые числаКвантовые числа описывают состояние электрона в
- 18. Наибольшее число электронов на энергетическом уровне определяется
- 19. Квантовые числаl – побочное квантовое число; уточняет
- 20. Квантовые числаm1 – магнитное орбитальное квантовое числосоответствует
- 21. Квантовые числаms – магнитное спиновое квантовое число
- 22. Принципы заполнения электронных оболочекПринцип минимальной энергии:принцип Паулиправило Хундаправило Клечковского
- 23. Принцип ПаулиВ атоме на одной орбитали может находится не белее двух электронов, имеющих противоположные спины
- 24. Несоблюдение правила ХундаСуммарный спин должен быть максимальным, что соответствует минимальному значению энергии.
- 25. Правило КлечковскогоЗаполнение электронами орбиталей в атоме происходит
- 26. Электронные семействаs-элементы, если заполняется
- 27. Электронная формулаЭлектронная формула атома химического элемента показывает
- 28. Электронная формула
- 29. «Провал» электронаВ атомах некоторых элементов электрон с
- 30. ЗаданиеОпределить элемент:Составить электронные и электронно-графические формулы элемента:
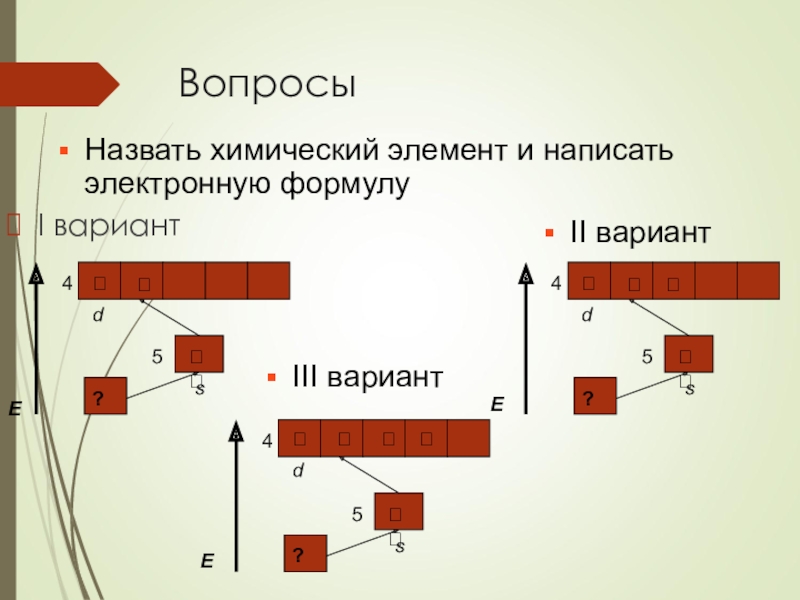
- 31. ВопросыI вариантНазвать химический элемент и написать электронную формулуIII вариант
Слайд 2Возникновение понятия «атом»
Понятие «атом» впервые появилось в работах древнегреческих философов Демокрита
Демокрит
(ок. 460–370 до н.э.)
Древнегреческий ученый
Слайд 3Экспериментальные данные, свидетельствующие о делимости атома
Открытие электрона 1891г.
Открытие явления радиоактивности 1896г.
Опыт
Слайд 4Ранние модели строения атома
«Пудинг с изюмом»
(1902-1904 г. Дж. Томсон)
«Планетарная» (1907 г.
«Модель Бора» (1913 г.)
Слайд 5Модель атома Томсона
Одну из первых моделей атома предложил английский физик Дж.
По Томсону атом – равномерно заполненный положительным зарядом шар, внутри которого находятся электроны.
Не объясняла явление радиоактивности и нуждалась в экспериментальной проверке.
Джозеф Джон Томсон
1856 – 1940
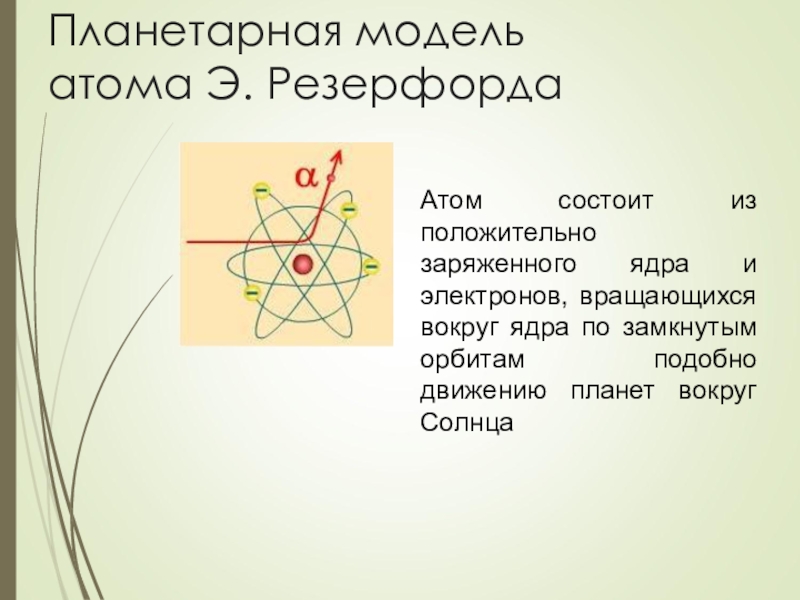
Слайд 6Планетарная модель атома Э. Резерфорда
Атом состоит из положительно заряженного ядра и
Слайд 7Квантовые постулаты Н. Бора 1913г.
1. Электрон вращается вокруг ядра по строго
2. Электрон переходит из одного «разрешенного» энергетического состояния в другое, что сопровождается излучением или поглощением кванта энергии.
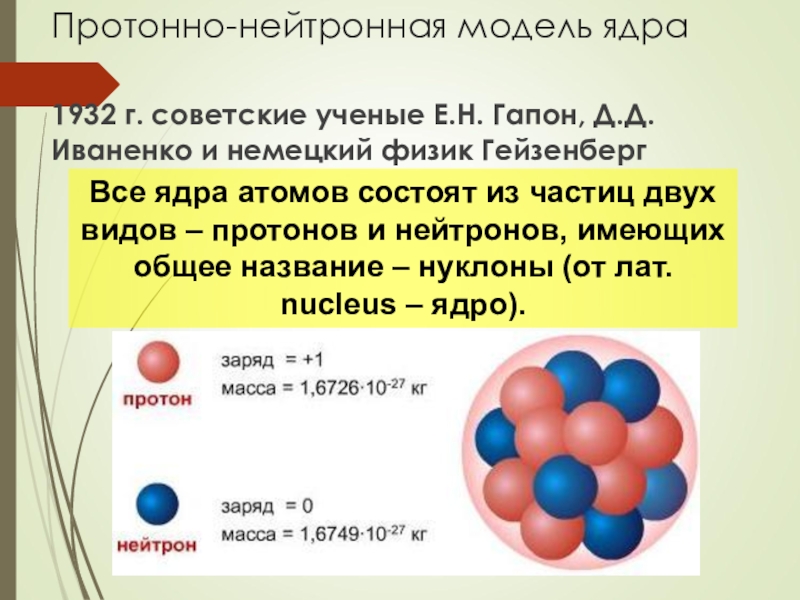
Слайд 8Протонно-нейтронная модель ядра
1932 г. советские ученые Е.Н. Гапон, Д.Д.Иваненко и немецкий
Все ядра атомов состоят из частиц двух видов – протонов и нейтронов, имеющих общее название – нуклоны (от лат. nucleus – ядро).
Слайд 9Современная модель атома
Атом – электронейтральная частица
Ядро атома – положительно заряженное
Электроны –
Электроны вращаются вокруг ядра с определённой скоростью
Электроны имеют двойственную природу
Слайд 10Атом -
- Электронейтральная система взаимодействующих частиц, состоящая из ядра (образованного
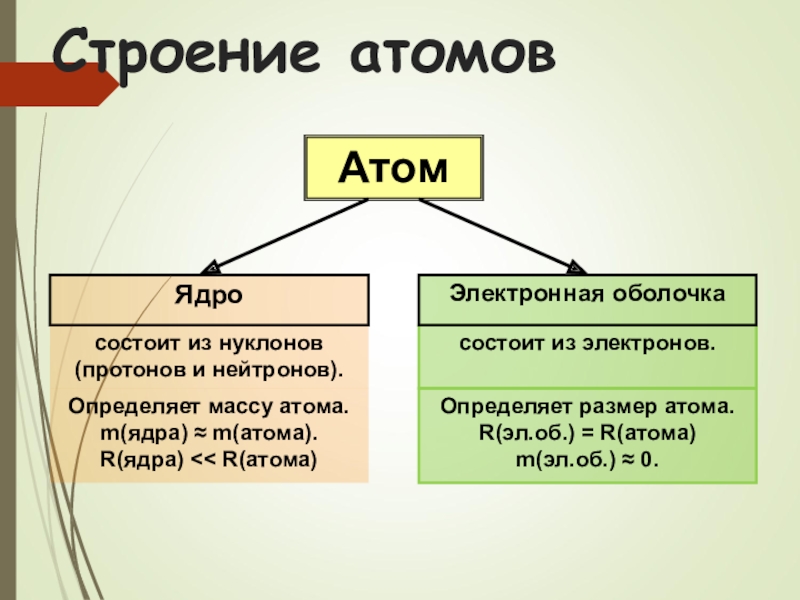
Слайд 11Строение атомов
Атом
Ядро
состоит из нуклонов (протонов и нейтронов).
состоит из электронов.
Электронная оболочка
Определяет
m(ядра) ≈ m(атома).
R(ядра) << R(атома)
Определяет размер атома.
R(эл.об.) = R(атома)
m(эл.об.) ≈ 0.
Слайд 12Состав атома
Атомы химических элементов состоят из трех частиц:
протоны
или р+
нейтроны
электроны
или е–
Заряд ядра определяется количеством протонов
Количество протонов соответствует порядковому номеру элемента в ПСХЭ
Слайд 13Изотопы
Изотопы – совокупность атомов, имеющих одинаковое число протонов, но различающихся количеством
Изотопы различны атомной массой (А)
Число нейтронов определяется по формуле: N = A – Z, где Z – порядковый номер элемента
Слайд 14Количественная характеристика атомов
А – массовое число атома
Z – зарядовое число атома
Масса
Заряд ядра: + 3
Состав ядра:
число протонов: 3
число нейтронов: 4
Число электронов: 3
Слайд 15Опишите характеристики и состав атомов
Масса атомов: 14 а.е.м.
Заряд ядра: + 6
Состав
число протонов: 6
число нейтронов: 8
Число электронов: 6
Слайд 16Важные понятия
Электронное облако – пространство около ядра атома, где сосредоточены вся
Атомная орбиталь – часть э.о., где сосредоточено >90% электронной плотности
Радиус АО – расстояние от ядра атома до максимальной электронной плотности
Слайд 17Квантовые числа
Квантовые числа описывают состояние электрона в атоме
n – главное квантовое
Номер периода в ПСХЭ соответствует количеству энергетических уровней в атоме, n принимает целые значения
Слайд 18Наибольшее число электронов на энергетическом уровне определяется по формуле:
N=2n2,
где N- максимальное
На первом энергетическом уровне может находиться не более двух электронов
На втором - ?
На третьем - ?
На четвёртом - ?
Слайд 19Квантовые числа
l – побочное квантовое число; уточняет запас энергии электрона на
l=0 – подуровень s, форма орбитали сферическая
l=1 – подуровень p, объёмная форма орбитали
l=2 – подуровень d, более сложная форма орбитали
l=3 – подуровень f, более сложная форма орбитали
Номер энергетического уровня соответствует количеству подуровней на данном энергетическом уровне
Слайд 20Квантовые числа
m1 – магнитное орбитальное квантовое число
соответствует распределению АО в пространстве
Определяет количество АО
Принимает значения -1, 0, +1
Слайд 21Квантовые числа
ms – магнитное спиновое квантовое число характеризует чисто квантовое свойство
Это собственный момент импульса электрона
Абсолютное значение спина = ½
Проекция спина на ось может иметь лишь два значения: ms=+1/2; ms=-1/2
Слайд 22Принципы заполнения электронных оболочек
Принцип минимальной энергии:
принцип Паули
правило Хунда
правило Клечковского
Слайд 23Принцип Паули
В атоме на одной орбитали может находится не белее двух
Слайд 24Несоблюдение правила Хунда
Суммарный спин должен быть максимальным, что соответствует минимальному значению
Слайд 25Правило Клечковского
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы
Слайд 26Электронные семейства
s-элементы, если
заполняется s-подуровень
p-элементы, если
заполняется
d-элементы, если заполняется d-подуровень
f-элементы, если заполняется f-подуровень
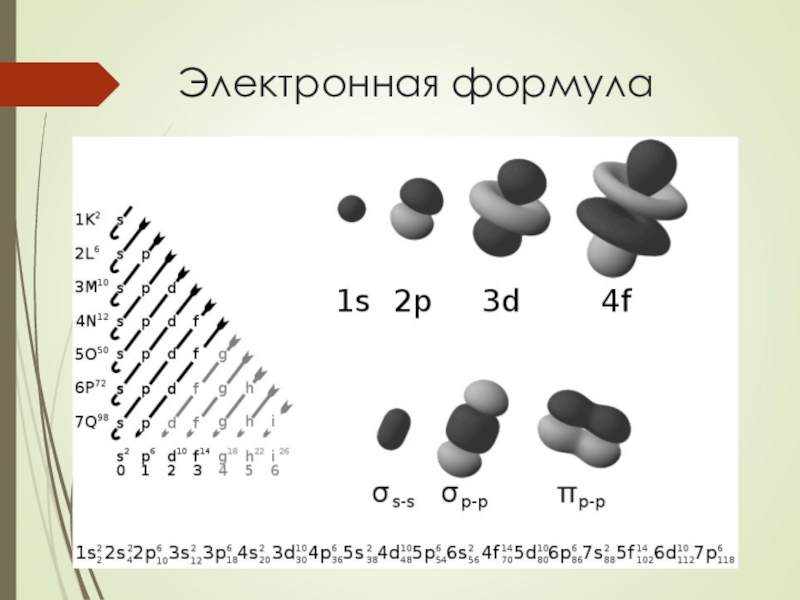
Слайд 27Электронная формула
Электронная формула атома химического элемента показывает как распределяются электроны в
109 Mt мейтнерий 1s22s22p63s23p64s23d104p65s24d105p66s2 4f145d106p67s25f146d7