- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Строение электронных оболочек атомов
Содержание
- 1. Презентация по химии на тему: Строение электронных оболочек атомов
- 2. Электронная оболочка – совокупность всех электронов в
- 3. Подуровни состоят из орбиталей. Число орбиталей на
- 4. Энергетические уровни, содержащие максимальное число электронов, называются
- 5. ЗАПОМНИТЕ!!!!Электроны, расположенные на последней электронной оболочке, называются
- 6. Форма электронных облаков - область наиболее вероятного
- 7. 1 периодН + 11n=1S1 S1Нe + 22n=1S1
- 8. 2 периодLi + 32 1n=1n=21 S2
- 9. 2 периодС + 62 4n=1n=2N +
- 10. 2 периодF + 92 7n=1n=2Ne +
- 11. 3 периодMg + 122 8 2n=1n=2Al
- 12. 3 периодP + 152 8 5n=1n=2S
- 13. 3 периодAr + 182 8 8n=1n=2K
- 14. Слайд 14
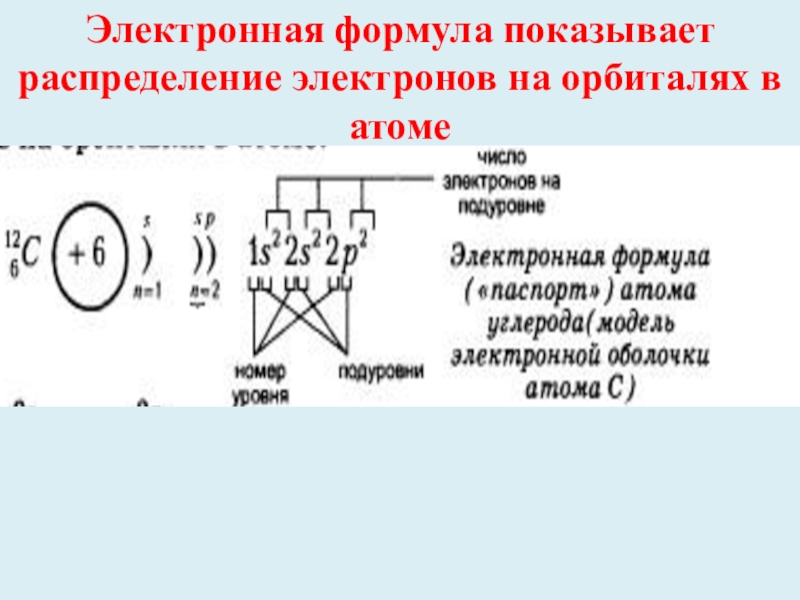
- 15. Электронная формула показывает распределение электронов на орбиталях в атоме
- 16. Принцип минимума энергии при формировании электронной оболочки1s1-22s1-22p1-63s1-23p1-64s1-23d1-104p1-65s1-24d1-105p1-66s1-2
Слайд 2Электронная оболочка – совокупность всех электронов в атоме окружающих ядро
Каждый электрон
Электроны расположены на различном расстоянии от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочки
По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее
Слайд 3
Подуровни состоят из орбиталей. Число орбиталей на уровне - n2
Максимальное
1
2
3
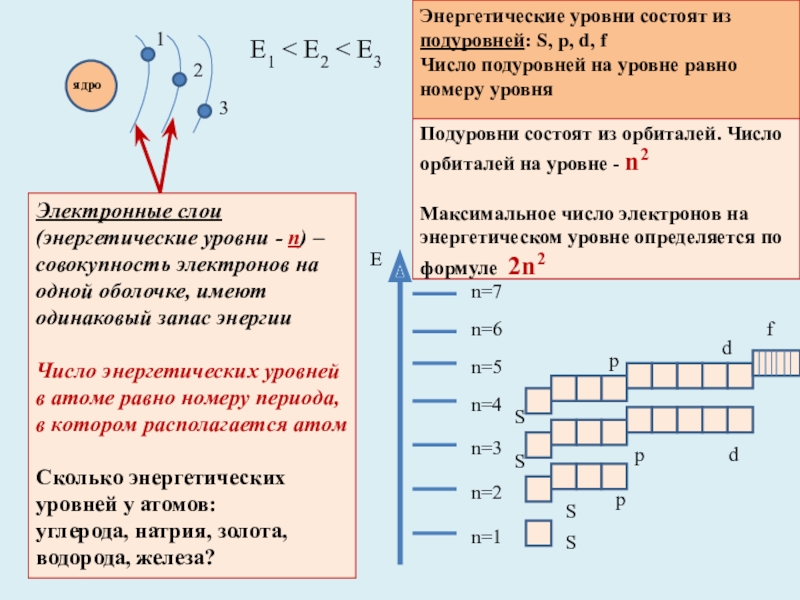
Е1 < E2 < E3
Электронные слои (энергетические уровни - n) – совокупность электронов на одной оболочке, имеют одинаковый запас энергии
Число энергетических уровней в атоме равно номеру периода, в котором располагается атом
Сколько энергетических уровней у атомов:
углерода, натрия, золота, водорода, железа?
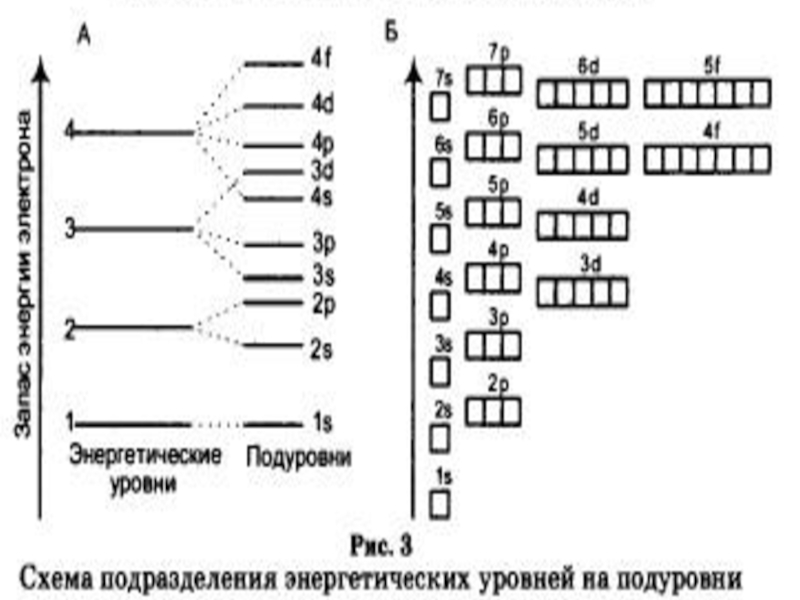
Энергетические уровни состоят из подуровней: S, p, d, f
Число подуровней на уровне равно номеру уровня
Е
n=1
n=2
n=3
n=4
n=5
n=6
n=7
S
p
d
f
S
S
S
p
p
d
ядро
Слайд 4Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной
Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
n=1 – 1 подуровень (s), 2 электрона
n=2 – 2 подуровня (s, р), 8 электронов
n=3 – 3 подуровня (s, р, d), 18 электронов
n=4 – 4 подуровня (s, р, d, f), 32 электрона
Слайд 5ЗАПОМНИТЕ!!!!
Электроны, расположенные на последней электронной оболочке, называются внешними
Число внешних электронов для
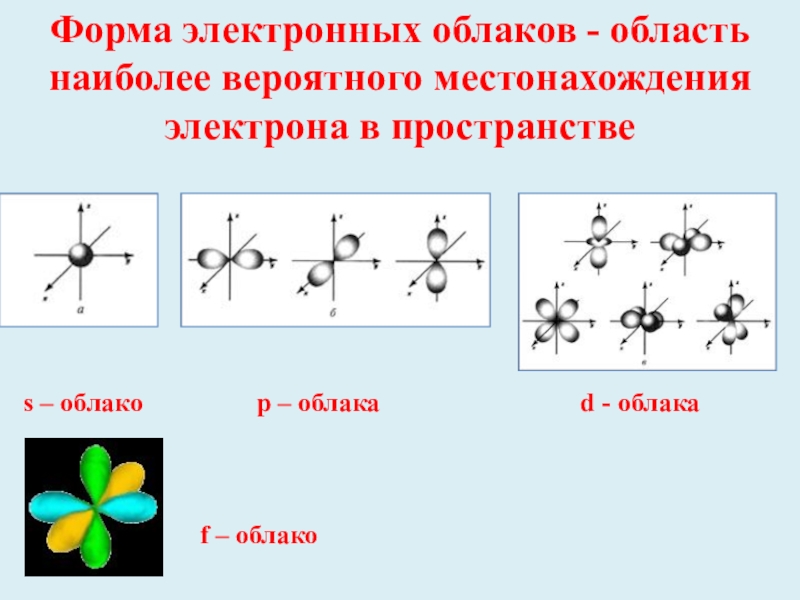
Слайд 6Форма электронных облаков - область наиболее вероятного местонахождения электрона в пространстве
s
f – облако
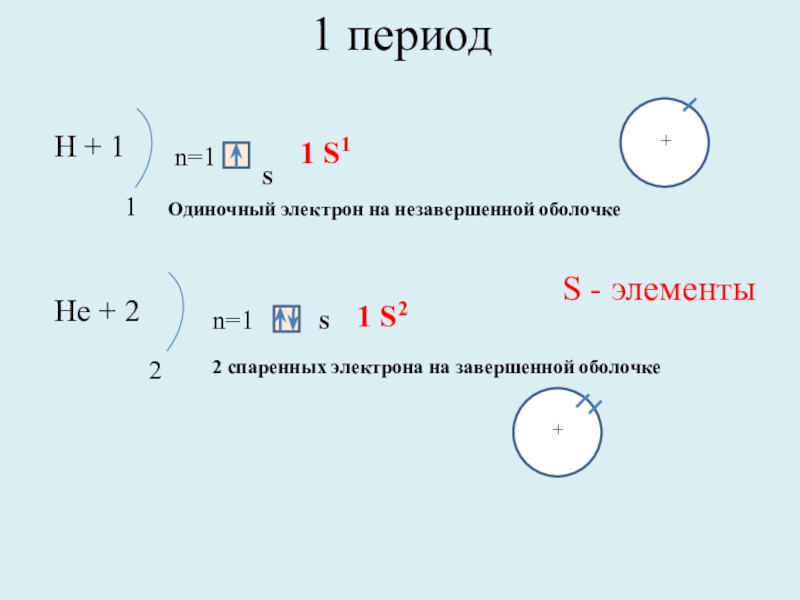
Слайд 71 период
Н + 1
1
n=1
S
1 S1
Нe + 2
2
n=1
S
1 S2
Одиночный электрон на незавершенной
2 спаренных электрона на завершенной оболочке
S - элементы
+
+
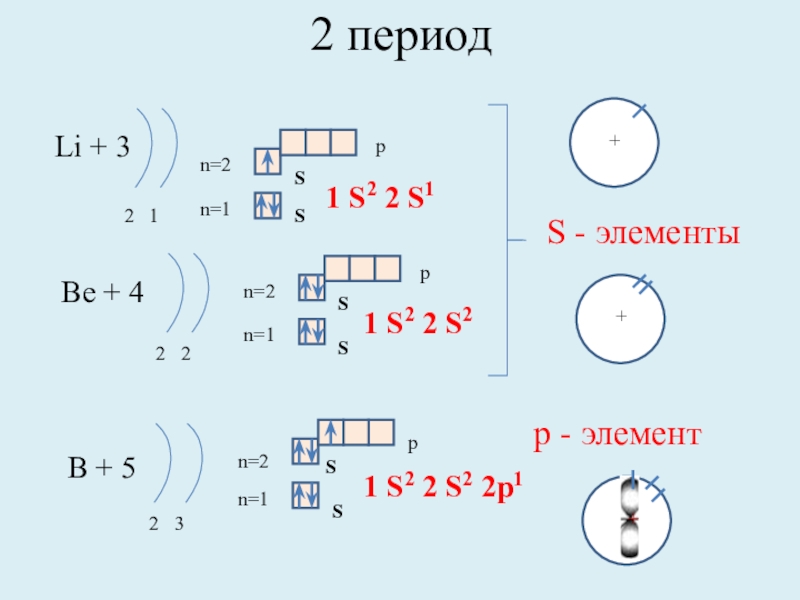
Слайд 82 период
Li + 3
2 1
n=1
n=2
1 S2 2 S1
Be + 4
2
n=1
n=2
1 S2 2 S2
B + 5
2 3
n=1
n=2
1 S2 2 S2 2p1
S - элементы
р - элемент
S
S
S
S
S
S
p
p
p
+
+
+
+
Слайд 92 период
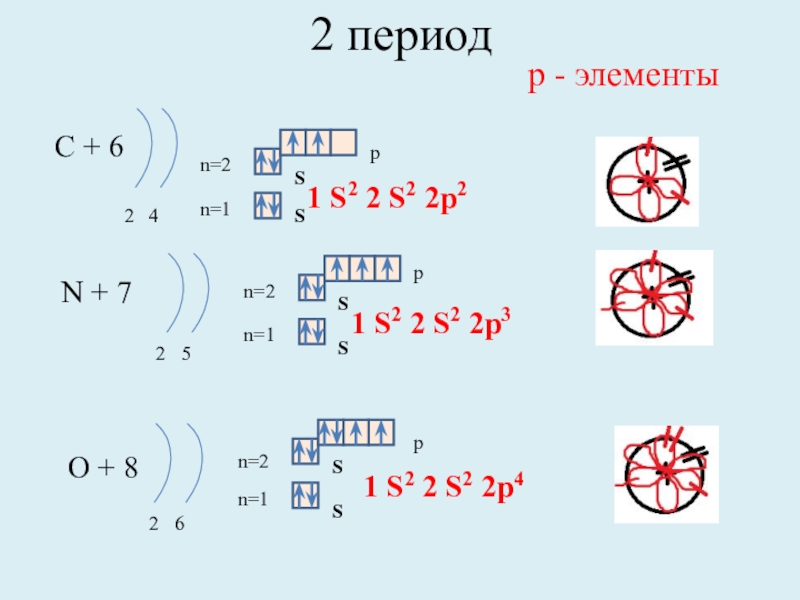
С + 6
2 4
n=1
n=2
N + 7
2 5
n=1
n=2
O +
2 6
n=1
n=2
1 S2 2 S2 2p4
р - элементы
1 S2 2 S2 2p2
1 S2 2 S2 2p3
S
S
S
S
S
S
p
p
p
Слайд 10
2 период
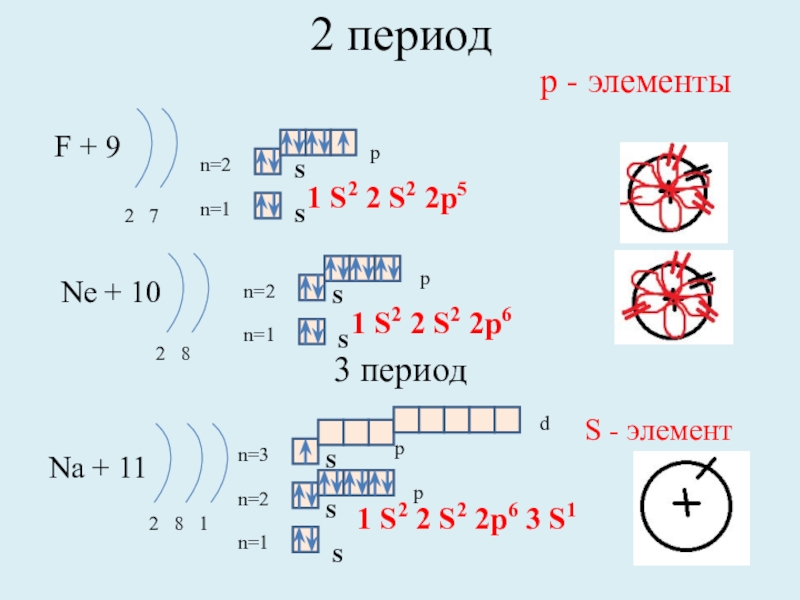
F + 9
2 7
n=1
n=2
Ne + 10
2 8
n=1
n=2
Na +
2 8 1
n=1
n=2
1 S2 2 S2 2p6 3 S1
р - элементы
1 S2 2 S2 2p5
1 S2 2 S2 2p6
3 период
S - элемент
S
S
S
S
S
S
S
p
p
p
p
d
n=3
Слайд 11
3 период
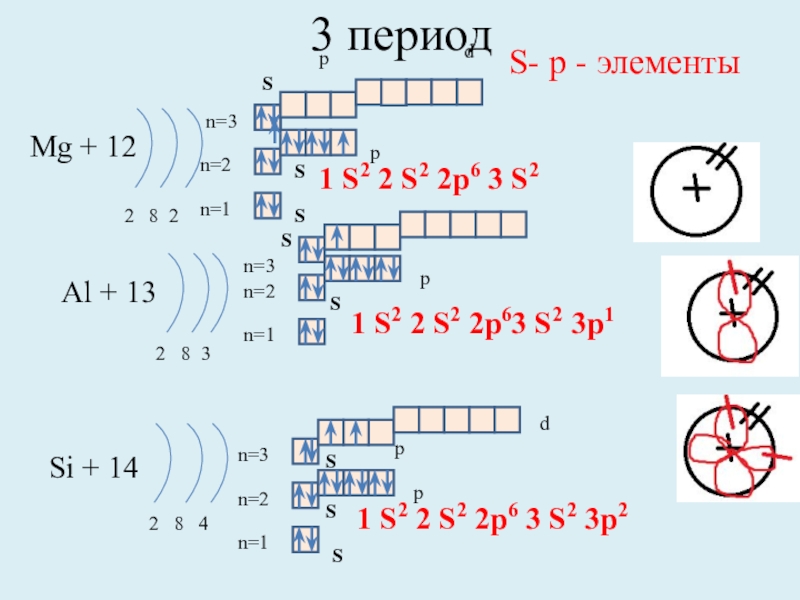
Mg + 12
2 8 2
n=1
n=2
Al + 13
2 8
n=1
n=2
Si + 14
2 8 4
n=1
n=2
1 S2 2 S2 2p6 3 S2 3p2
S- р - элементы
1 S2 2 S2 2p6 3 S2
1 S2 2 S2 2p63 S2
S
S
S
S
S
S
S
p
p
p
p
d
n=3
n=3
S
p
d
n=3
3p1
Слайд 12
3 период
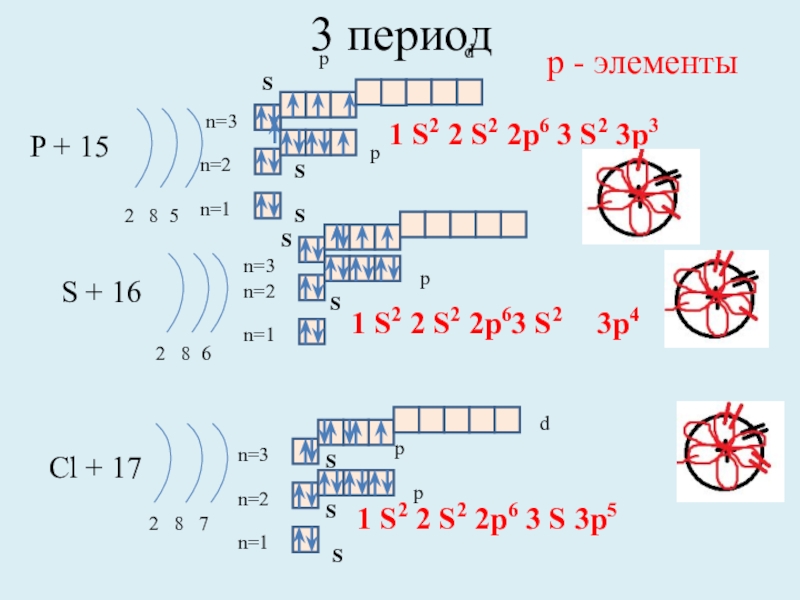
P + 15
2 8 5
n=1
n=2
S + 16
2 8
n=1
n=2
Cl + 17
2 8 7
n=1
n=2
1 S2 2 S2 2p6 3 S 3p5
р - элементы
1 S2 2 S2 2p6 3 S2 3p3
1 S2 2 S2 2p63 S2
S
S
S
S
S
S
S
p
p
p
p
d
n=3
n=3
S
p
d
n=3
3p4
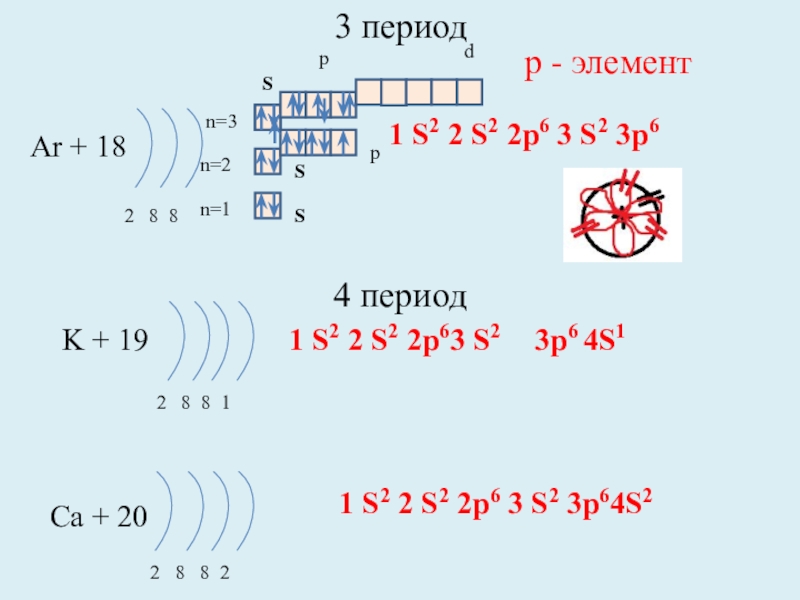
Слайд 133 период
Ar + 18
2 8 8
n=1
n=2
K + 19
2 8
Ca + 20
2 8 8 2
1 S2 2 S2 2p6 3 S2 3p64S2
р - элемент
1 S2 2 S2 2p6 3 S2 3p6
1 S2 2 S2 2p63 S2
S
S
p
n=3
S
p
d
3p6 4S1
4 период
Слайд 16Принцип минимума энергии при формировании электронной оболочки
1s1-22s1-22p1-63s1-23p1-64s1-23d1-104p1-65s1-2
4d1-105p1-66s1-2 4f1-145d1-106p1-6 7s1-2
При написании электронной формулы распределять электроны, количество которых в сумме должна быть равной порядковому номеру элемента!!!