- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Соли (11 класс)
Содержание
- 1. Презентация по химии на тему: Соли (11 класс)
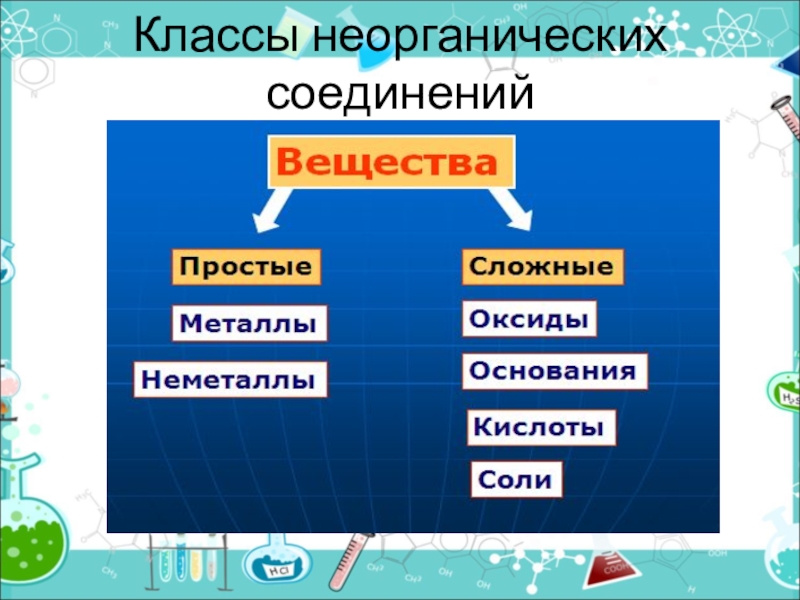
- 2. Классы неорганических соединений
- 3. Актуализация знаний:1).Осуществите превращение:Fe 0 +
- 4. Актуализация знаний: «Третий лишний»1.SO2 CaO
- 5. Актуализация знаний: «Третий лишний»4). H2CO3 , H2SO3,
- 6. Актуализация знаний:7).С какими из названных веществ будет
- 7. К какому классу соединений относятся данные вещества?AL(NO3)3(CuOH)2 CO3NaHCO3
- 8. соли ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 9. Эпиграф урока «Просто знать еще не все,
- 10. Цели урока:-Обобщение знаний о :классификации солей
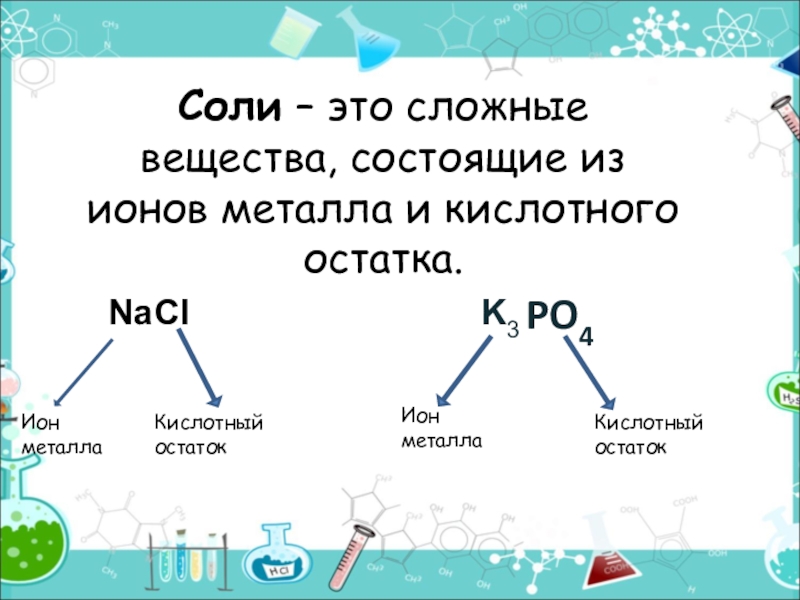
- 11. Соли
- 12. Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.PO4Ион металлаКислотный остатокИон металлаКислотный остатокNaClK3
- 13. Соли как электролиты Соли – это
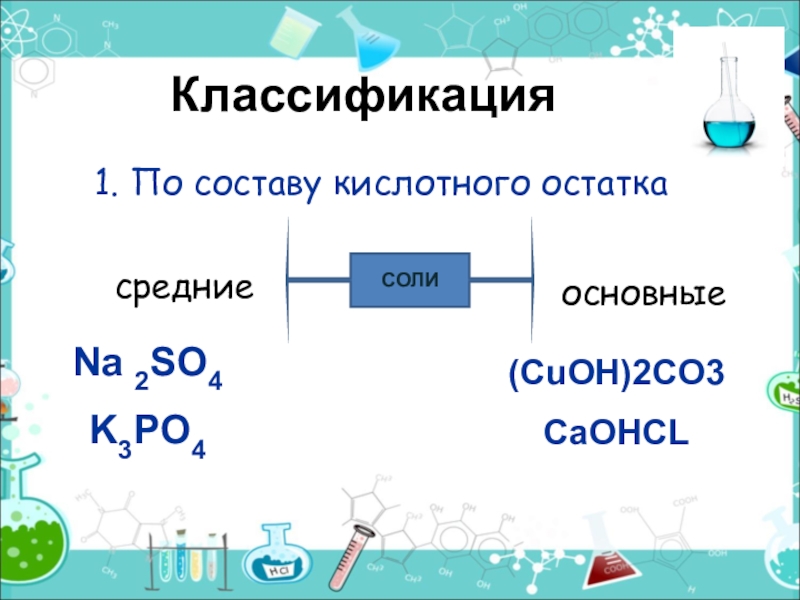
- 14. Классификация 1. По составу кислотного остаткаСОЛИсредниекислыеNa 2SO4K3PO4NaHSO4K2HPO4
- 15. Классификация 1. По составу кислотного остаткаСОЛИсредниеосновныеNa 2SO4K3PO4(CuOH)2CO3CaOHCL
- 16. Номенклатура кислых солейУказать название кислотного остаткаК названию кислотного остатка прибавить «гидро-»Наименование металла в родительном падежеNaHSO4сульфатгидронатрия
- 17. Номенклатура основных солейУказать название кислотного остаткаК названию кислотного остатка прибавить «гидроксо-»Наименование металла в родительном падеже(CuOH)2CO3ксокарбонатгидромеди
- 18. Слайд 18
- 19. Химические свойства1. Взаимодействие с металлами:
- 20. Химические свойства 2. Взаимодействие с основаниями:
- 21. Химические свойства3.Взаимодействие с кислотами:Сильные кислоты вытесняют более
- 22. Химические свойства4. Взаимодействие солеймежду собойКСl + AgNO3 → AgCl + KNO3
- 23. Химические свойства5. Разложение при нагревании :
- 24. Лабораторный опыт 1: «Обнаружение сульфатов»1.К раствору сульфата
- 25. Лабораторный опыт 2: «Обнаружение хлоридов»1.К раствору хлорида
- 26. Первичное закрепление знаний:Занимательный опыт: «Огонь-художник»На листе волнистая
- 27. «Огонь-художник»2KNO3 = 2 KNO2 + O2Нитрат
- 28. Творческое экспериментальное задание.Издавна, в русской деревне, женщины
- 29. Творческое экспериментальное заданиеЗола содержит большое количество карбоната
- 30. Творческое экспериментальное заданиеВ растворе накапливаются
- 31. Первичное закрепление знанийОпределите соответствие состава инаименования солей:1.СuOHCL
- 32. Практически возможные реакции:1.K2SO4 + NaCL
- 33. Практически возможные реакции: 1.K2SO4 + NaCL =
- 34. Викторина о солях1.Из какой муки нельзя испечь
- 35. Домашнее задание:Параграф 24, № 3 (всеми способами
- 36. 1. На уроке было над чем
- 37. Способы получения 1. Кислота + основание
- 38. Способы получения 5. Основание + соль
Слайд 3Актуализация знаний:
1).Осуществите превращение:
Fe 0 + 2 H+ =
Представьте для реакции ионно-электронное уравнение.
2).Экспериментально определите каждое из 3-х предложенных веществ:
А).Гидроксид натрия- NaOH.
Б).Соляную кислоту- HCL.
В).Хлорид натрия- NaCL.
Слайд 5Актуализация знаний:
«Третий лишний»
4). H2CO3 , H2SO3, AL(NO3)3
5). KI , FeCL2
6). S8 , ( CuOH)2CO3 , P4 .
Слайд 6Актуализация знаний:
7).С какими из названных веществ будет взаимодействовать соляная кислота- HCL:
S
Слайд 9Эпиграф урока «Просто знать еще не все, знания необходимо еще использовать» И.В.Гете
Слайд 10
Цели урока:
-Обобщение знаний о :
классификации солей по составу;
номенклатуре солей;
физических и химических
нахождении солей в природе и их
применении;
обнаружение солей важнейших кислот:
сульфатов и хлоридов;
Слайд 12Соли – это сложные вещества, состоящие из ионов металла и кислотного
PO4
Ион
металла
Кислотный
остаток
Ион
металла
Кислотный
остаток
Na
Cl
K3
Слайд 13
Соли как электролиты
Соли – это электролиты, образующие при электролитической диссоциации
1.K3PO4= 3 K+ + PO4 3-
2.CaCL2 = Ca 2+ + 2CL-
Слайд 15Классификация
1. По составу кислотного остатка
СОЛИ
средние
основные
Na 2SO4
K3PO4
(CuOH)2CO3
CaOHCL
Слайд 16Номенклатура кислых солей
Указать название кислотного остатка
К названию кислотного остатка прибавить «гидро-»
Наименование
NaHSO4
сульфат
гидро
натрия
Слайд 17Номенклатура основных солей
Указать название кислотного остатка
К названию кислотного остатка прибавить
«гидроксо-»
Наименование
(CuOH)2CO3
ксокарбонат
гидро
меди
Слайд 18 Способы получения солей: Средних: AL(OH)3 +3HNO3=AL(NO3)3 +3HOH Кислых: NaOH + H2CO3 =NaHCO3+HOH Основных: Сu(OH)2 +
Слайд 19Химические свойства
1. Взаимодействие с металлами:
SnCl2 + Zn ?
Свободный металл должен быть
расположен …………… металла соли
в вытеснительном ряду металлов
Н.Н.Бекетова.
Слайд 20Химические свойства
2. Взаимодействие с основаниями:
2NaОН + CuSO4 →
Соли взаимодействуют
с ………………..
основаниями, или ………..
Слайд 21Химические свойства
3.Взаимодействие с кислотами:
Сильные кислоты вытесняют более …………. из их солей!
CaCO3 + HCl →
Слайд 24Лабораторный опыт 1:
«Обнаружение сульфатов»
1.К раствору сульфата натрия прилейте
раствор нитрата бария.Каковы признаки
данной
реакций.
Na2SO4 + Ba(NO3)2 =
Слайд 25Лабораторный опыт 2:
«Обнаружение хлоридов»
1.К раствору хлорида натрия прилейте
раствор нитрата серебра. Каковы
признаки
реакции.
NaCL + AgNO3 =
Слайд 26Первичное закрепление знаний:
Занимательный опыт:
«Огонь-художник»
На листе волнистая змейка нарисована концентрированным
раствором соли.
к змейке. Огонь бежит по листу, «рисуя» змейку. Какой процесс происходит? Какая соль взята?
Слайд 28Творческое экспериментальное
задание.
Издавна, в русской деревне, женщины мыли
волосы, добавляя в воду
золы , полученной при сгорании стеблей подсолнечника. Особенно это было распространено там, где пользовались не
речной водой, а колодезной. Как можно
объяснить применение золы подсолнечника
для этих целей?
Слайд 29Творческое экспериментальное
задание
Зола содержит большое количество карбоната калия- K2CO3, который является
К2СО3 = 2 К+ + С03 2-
С03 2- + НОН= НС03 - + OH-
Слайд 30
Творческое экспериментальное
задание
В растворе накапливаются ионы OH- п.э.среда становится щелочной. Под
Слайд 31Первичное закрепление
знаний
Определите соответствие состава и
наименования солей:
1.СuOHCL A).нитрат магния;
2.CaH2 PO4
3.ZnOHCL В).дигидрофосфат кальция;
4.Mg(NO3)2 Г).гидроксохлорид цинка;
Д).гидроксид калия;
Е).гидрокарбонат кальция;
Слайд 32 Практически возможные
реакции:
1.K2SO4 + NaCL =
2.AgNO3 + K3PO4 =
3.NaOH +
4.Cu(OH)2 + KCL =
Слайд 33Практически возможные реакции:
1.K2SO4 + NaCL = не реагируют
2.3AgNO3+K3PO4=3KNO3 +Ag3PO4
3.2NaOH+FeCL2=2NaCL+Fe(OH)2
осадок
4.Cu(OH)2 + KCL =не реагируют
Слайд 34Викторина о солях
1.Из какой муки нельзя испечь хлеб?
2.Какую соль называют
3.При лечении малокровия используют
«железное» яблоко. Что оно из себя представляет?
Слайд 35Домашнее задание:
Параграф 24, № 3 (всеми способами получить сульфат железа (11)–
№ 8-сообщения: «Соли в медицине», «История производства соды»,
викторина «О солях».
Слайд 361. На уроке было над
чем подумать
2. На все
вопросы я получил ответы
4. На уроке я поработал
добросовестно
5. Оцените свою работу на уроке по пятибалльной системе.
Ответьте на утверждение знаком
«+» или «-»:
Слайд 37Способы получения
1. Кислота + основание = соль + вода
2. Кислота + металл = соль + водород
2HCL +Zn = ZnCL2 + H2
3. Кислота + основный оксид = соль + вода
2HCL + CuO = CuCL2 + H2O
4. Кислота + соль = новая кислота + новая соль
H2SO4 + BaCL2 = 2HCL + BaSO4
Условия: в результате реакции должны получиться газ, осадок или вода.
Основаны на химических свойствах оксидов,
оснований, кислот
10
способов
10
способов
10
способов
10
способов
10
способов
Слайд 38Способы получения
5. Основание + соль = новое основание + новая
2КОН + СаSO4 = Са(ОН) 2 + К2SO4
6. Основание + кислотный оксид + = соль + вода
2NaOH + SO3 = Na2SO4 + H2O
7. Кислотный оксид + основный оксид = соль
СО2+ СаО = СаСО3
8. Соль + соль = новая соль + новая соль
КСl + AgNO3 → AgCl + KNO3
9. Соль + металл = новая соль + металл
CuSO4 + Fe = FeSO4 + Cu
10. Металл + неметалл = соль
Fe +S = FeS
10
способов
10
способов
10
способов
10
способов