Соединения железа (+2, +3).
Роль железа в жизни человека
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Соединения железа. Роль железа в жизни человека (9 класс)
Содержание
- 1. Презентация по химии на тему Соединения железа. Роль железа в жизни человека (9 класс)
- 2. Жизнь человека подобна железу: если
- 3. Цель урока:Познакомиться с соединениями железа и качественными
- 4. Выполните тест:1)Железо находится в:а) IV периоде, 8А
- 5. Выполните взаимопроверку Ответ: 1в;
- 6. Немного истории В середине II тысячелетия
- 7. Распространение элементов в природе по массе
- 8. Железо в природе
- 9. Главные месторождения железных руд
- 10. Природные соединения железа Fе3О4 (Fе+2О. Fе2+3О3)- магнитный
- 11. КМА- Курская магнитная аномалия . Богатейшее месторождение
- 12. Железо в организме человека
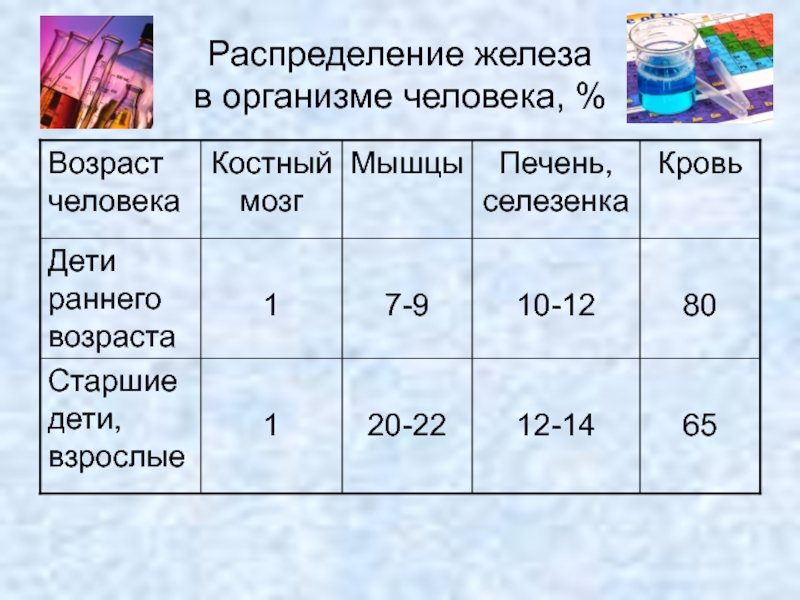
- 13. Распределение железа в организме человека, %
- 14. Живое железо
- 15. Содержание железа в продуктах питания, мг/100 г
- 16. Если плохо пережёвывать пищу, то железо не
- 17. Проведение исследования Метод исследования - проведение химического эксперимента
- 18. Химический эксперимент
- 19. Группа 2 ЭкспериментаторыПолучение и исследование свойств
- 20. Слайд 20
- 21. Слайд 21
- 22. Группа
- 23. Группа 6 Исследователи Исследование свойств
- 24. Правила работы с кислотами и щелочамиСоблюдай осторожность
- 25. Проведение исследования1. В пробирку прилить 1 мл
- 26. Fе(ОН)2- зеленый осадок FеSО4+ 2NaOH=Na2SО4+ Fе(ОН)2↓
- 27. 1. В
- 28. Fе(ОН)3- бурый осадок FеСl3+ 3NaOH=3NaСl +
- 29. Слайд 29
- 30. Качественные реакции на ионы железа Fe3+На
- 31. Качественные реакции на ионы железа Fe2+
- 32. Определение содержания железа в яблоках и гречке
- 33. Определение связывания ионов железа(III) черным чаем1. Налить
- 34. Компоненты чая связывают железо в
- 35. Качественные реакции на катионы железаK3[Fe(CN)6]—красная кровяная сольK4[Fe(CN)6]–
- 36. Техническое значение соединений железа FеSО4 . 7Н2О
- 37. Чудеса мира.Железо находит широкое применение в виде
- 38. Художественное литье
- 39. Применение стали
- 40. Булат – старинная узорчатая твердая сталь для клинков.
- 41. Закончите предложения: Сегодня я узнал ……………..Я удивился ……………………….Теперь я умею ……………………Я хотел бы узнать ………………………..
- 42. Обращаясь к эпиграфу урока, хотелось бы
- 43. ЖЕЛАЮ ТВОРЧЕСКИХ УСПЕХОВ
- 44. Литература1. Габриелян О. С. Химия 9 класс:
Слайд 1МОУ «Майская гимназия
Белгородского района Белгородской области»
Учитель химии
Карташова Элеонора Александровна
Слайд 2
Жизнь человека подобна железу:
если употреблять его в дело,
если не употреблять, ржавчина его съедает
Катон Старший
Слайд 3Цель урока:
Познакомиться с соединениями железа и качественными реакциями на ионы железа
Освоить навык определения ионов железа
Познакомиться с ролью железа в жизни человека
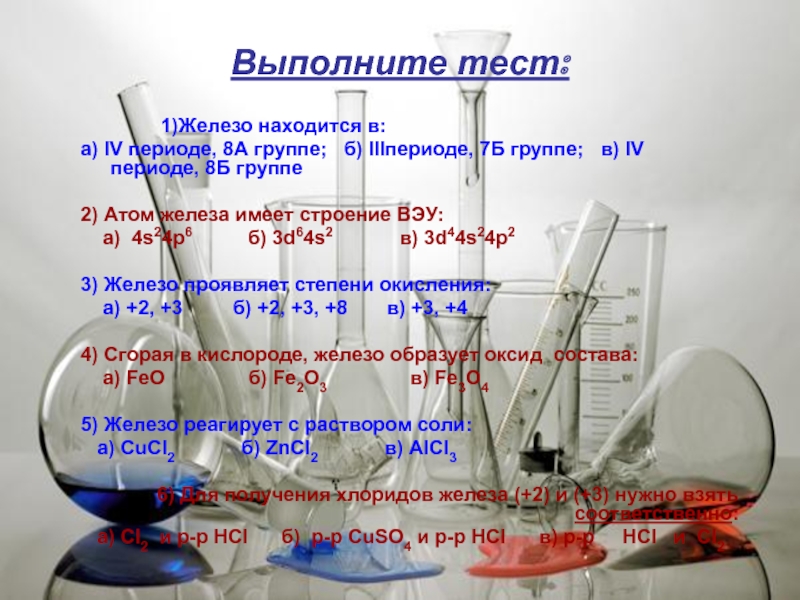
Слайд 4Выполните тест:
1)Железо находится в:
а) IV периоде, 8А группе; б) IIIпериоде,
2) Атом железа имеет строение ВЭУ:
а) 4s24p6 б) 3d64s2 в) 3d44s24p2
3) Железо проявляет степени окисления:
а) +2, +3 б) +2, +3, +8 в) +3, +4
4) Сгорая в кислороде, железо образует оксид состава:
а) FeO б) Fe2O3 в) Fe3O4
5) Железо реагирует с раствором соли:
а) CuCl2 б) ZnCl2 в) AlCl3
6) Для получения хлоридов железа (+2) и (+3) нужно взять соответственно:
а) Cl2 и р-р HCl б) р-р CuSO4 и р-р HCl в) р-р HCl и Cl2
Слайд 5Выполните взаимопроверку
Ответ: 1в; 2б; 3а; 4в; 5а; 6в
1)Железо
а) IV периоде, 8А группе; б) IIIпериоде, 7Б группе; в) IV периоде,8Б группе
2) Атом железа имеет строение внешнего энергетического уровня:
а) 4s24p6 б) 3d64s2 в) 3d44s24p2
3) Железо проявляет степени окисления:
а) +2, +3 б) +2, +3, +8 в) +3, +4
4) Сгорая в кислороде, железо образует оксид состава:
а) FeO б) Fe2O3 в) Fe3O4
5) Железо реагирует с раствором соли:
а) CuCl2 б) ZnCl2 в) AlCl3
6) Для получения хлоридов железа (+2) и (+3) нужно взять соответственно:
а) Cl2 и р-р HCl б) р-р CuSO4 и р-р HCl в) р-р HCl и Cl2
Слайд 6Немного истории
В середине II тысячелетия до н.э. в Египте
Слайд 10Природные соединения железа
Fе3О4 (Fе+2О. Fе2+3О3)- магнитный железняк (магнетит)
Fе2+3О3
2Fе2+3О3.3Н2О - бурый железняк (лимонит)
Fе+2S-12 - железный колчедан (пирит)
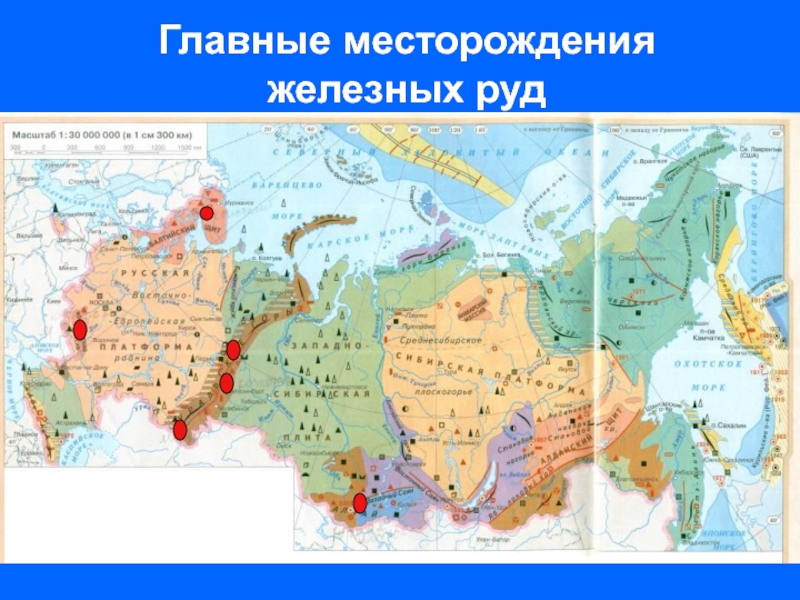
Слайд 11КМА- Курская магнитная аномалия .
Богатейшее месторождение
железной руды
магнитного железняка
Расположено в районе Губкина и
Старого Оскола
Белгородской области.
Курская магнитная
аномалия – настоящая жемчужина.
Руда лежит почти на поверхности и ее добывают
открытым способом - снимают поверхностный
слой почвы и осадочных пород и черпают руду
экскаватором.
К М А
Слайд 16Если плохо пережёвывать пищу, то железо не усваивается!
«Друзья» железа – витамин
«Враги» железа – чай, кофе (в их присутствии образуются трудно растворимые соединения железа)
Недостаток железа – малокровие или железодефицитная анемия
Слайд 18
Химический эксперимент
Группа 1 Экспериментаторы
Получение и исследование свойств гидроксида железа (2)
Цель опыта - получить и исследовать свойства гидроксида железа (2)
Слайд 19
Группа 2 Экспериментаторы
Получение и исследование свойств гидроксида железа (3)
Слайд 20
Цель опыта:
произвести исследование по распознаванию соли железа (3) среди выданных растворов солей
Для этого проделать качественные реакции
Слайд 21
Цель опыта:
произвести исследование по распознаванию соли железа (2) среди выданных растворов солей
Для этого проделать качественные реакции
Слайд 22 Группа 5 Исследователи Определение содержания
Цель опыта:
произвести исследование по определению железа в яблоках и гречке
Для этого проделать качественные реакции
Слайд 23
Группа 6 Исследователи
Исследование свойств
черного чая
Цель опыта:
произвести исследование
Слайд 24Правила работы с кислотами и щелочами
Соблюдай осторожность при работе с кислотами
В случае попадания на кожу – промой водой!
После промывания водой раствор кислоты нейтрализуют слабым раствором соды,
раствор щелочи нейтрализуют слабым раствором уксуса или лимонной кислоты.
Слайд 25Проведение исследования
1. В пробирку прилить 1 мл раствора соли FеSО4, добавить
2. Разделите вещество на две части.
3. В первую часть прилейте 1 мл. серной кислоты. Что наблюдаете
4. Вторую часть оставьте окисляться на воздухе. Что наблюдаете?
5. Запишите уравнения химических реакций в молекулярном и ионном видах.
6. Вывод – получили гидроксида железа (2) по схеме:
FеSО4→ Fе (ОН)2 → FеО
Слайд 26
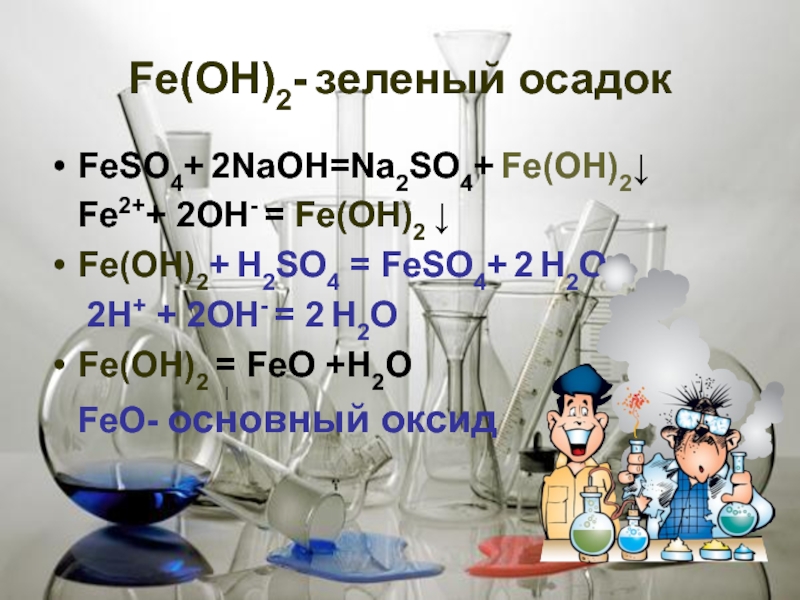
Fе(ОН)2- зеленый осадок
FеSО4+ 2NaOH=Na2SО4+ Fе(ОН)2↓
Fе2++ 2OH- = Fе(ОН)2 ↓
Fе(ОН)2+
2Н+ + 2OH- = 2 Н2О
Fе(ОН)2 = FеО +Н2О
FеО- основный оксид
Слайд 27 1. В пробирку прилить 1 мл
Проведение исследования
Слайд 28
Fе(ОН)3- бурый осадок
FеСl3+ 3NaOH=3NaСl + Fе(ОН)3↓
Fе3++ 3OH- = Fе(ОН)3
2Fе(ОН)3↓+ 3H2SО4 = Fе2(SО4)3+ 6Н2О
2Fе(ОН)3↓+ 6H+ = 2Fе 3++ 6Н2О
2Fе(ОН)3 = Fе2О3+3H2O
Fе2О3 – амфотерный оксид
Слайд 30Качественные реакции
на ионы железа Fe3+
На ионы Fe3+
+3
FeCl3 + K4[Fe(CN)6] —> KFe[Fe(CN)6] +3KCL
желтая кровяная соль синий осадок
+3 +3
FeCl3 + KCNS —> Fe(CNS)3 + 3KCl
роданид калия раствор красного
цвета
FеСl3+ 3NaOH = 3NaСl + Fе(ОН)3↓
Слайд 31Качественные реакции
на ионы железа Fe2+
На ионы Fe2+
FeCl2 + K3[Fe(CN)6] —> KFe[Fe(CN)6] +2KCL
красная кровяная соль синий осадок
FеSО4+ 2NaOH = Na2SО4+ Fе(ОН)2↓
Слайд 32Определение содержания железа в яблоках и гречке
1. В ступке измельчить образцы
2. Полученные смеси перенести в стаканы.
3. Добавить 1 мл. азотной кислоты, 1 каплю пероксида водорода.
4. Добавить 1 каплю раствора красной кровяной соли. Что наблюдаете? Какой цвет осадка?
5. Вывод – в яблоках и гречке содержится железо.
Соли железа, содержащиеся в яблоках, лучше усваиваются организмом, поскольку они находятся в благоприятном соотношении с витаминами.
Слайд 33Определение связывания ионов железа(III) черным чаем
1. Налить в стаканчики по 5
2. Добавить по 1 мл. хлорида железа (3). Что наблюдаете? (Раствор чая чернеет)
3. Профильтровать полученный раствор.
4. Добавить 1 каплю раствора красной кровяной соли.
Что наблюдаете? Какой цвет осадка?
(осадок черного цвета)
5. Вывод – происходит полное связывание ионов железа (3).
Вода также содержит ионы железа (3).
Слайд 34
Компоненты чая связывают железо в труднорастворимую форму.
еды, сократит усвоение железа
почти на 70%.
Если чай выпит после приема пищи, то организм недосчитается 40% железа, а если – за 1 ч до еды, он оставит железо в неприкосновенности.
Кроме чая,
“врагами” железа
являются кофе,
молочные продукты.
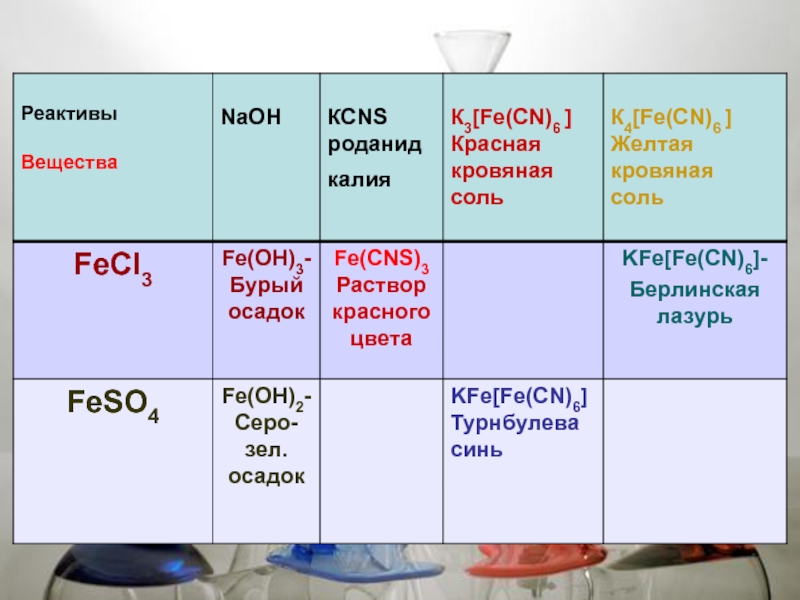
Слайд 35Качественные реакции на катионы железа
K3[Fe(CN)6]—красная кровяная соль
K4[Fe(CN)6]– желтая кровяная соль
FeCl2+ K3[Fe(CN)6
турнбуллева синь
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]
берлинская лазурь
KFe+2 [Fe+3 (CN)6] = KFe+3 [Fe+2 (CN)6]
Турнбуллева синь берлинская лазурь
Слайд 36Техническое значение соединений железа
FеSО4 . 7Н2О – железный купорос. Применяют для
FеСl3 – хлорид железа (III). Применяют для очистки воды, в качестве протравы при крашении тканей.
Fе2(SО4)3 * 9Н2О – сульфат железа(III). Применяют при очиcтке воды, в качестве растворителя в гидрометаллургии.
Сплавы железа
Чугун (Fе и 2-4,5%С) Сталь (Fе и >2%С)
Слайд 37Чудеса мира.
Железо находит широкое применение в виде чугуна и стали (сплавы
Набережные Санкт -Петербурга и решетка Летнего сада могут быть причислены к чудесам мира.
Слайд 41Закончите предложения:
Сегодня я узнал ……………..
Я удивился ……………………….
Теперь я умею
Я хотел бы узнать ………………………..
Слайд 42Обращаясь к эпиграфу урока,
хотелось бы вам пожелать
Пусть
не ржавеет от лени
Слайд 44Литература
1. Габриелян О. С. Химия 9 класс: учебник для общеобразовательных учреждений
2. Габриелян О. С. Химия 9 класс: Настольная книга учителя // О. О. Габриелян, И.Г. Остроумов. М.: Дрофа, 2003.
3. Горковенко М. Ю. Химия. 9 класс. Поурочные разработки к учебнику О. С. Габриеляна (М.: Дрофа); Л.С. Гузея и др. (М.: Дрофа); Г. Е. Рудзитиса, Ф. Г. Фельдмана // М. Ю. Горковенко. (М.: Просвещение). – М.: «ВАКО», 2004.
4. Зайцев О.С. Методика обучения химии. // М.: “Владос”, 1999. 5. Ивченко Л.А., Макареня А.А.
Валеология на уроках неорганической химии // Химия. – 2000. – № 26. 5. Харьковская Н.Л., Лященко Л.Ф., Волынцева Н.А. Железо и окружающая среда // Химия в школе. – 1998. – № 5.
6. Интернет – ресурсы





























![Презентация по химии на тему Соединения железа. Роль железа в жизни человека (9 класс) Качественные реакции на катионы железаK3[Fe(CN)6]—красная кровяная сольK4[Fe(CN)6]– желтая кровяная сольFeCl2+ K3[Fe(CN)6 Качественные реакции на катионы железаK3[Fe(CN)6]—красная кровяная сольK4[Fe(CN)6]– желтая кровяная сольFeCl2+ K3[Fe(CN)6 = KFe[Fe(CN)6]](/img/thumbs/5e58308df181ddd69e35605a1787588e-800x.jpg)














