Коррозия металлов.
Способы защиты от коррозии.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Коррозия металлов. Способы защиты от коррозии
Содержание
- 1. Презентация по химии на тему Коррозия металлов. Способы защиты от коррозии
- 2. Цель работыИзучить процесс коррозии металлов, виды коррозии и способы защиты от коррозии.
- 3. ВведениеНесмотря на широкое внедрение в нашу сегодняшнюю
- 4. Историческая справка Учение о коррозии и защите
- 5. Понятие коррозии металловКОРРОЗИЯ (от латинского «corrodere», что
- 6. Пагубное влияние коррозии Вызывает серьезные экологические последствия:
- 7. Факторы, вызывающие коррозиюКислород и влага атмосферыУглекислый и сернистый газы, содержащиеся в атмосфере Морская водаГрунтовые воды
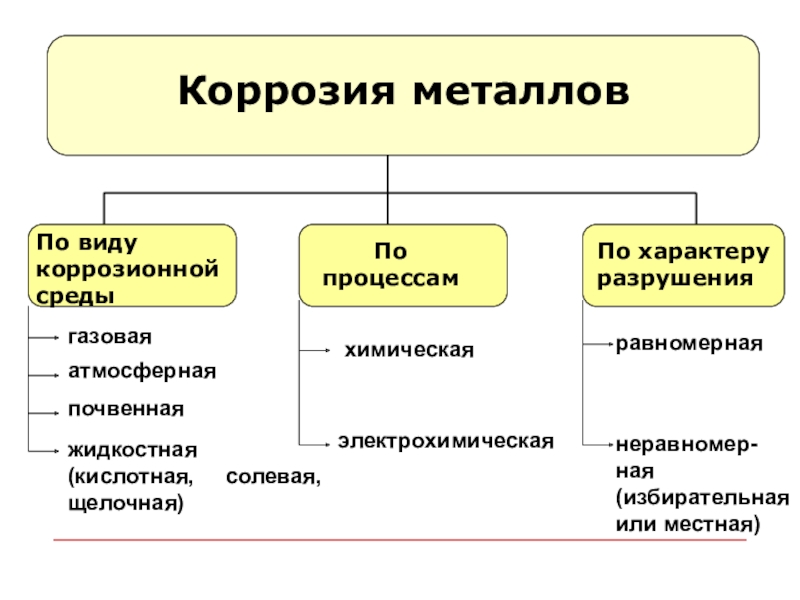
- 8. Коррозия металловПо процессамПо виду коррозионной средыПо характеру
- 9. Среда, в которой металл подвергается коррозии
- 10. Виды коррозииХИМИЧЕСКАЯ – это разрушение металлов и
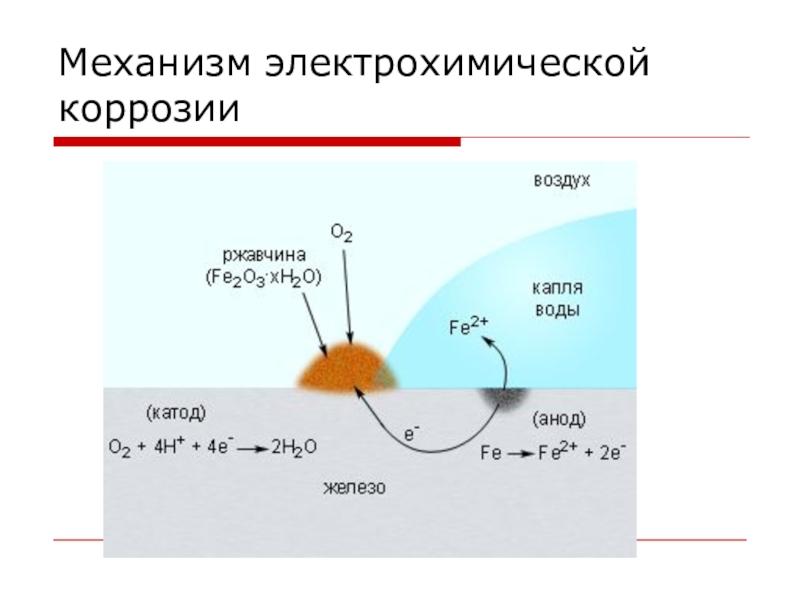
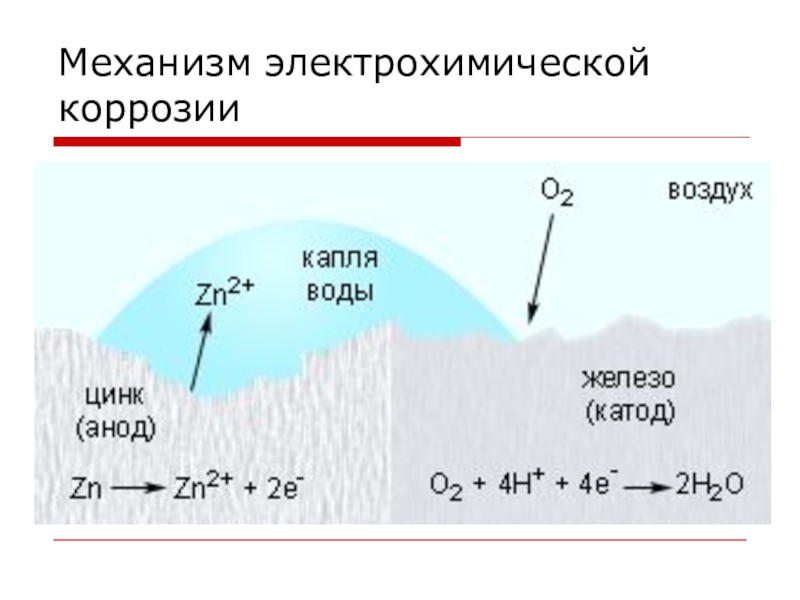
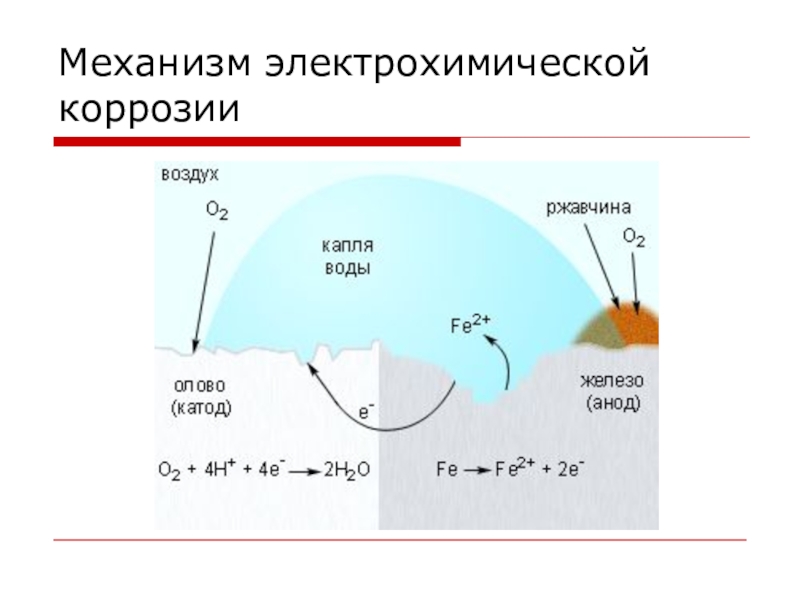
- 11. Виды коррозииЭЛЕКТРОХИМИЧЕСКАЯ – это разрушение металлов, которое
- 12. Условия, способствующие электрохимической коррозииПоложение металла в ряду
- 13. Механизм электрохимической коррозии
- 14. Механизм электрохимической коррозии
- 15. Механизм электрохимической коррозии
- 16. Способы защиты металлов от коррозииХимические методы защиты:1)
- 17. Слайд 17
- 18. 3) Изготовление изделий из чистого
- 19. 4) Добавление ингибиторов в агрессивную среду.
- 20. Электрохимические методы защиты: 1) Подача тока
- 21. 2) Протекторная защита Защищаемое изделие соединяют с
- 22. 3) ИСПОЛЬЗОВАНИЕ СОВРЕМЕННЫХ КОМБИНИРОВАННЫХ МАТЕРИАЛОВ:. Например: Ризолин
- 23. Опыты, исследования№ 1 – железный гвоздь, помещенный
- 24. Результаты исследованияНа следующий день мы обнаружили, что
- 25. ЗаключениеИзучение коррозии и разработка методов защиты металлов
- 26. БиблиографияБахвалов, Г.Т.; Турковская, А.В. Коррозия и защита
Цель работыИзучить процесс коррозии металлов, виды коррозии и способы защиты от коррозии.
Слайд 1
Авторы: Кухарчук Николай Леонидович, 11 Б
КОУ УР «РЦОМ»
Руководитель: Шмыкова Елена
Анатольевна, учитель химии
Слайд 3Введение
Несмотря на широкое внедрение в нашу сегодняшнюю жизнь полимерных материалов, стекла,
керамики, основным конструкционным материалом продолжает оставаться железо и сплавы на его основе. С изделиями из железа мы на каждом шагу встречаемся в быту и знаем, как много хлопот доставляют его ржавление и сама ржавчина.
Слайд 4Историческая справка
Учение о коррозии и защите металлов является отраслью прикладной
физической химии. Его основы заложены М.В.Ломоносовым, который в середине 18 в. изучал действие кислот на металлы, ясно различая обычное растворение солей в воде от явлений коррозии металлов, открыл пассивное состояние металлов и первый понял сущность явлений при окислении металлов. Большое значение для развития теории коррозии металлов имели работы английского ученого М.Фарадея, установившего в 1833-1834 основные законы электролиза и предложившего для объяснения пассивности металлов.
Слайд 5Понятие коррозии металлов
КОРРОЗИЯ (от латинского «corrodere», что означает разъедать) – самопроизвольное
разрушение металлов и сплавов в результате химического или электрохимического взаимодействия их с окружающей средой.
Это окислительно-восстановительная реакция, при которой атомы металла превращаются в ионы. Чем активнее металл, тем он больше подвержен коррозии.
В роли окислителя выступают атмосферный кислород и катионы водорода.
Это окислительно-восстановительная реакция, при которой атомы металла превращаются в ионы. Чем активнее металл, тем он больше подвержен коррозии.
В роли окислителя выступают атмосферный кислород и катионы водорода.
Слайд 6Пагубное влияние коррозии
Вызывает серьезные экологические последствия: утечка нефти, газа, других
химических продуктов.
Недопустима во многих отраслях промышленности: авиационной, химического, нефтяного и атомного машиностроения.
Отрицательно влияет на жизнь и здоровье людей
Ежегодно потери от коррозии составляют около 10% от годовой добычи металла.
Недопустима во многих отраслях промышленности: авиационной, химического, нефтяного и атомного машиностроения.
Отрицательно влияет на жизнь и здоровье людей
Ежегодно потери от коррозии составляют около 10% от годовой добычи металла.
Слайд 7Факторы,
вызывающие коррозию
Кислород и влага атмосферы
Углекислый и сернистый газы, содержащиеся в
атмосфере
Морская вода
Грунтовые воды
Морская вода
Грунтовые воды
Слайд 8
Коррозия металлов
По процессам
По виду коррозионной среды
По характеру разрушения
газовая
атмосферная
почвенная
жидкостная (кислотная,
солевая, щелочная)
химическая
электрохимическая
равномерная
неравномер- ная (избирательная или местная)
Слайд 9 Среда, в которой металл подвергается коррозии (корродирует) называется коррозионной или агрессивной
средой.
По степени воздействия на металлы различают среды:
неагрессивные;
слабоагрессивные;
среднеагрессивные;
сильноагрессивные.
Слайд 10Виды коррозии
ХИМИЧЕСКАЯ – это разрушение металлов и сплавов в результате их
химического взаимодействия с веществами окружающей среды.
Защитная оксидная пленка на поверхности алюминия
Рыхлая пленка на поверхности железа, приводящая к разрушению металла
Защитная оксидная пленка на поверхности алюминия
Рыхлая пленка на поверхности железа, приводящая к разрушению металла
Слайд 11Виды коррозии
ЭЛЕКТРОХИМИЧЕСКАЯ – это разрушение металлов, которое сопровождается возникновением электрического тока
в воде или среде другого электролита.
Химические процессы – это окисление корродируемого металла, отдача электронов.
Электрические процессы – перенос электронов с одного участка изделия к другому.
Химические процессы – это окисление корродируемого металла, отдача электронов.
Электрические процессы – перенос электронов с одного участка изделия к другому.
Слайд 12Условия, способствующие электрохимической коррозии
Положение металла в ряду активности металлов: чем они
дальше расположены друг от друга, тем быстрее происходит коррозия.
Чистота металла: примеси ускоряют коррозию.
Неровности поверхности металла, трещины.
Грунтовые воды, морская вода, среда электролита.
Повышение температуры.
Действие микроорганизмов (грибы, бактерии и лишайники воздействуют на металл с высокой коррозионной стойкостью).
Чистота металла: примеси ускоряют коррозию.
Неровности поверхности металла, трещины.
Грунтовые воды, морская вода, среда электролита.
Повышение температуры.
Действие микроорганизмов (грибы, бактерии и лишайники воздействуют на металл с высокой коррозионной стойкостью).
Слайд 16Способы защиты металлов от коррозии
Химические методы защиты:
1) Нанесение защитных покрытий. Широко
используют металлические покрытия (хромирование, никелирование, алитирование и т. д.), неметаллические (покрытия лаками, смолами, красками, эмалями), химические (покрытия пленками из оксидов, нитридов, фосфатов данного металла).
Слайд 17
.
2) Изготовление сплавов, устойчивых перед коррозией
К числу сплавов, обладающих высокой
коррозионной устойчивостью относятся нержавеющие стали, содержащие до 18 % хрома и 10 % никеля. Такие стали часто используют для изготовления агрегатов, работающих в агрессивных средах
Слайд 18
3) Изготовление изделий из чистого металла.
Наличие примеси создает условие для
передачи электронов, система будет работать как гальванический элемент, разрушая металл.
Слайд 194) Добавление ингибиторов в агрессивную среду.
Например, добавив в кислоту
ингибитор уротропин, можно хранить и переносить её в стальной таре.
Слайд 20
Электрохимические методы защиты:
1) Подача тока
противоположного
направления.
Защищаемое изделие
присоединяется к отрицательному полюсу источника тока и становится катодом.
В качестве анодов используют куски железа. При этом анод разрушается, а на катоде происходит восстановление окислителя.
присоединяется к отрицательному полюсу источника тока и становится катодом.
В качестве анодов используют куски железа. При этом анод разрушается, а на катоде происходит восстановление окислителя.
Слайд 212) Протекторная защита
Защищаемое изделие соединяют с более реакционноспособным металлом, который
корродирует в первую очередь. Изделие при этом не разрушается. Такой способ применяют для защиты от коррозии подводных частей морских судов, а также трубопроводов. В качестве протекторов обычно применяют цинк или сплавы магния.
Слайд 223) ИСПОЛЬЗОВАНИЕ СОВРЕМЕННЫХ КОМБИНИРОВАННЫХ МАТЕРИАЛОВ:.
Например:
Ризолин - самоклеящийся, рулонный кровельный
и гидроизоляционный
материал, изготовленный основе
стеклоткани, пропитанной битумно-полимерным составом
с целевыми добавками, улучшающими
эксплуатационные свойства материала.
Фольгированную поверхность Ризолина
можно окрашивать обычными синтетическими
красками в любой цвет по желанию.
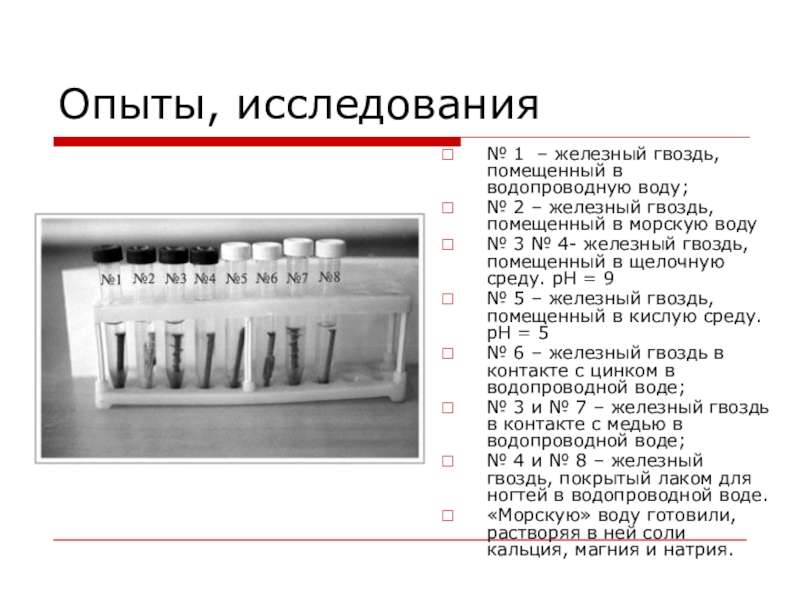
Слайд 23Опыты, исследования
№ 1 – железный гвоздь, помещенный в водопроводную воду;
№
2 – железный гвоздь, помещенный в морскую воду
№ 3 № 4- железный гвоздь, помещенный в щелочную среду. pH = 9
№ 5 – железный гвоздь, помещенный в кислую среду. pH = 5
№ 6 – железный гвоздь в контакте с цинком в водопроводной воде;
№ 3 и № 7 – железный гвоздь в контакте с медью в водопроводной воде;
№ 4 и № 8 – железный гвоздь, покрытый лаком для ногтей в водопроводной воде.
«Морскую» воду готовили, растворяя в ней соли кальция, магния и натрия.
№ 3 № 4- железный гвоздь, помещенный в щелочную среду. pH = 9
№ 5 – железный гвоздь, помещенный в кислую среду. pH = 5
№ 6 – железный гвоздь в контакте с цинком в водопроводной воде;
№ 3 и № 7 – железный гвоздь в контакте с медью в водопроводной воде;
№ 4 и № 8 – железный гвоздь, покрытый лаком для ногтей в водопроводной воде.
«Морскую» воду готовили, растворяя в ней соли кальция, магния и натрия.
Слайд 24Результаты исследования
На следующий день мы обнаружили, что начала появляться ржавчина в
таких средах: «морская» вода, водопроводная. В среде вода и кислота появился черный налет плотной структуры. Через неделю в среде соленая вода масса налета заметно увеличилась, что подтвердило фильтрование воды и измерение массой налета.
В среде щелочь гвоздь остался чистым, коррозия не пошла.
Эти исследования подтверждают, что характер среды влияет на течение коррозии.
В «морской» воде более заметно выражены все проявления коррозии из-за агрессивности среды, которая создается растворимыми солями (гидролиз солей).
Гвоздь, покрытый лаком, не подвергся коррозии.
При контакте железа с цинком явление коррозии железа практически не выражено. В данном случае электрохимическая коррозия затронула цинк, как более активный металл.)
При контакте железа с медью усиливается разрушение железа вследствие электрохимической коррозии, т. к. железо более активный металл, чем медь (в электрохимическом ряду напряжений металлов железо стоит левее меди).
В среде щелочь гвоздь остался чистым, коррозия не пошла.
Эти исследования подтверждают, что характер среды влияет на течение коррозии.
В «морской» воде более заметно выражены все проявления коррозии из-за агрессивности среды, которая создается растворимыми солями (гидролиз солей).
Гвоздь, покрытый лаком, не подвергся коррозии.
При контакте железа с цинком явление коррозии железа практически не выражено. В данном случае электрохимическая коррозия затронула цинк, как более активный металл.)
При контакте железа с медью усиливается разрушение железа вследствие электрохимической коррозии, т. к. железо более активный металл, чем медь (в электрохимическом ряду напряжений металлов железо стоит левее меди).
Слайд 25Заключение
Изучение коррозии и разработка методов защиты металлов от нее представляют теоретический
интерес и имеют большое народнохозяйственное значение.
К настоящему времени благодаря изучению механизма коррозии разработаны разнообразные методы защиты от коррозии, выбор которых определяется природой защищаемого металла, параметрами коррозионной среды и экономическими соображениями.
К настоящему времени благодаря изучению механизма коррозии разработаны разнообразные методы защиты от коррозии, выбор которых определяется природой защищаемого металла, параметрами коррозионной среды и экономическими соображениями.
Слайд 26Библиография
Бахвалов, Г.Т.; Турковская, А.В. Коррозия и защита металлов; М.: Металлургиздат -
Москва, 2012. - 400 c.
Неверов А. С., Родченко Д. А., Цырлин М. И. Коррозия и защита материалов; Высшая школа - Москва, 2007. - 224 c.
Розенфельд И. Н. Коррозия и защита металлов; Мока - Москва, 2012. - 446 c.
http://n-t.ru/ri/kk/hm13.htm
Неверов А. С., Родченко Д. А., Цырлин М. И. Коррозия и защита материалов; Высшая школа - Москва, 2007. - 224 c.
Розенфельд И. Н. Коррозия и защита металлов; Мока - Москва, 2012. - 446 c.
http://n-t.ru/ri/kk/hm13.htm