- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Химические свойства металлов и их соединений
Содержание
- 1. Презентация по химии на тему Химические свойства металлов и их соединений
- 2. По своим химическим свойствам все металлы являются
- 3. В общем виде можно выразить схемой:
- 4. Металлы способны отдавать свои валентные электроны атомам
- 5. Взаимодействие с простыми веществамиС кислородом большинство металлов образует оксиды
- 6. Взаимодействие с простыми веществамиС галогенами металлы образуют соли галогеноводородных
- 7. С серой металлы образуют сульфиды – соли сероводородной кислоты:Взаимодействие
- 8. Если металл реагирует с кислотой, то он
- 9. Игра: Химическая биржа
- 10. Часть I. Игра1. Класс делится на две-три
- 11. Слайд 11
- 12. Вопрос 1Почему в земной коре не могут
- 13. Смесь двух металлов второй группы главной подгруппы
- 14. Новый цинковый бак, в котором приготовили раствор
- 15. Вопрос 4Для тепловозов, имеющих двигатели с чугунными
- 16. Почему алюминиевую посуду нельзя мыть содой?Вопрос 5Учитывая,
- 17. Какие из предложенных солей подвергаются гидролизу: хлорид
- 18. Часть II. Проблемно-поисковый этап Должны мы на
- 19. Работа 1-й группы Работа 2-й группы Работа 3-й группы Работа 4-й группы
- 20. Цель исследования. Изучение протекания химических реакций при
- 21. Работа 2-й группыЦель исследования. Изучить взаимодействие щелочно-земельных
- 22. Цель исследования. Изучить протекание химических реакций при
- 23. Цель исследования. Изучить протекание химических реакций при
- 24. Часть III. Этап рефлексии (презентация полученных результатов)Учащиеся
Слайд 2По своим химическим свойствам все металлы являются восстановителями, все они сравнительно
Химические свойства металлов
Слайд 3В общем виде можно выразить схемой:
Химические свойства металлов
Слайд 4Металлы способны отдавать свои валентные электроны атомам неметаллов, ионам водорода, ионам
Химические свойства металлов
Взаимодействие с простыми веществами →
Слайд 5Взаимодействие с простыми веществами
С кислородом большинство металлов образует оксиды – амфотерные и основные:
4Li
4Al + 3O2 = 2Al2O3
Щелочные металлы, за исключением лития, образуют пероксиды:
2Na + O2 = Na2O2
Слайд 6Взаимодействие с простыми веществами
С галогенами металлы образуют соли галогеноводородных кислот:
Cu + Cl2 = CuCl2
С водородом самые
2Na + H2 = 2NaH
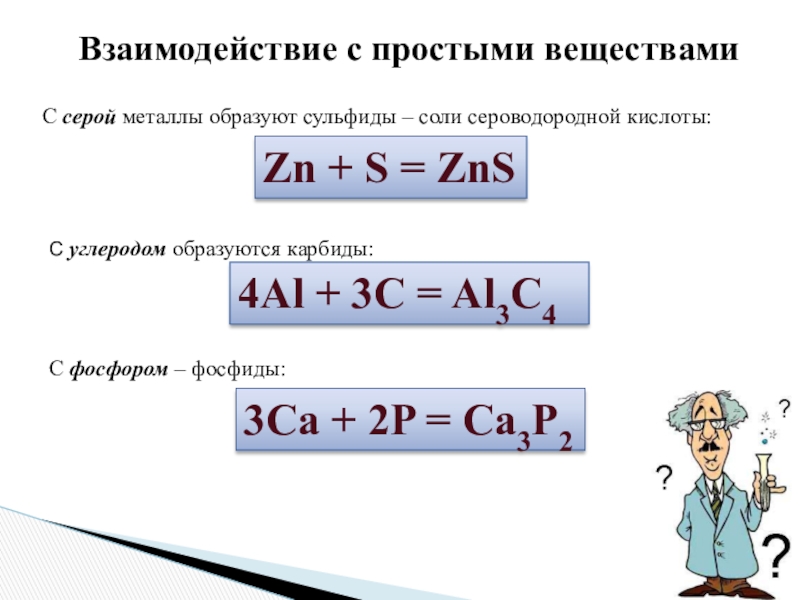
Слайд 7С серой металлы образуют сульфиды – соли сероводородной кислоты:
Взаимодействие с простыми веществами
Zn +
С углеродом образуются карбиды:
4Al + 3C = Al3C4
С фосфором – фосфиды:
3Ca + 2P = Ca3P2
Слайд 8Если металл реагирует с кислотой, то он входит в состав образующейся
Химические свойства металлов
Me + nH+ → Men+ + H2↑
Слайд 10Часть I. Игра
1. Класс делится на две-три команды
2. Каждая команда по
3. Команда, выбравшая вопрос, обсуждаю и выбирают отвечающего (2-3 минуты)
при правильном ответе команде начисляется ставка, которую они выбрали
если ответ не защитан, то команда-соперник имеет право ответить
если команды не ответили, то вопрос аннулируется
Слайд 12Вопрос 1
Почему в земной коре не могут встречаться в свободном состоянии
Ответ
Благодаря высокой реакционной способности щелочных металлов, взаимодействии с водой и химических свойствах их соединений.
Учащиеся на основании положения щелочных металлов в периодической системе химических элементов делают вывод об их активности и высокой скорости протекания реакции с водой, а также о взаимодействии оксида и гидроксида щелочного металла с кислотными оксидами и кислотами.
Учащиеся делают вывод о нахождении щелочных металлов в земной коре только в виде солей.
Ставки
Слайд 13Смесь двух металлов второй группы главной подгруппы растворили в воде. Один
Вопрос 2
Ответ
Ответ на данный вопрос предполагает сравнение активности металлов (магния и кальция), а также их соединений.
Учитывая, что кальций при обычных условиях взаимодействует с водой с образованием малорастворимого гидроксида, а магний с холодной водой не реагирует, учащиеся приходят к выводу, что в воде не растворился магний.
Ставки
Слайд 14Новый цинковый бак, в котором приготовили раствор медного купороса для опрыскивания
Вопрос 3
Учащиеся сравнивают активность металлов в электрохимическом ряду напряжений и делают вывод о протекании реакции замещения более активным металлом (Zn) менее активного (Cu) в растворимой соли, вследствие
Ответ
Ставки
Слайд 15Вопрос 4
Для тепловозов, имеющих двигатели с чугунными и стальными блоками, в
Необходимо учесть наличие разной среды растворов, а также проявление отдельными металлами свойств амфотерности. Анализируя значения рН, учащиеся делают вывод о невозможности нахождения алюминия в щелочной среде раствора, т.к. в этом случае будет протекать его взаимодействие со щелочью.
Ответ
Ставки
Слайд 16Почему алюминиевую посуду нельзя мыть содой?
Вопрос 5
Учитывая, что алюминий и его
Ответ
Ставки
Слайд 17Какие из предложенных солей подвергаются гидролизу: хлорид натрия, хлорид магния, карбонат
Вопрос 6
Данный вопрос направлен на идентификацию среды раствора, образованной в результате гидролиза соли. Учащиеся демонстрируют знания процесса гидролиза и объясняют образование среды раствора солей.
Ответ
Ставки
Слайд 18Часть II. Проблемно-поисковый этап
Должны мы на уроке истину установить,
При этом
Таблица исследования
Слайд 20Цель исследования. Изучение протекания химических реакций при взаимодействии щелочных металлов с
Опыт 1. В растворы хлоридов магния и железа осторожно помещают кусочек лития. Наблюдения заносят в протокол (бурно выделяется газ, выпадают осадки белого и бурого цвета).
Опыт 2. В раствор хлорида меди(II) помещают кусочек лития. Заносят наблюдения в протокол (выпадает осадок черного цвета).
Работа 1-й группы
Работы групп
Таблица исследования
Слайд 21Работа 2-й группы
Цель исследования. Изучить взаимодействие щелочно-земельных металлов с растворами солей.
Опыт
Опыт 2. В раствор хлорида магния поместите небольшое количество магния. Учащиеся записывают наблюдения в протокол исследования (растворение магния в растворе своей соли и выделение газа).
Работы групп
Таблица исследования
Слайд 22Цель исследования. Изучить протекание химических реакций при действии алюминия на растворы
Опыт 1. В раствор карбоната натрия опустите гранулу алюминия. Наблюдения учащиеся заносят в протокол (выпадение белого осадка и выделение газа).
Опыт 2. В раствор хлорида меди(II) поместите гранулу алюминия. В результате эксперимента выделяется бесцветный газ и большой объем порошкообразной меди на поверхности алюминия.
Опыт 3. В раствор нитрата меди(II) поместите гранулу алюминия. Учащиеся фиксируют отсутствие видимых признаков реакции.
Работа 3-й группы
Работы групп
Таблица исследования
Слайд 23Цель исследования. Изучить протекание химических реакций при действии металлов побочных подгрупп
Опыт 1. В раствор сульфата меди(II) опустите железные стружки. Учащиеся группы фиксируют выделение меди на поверхности железа.
Опыт 2. В раствор хлорида железа(III) поместите небольшое количество меди. В результате эксперимента происходит растворение меди.
Опыт 3. В раствор нитрата железа(III) поместите небольшое количество серебра. В результате эксперимента происходит растворение серебра.
Работа 4-й группы
Работы групп
Таблица исследования
Слайд 24Часть III. Этап рефлексии (презентация полученных результатов)
Учащиеся докладывают о достижении поставленных
Отчет групп учащихся поддерживается мультимедийной презентацией проведенного исследования.