- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Характеристика химического элемента.Решение задач (9 класс)
Содержание
- 1. Презентация по химии Характеристика химического элемента.Решение задач (9 класс)
- 2. В результате изучения темы ,вы будете способны:Характеризовать
- 3. «Единственный путь, ведущий к знанию, -это деятельность»Б. Шоу.
- 4. Задание: Дать характеристику
- 5. Алгоритм решения расчетных задач с использованием уравнений
- 6. ?АЛГОРИТМ РЕШЕНИЯ ЗАДАЧNmVνNxmxVxνx1. Написать уравнение реакцииПо известному
- 7. Алгоритм решения задач по химии
- 8. 2H2 + O2 = 2H2O
- 9. Дано:ν(Al2S3) =2,5 мольν(S) – ?Решение:
- 10. Слайд 10
- 11. Дано:m(Cu(OH)2)=14,7 гm(CuO) – ?Решение:0,15 моль
- 12. Дано:m(Zn)=13 гm(ZnCl2) – ?Решение: 13г
- 13. САМОСТОЯТЕЛЬНАЯ РАБОТА:ВАРИАНТ 1: Вычислите массу меди, которая
- 14. Разобрать конспект.Прорешать задачи конспектаРассчитайте, какая масса кислорода
- 15. Цель достигнута? Спасибо за урок!
- 16. Слайд 16
Слайд 2В результате изучения темы ,вы будете способны:
Характеризовать химический элемент по положению
Вычислять на основе химических уравнений количества вещества и массы вещества, зная количество/массу другого вещества.
Слайд 5Алгоритм решения расчетных задач с использованием уравнений химических реакций.
1.Внимательно прочитайте текст
2.Составьте уравнения хим. реакции
3. Выпишите данные из условия задачи с соответствующими единицами измерения (вместе с неизвестными величинами) в уравнение над формулами
4. Под формулами веществ запишите
соответствующие значения этих величин, найденные по уравнению реакции.
5. Составляете алгоритм задачи и решаете ее.
6.Записываете ответ задачи
Слайд 6?
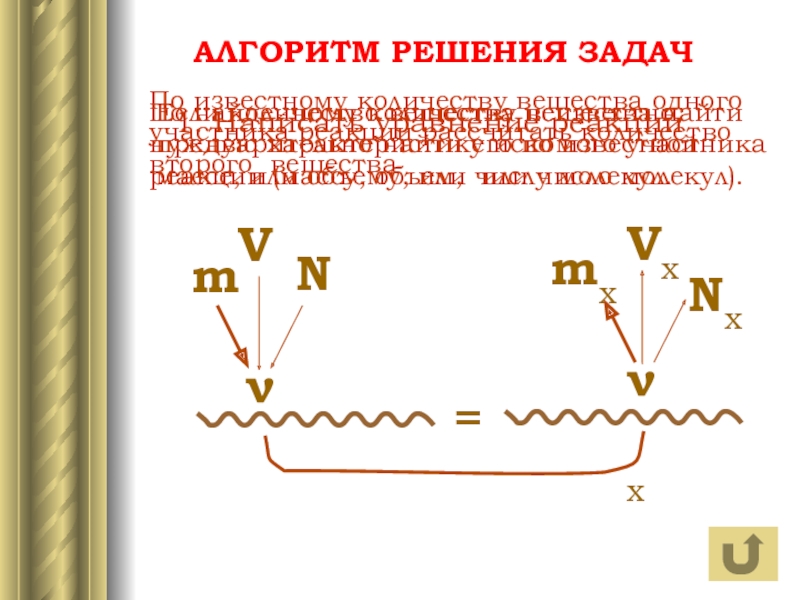
АЛГОРИТМ РЕШЕНИЯ ЗАДАЧ
N
m
V
ν
Nx
mx
Vx
ν
x
1. Написать уравнение реакции
По известному количеству вещества одного участника
Если количество вещества неизвестно, предварительно найти его по известной массе, или объему, или числу молекул.
По найденному количеству вещества найти нужную характеристику искомого участника реакции (массу, объем, или число молекул).
Слайд 82H2 + O2 = 2H2O
4
1. Записываем уравнение реакции. Обозначаем количества веществ, о которых идёт речь:
Дано:
ν (O2) = 4 моль
Найти:
ν(H2O) = ?
1 моль 2 моль
Решение
Ответ: ν(H2O) = 8 моль
Задача № 1. Вычислите сколько моль воды образуется при сжигании 4 моль кислорода в водороде
Слайд 9Дано:
ν(Al2S3) =2,5 моль
ν(S) – ?
Решение:
2Al + 3S = Al2S3
3 моль 1 моль
Ответ: ν(S) = 7,5 моль
Задача № 2. Определите количество вещества серы, необходимое для получения 2,5 моль сульфида алюминия.
Слайд 11Дано:
m(Cu(OH)2)=14,7 г
m(CuO) – ?
Решение:
0,15 моль x моль
Cu(OH)2
1 моль 1 моль
? г/моль ? г/моль
Ответ: m(CuO) = 12 г
Задача № 3. Вычислите массу оксида меди (II), образующегося при разложении 14,7 г гидроксида меди (II).
Слайд 12Дано:
m(Zn)=13 г
m(ZnCl2) – ?
Решение:
13г
Zn + 2HCl = ZnCl2 + H2↑
1 моль 1 моль
? г/моль ? г/моль
Ответ: m(ZnCl2) = 27,2 г
Задача №4. Рассчитайте массу соли, которая образуется при взаимодействии 13 г цинка с соляной кислотой.
Слайд 13САМОСТОЯТЕЛЬНАЯ РАБОТА:
ВАРИАНТ 1:
Вычислите массу меди, которая образуется при восстановлении избытком
CuO + H2 = Cu + H2O
ВАРИАНТ 2:
В реакцию с серной кислотой вступило 20 г гидроксида натрия. Рассчитайте массу образовавшейся соли.
2NaOH + H2SO4 = Na2SO4 + 2H2O
Слайд 14
Разобрать конспект.
Прорешать задачи конспекта
Рассчитайте, какая масса кислорода образуется при разложении 108
Вычислите объем (н.у.) газа, который образуется при взаимодействии цинка с раствором, содержащим 0,4 моль соляной кислоты
Домашнее задание