СОШ № 5
г. Новочеркасска
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Астат
Содержание
- 1. Презентация по химии Астат
- 2. ВведениеАстат - элемент главной подгруппы седьмой группы, шестого
- 3. Физические свойстваАстат — твёрдое вещество красивого сине-чёрного
- 4. Химические свойстваАстат отличается низкой упругостью паров, мало
- 5. Химические свойстваАстат растворяется в разбавленной соляной и
- 6. ИсторияПредсказан (как «эка-иод») Д. И. Менделеевым. В
- 7. Астат в природеАстат является наиболее редким элементом
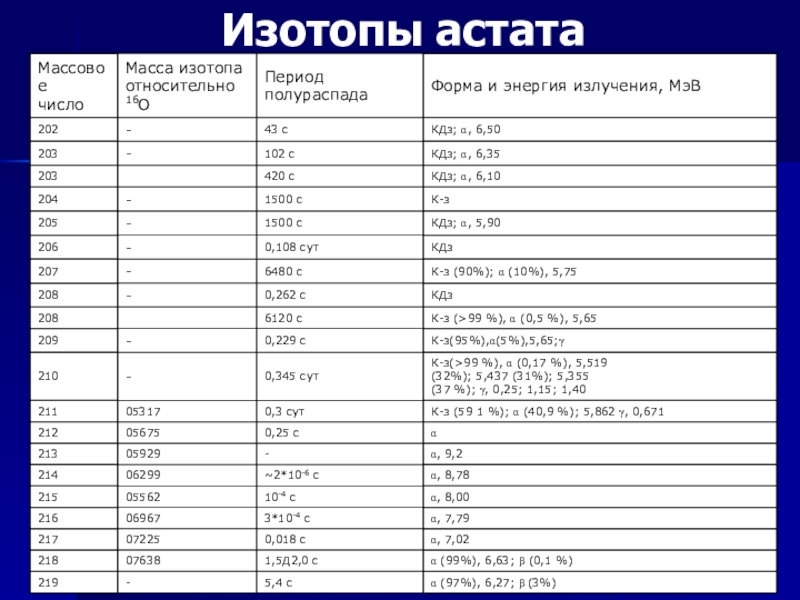
- 8. ИзотопыНа 2003 год известны 33 изотопа астата,
- 9. Изотопы астата
- 10. ПрименениеПервые попытки применить астат на практике были
- 11. ПрименениеАстат-211 испускает лишь альфа-лучи – весьма энергичные
- 12. Биологическая рольПри попадании в организм концентрируется в
- 13. Литератураhttp://samogo.net/articles.php?id=2507http://www.himsnab-spb.ru/article/ps/at/http://ximik.biz/himicheskie-elementi/39-astat-v-tablize-mendeleyevahttp://premier-pdc.narod.ru/chemfiles/element/at/at.htmlhttp://ru.wikipedia.org/wiki/%C0%F1%F2%E0%F2#.D0.9F.D1.80.D0.B8.D0.BC.D0.B5.D0.BD.D0.B5.D0.BD.D0.B8.D0.B5
ВведениеАстат - элемент главной подгруппы седьмой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 85. Обозначается символом At (лат. Astatium). Радиоактивен. Самый тяжёлый элемент из известных галогенов. Простое вещество астат при нормальных
Слайд 1«Редкие химические элементы и их применение»
«Астат»
Подготовила Борзенкова Юлия
Ученица 11Б класса
МБОУ
Слайд 2Введение
Астат - элемент главной подгруппы седьмой группы, шестого периода периодической системы химических
элементов Д. И. Менделеева, с атомным номером 85. Обозначается символом At (лат. Astatium). Радиоактивен. Самый тяжёлый элемент из известных галогенов. Простое вещество астат при нормальных условиях — нестабильные кристаллы чёрно-синего цвета. Молекула астата, по всей видимости, двухатомна (формула At2).
Астат – ядовитое вещество. Вдыхание его в совсем небольшом количестве способно вызвать сильное раздражение и воспаление дыхательных путей, а большая концентрация приводит к сильному отравлению.
Астат – ядовитое вещество. Вдыхание его в совсем небольшом количестве способно вызвать сильное раздражение и воспаление дыхательных путей, а большая концентрация приводит к сильному отравлению.
Слайд 3Физические свойства
Астат — твёрдое вещество красивого сине-чёрного цвета, по внешнему виду
похожее на иод. Для него характерно сочетание свойств неметаллов (галогенов) и металлов (полоний, свинец и другие). Как и иод, астат хорошо растворяется в органических растворителях и легко ими экстрагируется. По летучести немного уступает иоду, но также может легко возгоняться.
Температура плавления 302 °C, кипения (возгонки) 337 °C.
Температура плавления 302 °C, кипения (возгонки) 337 °C.
Слайд 4Химические свойства
Астат отличается низкой упругостью паров, мало растворим в воде, лучше
растворяется в органических растворителях.
Астат в водном растворе восстанавливается диоксидом серы SO2; как и металлы, он осаждается даже из сильнокислых растворов сероводородом (H2S). Вытесняется из сернокислых растворов цинком (свойства металла).
Как и все галогены, астат образует нерастворимую соль AgAt (астатид серебра). Он способен окисляться до состояния At(V), как и иод (например, соль AgAtO3 идентична по свойствам AgIO3).
Астат реагирует с бромом и иодом, при этом образуются межгалогенные соединения — иодид астата AtI и бромид астата AtBr:
Оба эти соединения растворяются в тетрахлорметане СCl4.
Астат в водном растворе восстанавливается диоксидом серы SO2; как и металлы, он осаждается даже из сильнокислых растворов сероводородом (H2S). Вытесняется из сернокислых растворов цинком (свойства металла).
Как и все галогены, астат образует нерастворимую соль AgAt (астатид серебра). Он способен окисляться до состояния At(V), как и иод (например, соль AgAtO3 идентична по свойствам AgIO3).
Астат реагирует с бромом и иодом, при этом образуются межгалогенные соединения — иодид астата AtI и бромид астата AtBr:
Оба эти соединения растворяются в тетрахлорметане СCl4.
Слайд 5Химические свойства
Астат растворяется в разбавленной соляной и азотной кислотах.
С металлами астат
образует соединения, в которых проявляет степень окисления −1, как и все остальные галогены (NaAt — астатид натрия). Подобно другим галогенам, астат может замещать водород в молекуле метана до получения тетраастатметана CAt4. При этом образуются сперва астатметан CH3At, затем диастатметан CH2At2 и астатоформ CHAt3.
В положительных степенях окисления астат образует кислородсодержащую форму, которую условно обозначают как Atτ+ (астат-тау-плюс).
В положительных степенях окисления астат образует кислородсодержащую форму, которую условно обозначают как Atτ+ (астат-тау-плюс).
Слайд 6История
Предсказан (как «эка-иод») Д. И. Менделеевым. В 1931 Ф. Аллисон с
сотрудниками (Алабамский политехнический институт) сообщили об открытии этого элемента в природе и предложили для него название «алабамин» (Ab), однако этот результат не подтвердился. Впервые астат был получен искусственно в 1940 Д. Корсоном, К. Р. Маккензи и Э. Сегре (Калифорнийский университет в Беркли). Для синтеза изотопа 211At они облучали висмут альфа-частицами.
В 1943—1946 годах изотопы астата были обнаружены в составе природных радиоактивных рядов
В русской терминологии элемент вначале назывался «астатин».
Также предлагались названия «гельветин» (в честь Гельвеции — древнего названия Швейцарии) и «лептин» (от греч. «слабый, шаткий»).
Название происходит от греческого слова «астатос», что буквально означает «неустойчивый». И элемент полностью соответствует данному ему наименованию: его жизнь коротка, период полураспада составляет всего 8,1 ч.
Название происходит от греческого слова «астатос», что буквально означает «неустойчивый». И элемент полностью соответствует данному ему наименованию: его жизнь коротка, период полураспада составляет всего 8,1 ч.
Слайд 7Астат в природе
Астат является наиболее редким элементом среди всех, обнаруженных в
природе. В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата. Постоянное присутствие астата в природе связано с тем, что его короткоживущие радионуклиды (215At, 218At и219At) входят в состав радиоактивных рядов 235U и 238U. Скорость их образования постоянна и равна скорости их радиоактивного распада, поэтому в земной коре содержатся сравнительно постоянное равновесное количество изотопов астата.
Слайд 8Изотопы
На 2003 год известны 33 изотопа астата, а также 23 метастабильных
возбуждённых состояния ядер астата. Все они радиоактивны. Самые устойчивые из них (от 207At до 211At) имеют период полураспада больше часа (наиболее стабилен 210At, T1/2=8,1 часа); однако у трёх природных изотопов период полураспада не превышает минуты.
В основном изотопы астата получают облучением металлических висмута или тория α-частицами высокой энергии с последующим отделением астата соосаждением, экстракцией, хроматографией или дистилляцией. Температура плавления 302 °C, кипения (возгонки) 337 °C.
В основном изотопы астата получают облучением металлических висмута или тория α-частицами высокой энергии с последующим отделением астата соосаждением, экстракцией, хроматографией или дистилляцией. Температура плавления 302 °C, кипения (возгонки) 337 °C.
Слайд 10Применение
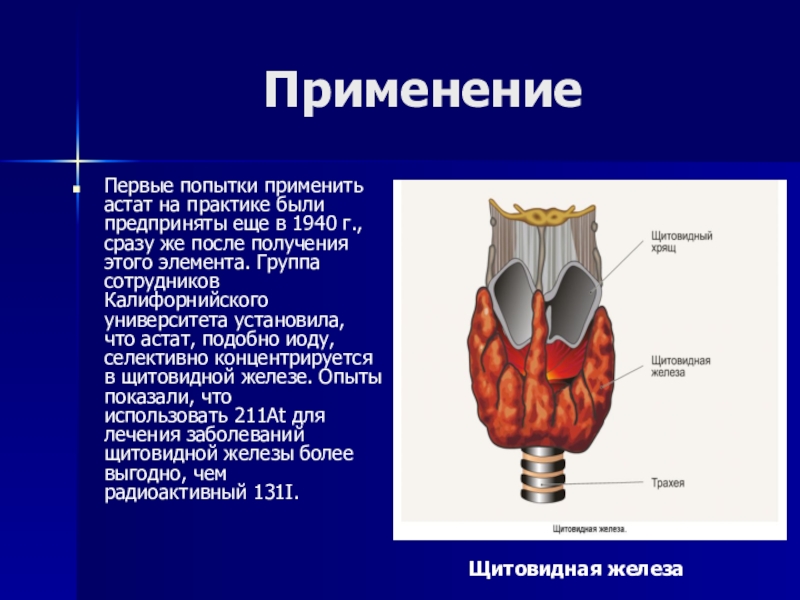
Первые попытки применить астат на практике были предприняты еще в 1940 г.,
сразу же после получения этого элемента. Группа сотрудников Калифорнийского университета установила, что астат, подобно иоду, селективно концентрируется в щитовидной железе. Опыты показали, что использовать 211At для лечения заболеваний щитовидной железы более выгодно, чем радиоактивный 131I.
Щитовидная железа
Слайд 11Применение
Астат-211 испускает лишь альфа-лучи – весьма энергичные на небольших расстояниях, но
не способные уйти далеко. В итоге они действуют лишь на щитовидную железу, не затрагивая соседнюю – паращитовидную. Радиобиологическое действие альфа-частиц астата на щитовидную железу в 2,8 раза сильнее, чем бета-частиц, излучаемых иодом-131. Это говорит о том, что в качестве терапевтического средства при лечении щитовидной железы астат весьма перспективен. Найдено и надежное средство выведения астата из организма. Роданид-ион блокирует накопление астата в щитовидной железе, образуя с ним прочный комплекс.
Роданид-ион
Слайд 12Биологическая роль
При попадании в организм концентрируется в печени. Как и иод, астат
способен накапливаться в щитовидной железе. α-излучение астата поражает близлежащие ткани, приводит к нарушению их функции и в перспективе — к образованию опухолей. Кроме того, частичное накопление астата наблюдается в молочных желёзах.