и химии Бородина О.В.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 11 класс Строение атома
Содержание
- 1. Презентация по химии 11 класс Строение атома
- 2. Цели1. Рассмотреть современные представления о строении атома.
- 3. Загадка По-античному наивно, Откровенно простовато Совершенно "неделимым" Называли греки….Тема нашего урока( запись в тетради)
- 4. Левкиппутверждал, что мир состоит из мельчайших частиц и пустотыВоззрения древнегреческих
- 5. ЭпикурСпособность атомов самостоятельно взаимодействовать друг с другом
- 6. XIX в.Началовозродил атомистическую теорию. Он установил, что атомы
- 7. В конце XIX и в начале XX вв. доказательства сложной структуры атома:- фотоэффект
- 8. Слайд 8
- 9. Слайд 9
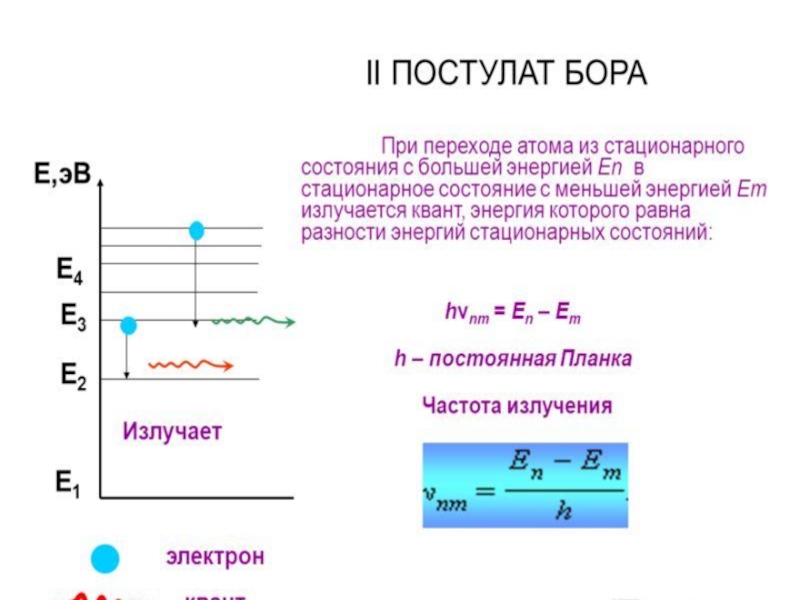
- 10. Квантовые постулаты Н.Бора(1913 г).
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Порядковый номер хим. элемента совпадает с зарядом
- 16. (Работа с ПСХЭ на определение количества p, n, ē).Электроны,
- 17. Слайд 17
- 18. Изотопы кислородаНапример, в природном О2 кроме атомов с
- 19. Задание 2
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Закрепление
- 25. ЗаданияТестовые задания с выбором одного ответа1 Электронная
- 26. ЗаданияЧисло протонов, нейтронов и электронов в атоме 40Ar соответственно
- 27. Порядковый номер элемента в Периодической системе указывает
- 28. Урок я усвоил на :Я знаюЯ умеюМне было интересноВызвало трудности Подведение итогов . Выставление оценок
- 29. Домашнее заданиеПараграф 1, задания 1-3, тесты
- 30. Спасибо за внимание !
- 31. Слайд 31
Цели1. Рассмотреть современные представления о строении атома. Дать важнейшие химические понятия: «хим. элемент», «изотопы». Научить учащихся определять состав и строение атома элемента по его положению в ПСХЭ.2. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы.3.
Слайд 2Цели
1. Рассмотреть современные представления о строении атома. Дать важнейшие химические понятия:
«хим. элемент», «изотопы». Научить учащихся определять состав и строение атома элемента по его положению в ПСХЭ.
2. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы.
3. Воспитывать любовь к предмету.
Тип урока: вводный
Метод: рассказ с элементами беседы
2. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы.
3. Воспитывать любовь к предмету.
Тип урока: вводный
Метод: рассказ с элементами беседы
Слайд 3Загадка
По-античному наивно,
Откровенно простовато
Совершенно "неделимым"
Называли греки….
Тема нашего урока( запись в тетради)
Слайд 4Левкипп
утверждал, что
мир состоит
из мельчайших
частиц и пустоты
Воззрения древнегреческих философов 500-200 гг.до н.э.
Демокрит назвал эти частицы атомами и считал, что они вечно существуют и способны двигаться. Форма, внешнее различие атомов. как считалось, придают определённые свойства телам. Например, атомы воды – гладкие, они способны перекатываться, и поэтому жидкости свойственна текучесть; атомы железа имеют зубчики, которыми они закрепляются друг за друга, что придаёт железу свойства твёрдого тела.
Слайд 6XIX в.Начало
возродил атомистическую теорию. Он установил, что атомы одного и того же
хим. элемента имеют одинаковые свойства, а разным элементам соответствуют разные атомы. Была введена важнейшая характеристика атома – атомная масса, относительные значения которой были установлены для ряда элементов. Однако атом по-прежнему считался неделимой частицей.
Слайд 7В конце XIX и в начале XX вв.
доказательства сложной структуры атома:
- фотоэффект – явление, когда при освещении металлов
с их поверхности испускаются носители электрического заряда ( А.Г. Столетов, 1889 г.);
- катодные лучи – поток отрицательно заряженных частиц–электронов в вакуумированной трубке, содержащей анод и катод (Дж. Томсон, 1897 г.);
- рентгеновские лучи – электромагнитное излучение, подобное видимому свету, но с гораздо более высокой частотой, испускаемое веществами при сильном воздействии на них катодных лучей;
- радиоактивность – явление самопроизвольного превращения одного хим. элемента в другой, сопровождающееся испусканием электронов, положительно заряженных частиц, других элементарных частиц и рентгеновского излучения ( А. Беккерель, М. Складовская-Кюри, 1896-189 гг.)
- катодные лучи – поток отрицательно заряженных частиц–электронов в вакуумированной трубке, содержащей анод и катод (Дж. Томсон, 1897 г.);
- рентгеновские лучи – электромагнитное излучение, подобное видимому свету, но с гораздо более высокой частотой, испускаемое веществами при сильном воздействии на них катодных лучей;
- радиоактивность – явление самопроизвольного превращения одного хим. элемента в другой, сопровождающееся испусканием электронов, положительно заряженных частиц, других элементарных частиц и рентгеновского излучения ( А. Беккерель, М. Складовская-Кюри, 1896-189 гг.)
Слайд 15Порядковый номер хим. элемента совпадает с зарядом ядра его атома.
. В
1920г он же ввел понятие о протоне как о «+» элементарной частице, входящей в состав всех атомных ядер, и предсказал существование нейтрона не имеющего электрического заряда ( т.к. число протонов недостаточное, зн. есть ещё и нейтроны, но заряда они не несут. Поэтому ядро имеет «+» заряд) .
Сумма числа протонов и нейтронов в атоме называется массовым числом, которое численно равно округлённому до целого числа значению Ar.
Сумма числа протонов и нейтронов в атоме называется массовым числом, которое численно равно округлённому до целого числа значению Ar.
Слайд 16(Работа с ПСХЭ на определение количества p, n, ē).
Электроны, протоны и нейтроны называют
элементарными частицами.
В ядре можно изменить:
А) число протонов в ядре, т.е. заряд атома →образуется новый элемент
Б) число нейтронов в ядре, т.е. заряд атома не измениться→новый элемент не образуется.
Рассмотрим данные случаи подробно.
А). При изменении числа протонов в ядре из исходного эл-та образуются совсем др. хим. эл-ты. Такие процессы называются ядерными.
Ядерные реакции – это процессы превращения атомов одних элементов в другие.
14N + 4He →17O +1 H - 1919г Э.Резерфорд.
226Ra →222 Rn + ….. 14 С →…..+ 0β (ē)
14N +1 n →1 p + ….. 56 Fe + 1 n → 1 p + …..
Для осуществления яд. Реакций широко применяются ускорители заряженных частиц – мощные установки, в которых получают пучки частиц с большим значением энергии.
В ядре можно изменить:
А) число протонов в ядре, т.е. заряд атома →образуется новый элемент
Б) число нейтронов в ядре, т.е. заряд атома не измениться→новый элемент не образуется.
Рассмотрим данные случаи подробно.
А). При изменении числа протонов в ядре из исходного эл-та образуются совсем др. хим. эл-ты. Такие процессы называются ядерными.
Ядерные реакции – это процессы превращения атомов одних элементов в другие.
14N + 4He →17O +1 H - 1919г Э.Резерфорд.
226Ra →222 Rn + ….. 14 С →…..+ 0β (ē)
14N +1 n →1 p + ….. 56 Fe + 1 n → 1 p + …..
Для осуществления яд. Реакций широко применяются ускорители заряженных частиц – мощные установки, в которых получают пучки частиц с большим значением энергии.
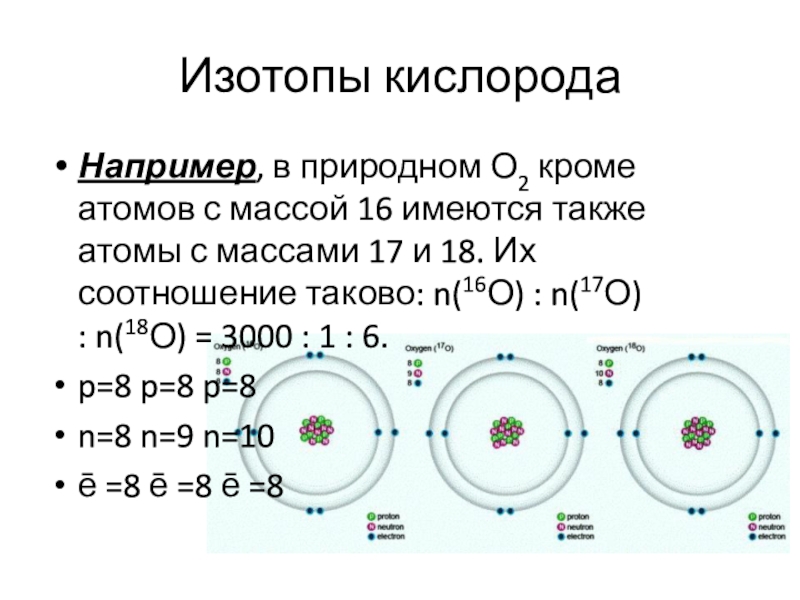
Слайд 18Изотопы кислорода
Например, в природном О2 кроме атомов с массой 16 имеются также
атомы с массами 17 и 18. Их соотношение таково: n(16О) : n(17О) : n(18О) = 3000 : 1 : 6.
p=8 p=8 p=8
n=8 n=9 n=10
ē =8 ē =8 ē =8
p=8 p=8 p=8
n=8 n=9 n=10
ē =8 ē =8 ē =8
Слайд 25Задания
Тестовые задания с выбором одного ответа
1 Электронная формула внешнего энергетического уровня
атома серы
А) 3s23p2 В) 3s23p4 С) 3s13p4 D) 4s24p4 E) 4s24p4 F)3s33p4 G)4s24p2 H)3s23p6
2. Порядковый номер элемента в Периодической системе указывает на
A) заряд ядра атома
В) число электронов в наружном слое атома
С) число электронных слоев в атоме
D) значение электроотрицательности элемента
Е) число энергетических подуровней на электронном слое
F) значение атомной массы элемента
G) число нейтронов в атоме
H) максимальную валентность элемента в соединениях с кислородом
3. Ряд чисел 2,8,5 соответствует распределению электронов по энергетическим уровням атома
А) алюминия В) фосфора С) азота D) хлора Е) сера F) аргон G) кремний H) магний
А) 3s23p2 В) 3s23p4 С) 3s13p4 D) 4s24p4 E) 4s24p4 F)3s33p4 G)4s24p2 H)3s23p6
2. Порядковый номер элемента в Периодической системе указывает на
A) заряд ядра атома
В) число электронов в наружном слое атома
С) число электронных слоев в атоме
D) значение электроотрицательности элемента
Е) число энергетических подуровней на электронном слое
F) значение атомной массы элемента
G) число нейтронов в атоме
H) максимальную валентность элемента в соединениях с кислородом
3. Ряд чисел 2,8,5 соответствует распределению электронов по энергетическим уровням атома
А) алюминия В) фосфора С) азота D) хлора Е) сера F) аргон G) кремний H) магний
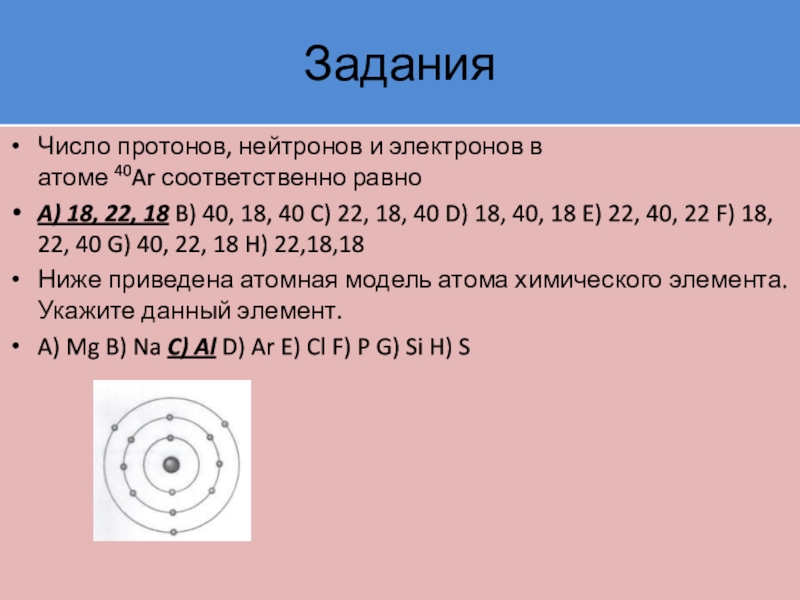
Слайд 26Задания
Число протонов, нейтронов и электронов в атоме 40Ar соответственно равно
A) 18, 22, 18 B)
40, 18, 40 C) 22, 18, 40 D) 18, 40, 18 E) 22, 40, 22 F) 18, 22, 40 G) 40, 22, 18 H) 22,18,18
Ниже приведена атомная модель атома химического элемента. Укажите данный элемент.
A) Mg B) Na C) Al D) Ar E) Cl F) P G) Si H) S
Ниже приведена атомная модель атома химического элемента. Укажите данный элемент.
A) Mg B) Na C) Al D) Ar E) Cl F) P G) Si H) S
Слайд 27Порядковый номер элемента в Периодической системе указывает на
A) заряд ядра атома
В)
число электронов в наружном слое атома
С) число электронов в атоме
D) число нейтронов в атоме
Е) число энергетических подуровней на электронном слое
F) число протонов
G) максимальную валентность элемента в соединениях с кислородом
H) число электронных слоев в атоме . На последнем энергетическом уровне находится 8 электронов у
А) aтом аргона Ar B) атом кальция С) атом калия K D) анион хлора Сl-
Е) атом калия К F)катион кальция Са2+ G) атом хлора H) анион фтора F-
. Электронная формула 1s22s22р6 соответствует
А) атому неона B) аниону кислорода C) атому кислорода D) аниону фтора
E) атому фтора F) атом кислорода G) атому натрия H) аниону хлора
. Атом данного металла имеет электронную формулу внешнего энергетического уровня ns2np1 A) В B) O C) P D) As E) Аl F) C G) Ga H)Si . В реакциях элемент отдает один электрон
А) Li В) Zn С) Cl D) Rb Е) Na F) Аl G) Ca H) F
. Двухэлектронную внешнюю оболочку имеет ион А) S6+ В) S2- С) Br5+ D) S4+ Е) С2+ F) Sn4+ G) С4+ H) Br-
. Является p- элементом
А) S В) Na С) Ca D) P Е) O F) K G) Zn H) Li
. В реакциях элемент принимает один электрон
А) Li В) Zn С) Cl D) Rb Е) Вr F) K G) Ca H) F
. Атом элемента, максимальная степень окисления которого + 4, в основном состоянии может иметь электронную конфигурацию внешнего энергетического уровня:
А) 3s23p4 В) 2s22p2 С) 2s22p4 D)3s23p2 Е) 2s22p6 F) 3s23p4 G) 4s24p2 H) 2s22p5
С) число электронов в атоме
D) число нейтронов в атоме
Е) число энергетических подуровней на электронном слое
F) число протонов
G) максимальную валентность элемента в соединениях с кислородом
H) число электронных слоев в атоме . На последнем энергетическом уровне находится 8 электронов у
А) aтом аргона Ar B) атом кальция С) атом калия K D) анион хлора Сl-
Е) атом калия К F)катион кальция Са2+ G) атом хлора H) анион фтора F-
. Электронная формула 1s22s22р6 соответствует
А) атому неона B) аниону кислорода C) атому кислорода D) аниону фтора
E) атому фтора F) атом кислорода G) атому натрия H) аниону хлора
. Атом данного металла имеет электронную формулу внешнего энергетического уровня ns2np1 A) В B) O C) P D) As E) Аl F) C G) Ga H)Si . В реакциях элемент отдает один электрон
А) Li В) Zn С) Cl D) Rb Е) Na F) Аl G) Ca H) F
. Двухэлектронную внешнюю оболочку имеет ион А) S6+ В) S2- С) Br5+ D) S4+ Е) С2+ F) Sn4+ G) С4+ H) Br-
. Является p- элементом
А) S В) Na С) Ca D) P Е) O F) K G) Zn H) Li
. В реакциях элемент принимает один электрон
А) Li В) Zn С) Cl D) Rb Е) Вr F) K G) Ca H) F
. Атом элемента, максимальная степень окисления которого + 4, в основном состоянии может иметь электронную конфигурацию внешнего энергетического уровня:
А) 3s23p4 В) 2s22p2 С) 2s22p4 D)3s23p2 Е) 2s22p6 F) 3s23p4 G) 4s24p2 H) 2s22p5
Слайд 28Урок я усвоил на :
Я знаю
Я умею
Мне было интересно
Вызвало трудности
Подведение
итогов . Выставление оценок