- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку в 8 классе по теме Кислоты
Содержание
- 1. Презентация к уроку в 8 классе по теме Кислоты
- 2. Е́сли в па́ре элеме́нтов кислоро́д вторы́м
- 3. Е́сли фо́рмулы
- 4. Как называ́ются раствори́мые в воде́ основа́ния? NaOH – KOH - е́дкое калие́дкий натр
- 5. Распредели́ть фо́рмулы веще́ств по кла́ссам: Са(ОН)
- 6. Слайд 6
- 7. Слайд 7
- 8. Кисло́ты в приро́деЛимо́нная кислота́Муравьи́ная кислота́Муравьи́ная кислота́Аскорби́новая кислота́
- 9. Кисло́ты в проду́ктах пита́нияПри скиса́нии молока́, квашении
- 10. Пра́вила те́хники безопа́сности. 1.Прове́рить нали́чие
- 11. Измене́ние окра́ски индика́торовкра́сныйкра́сно-ро́зовый
- 12. Слайд 12
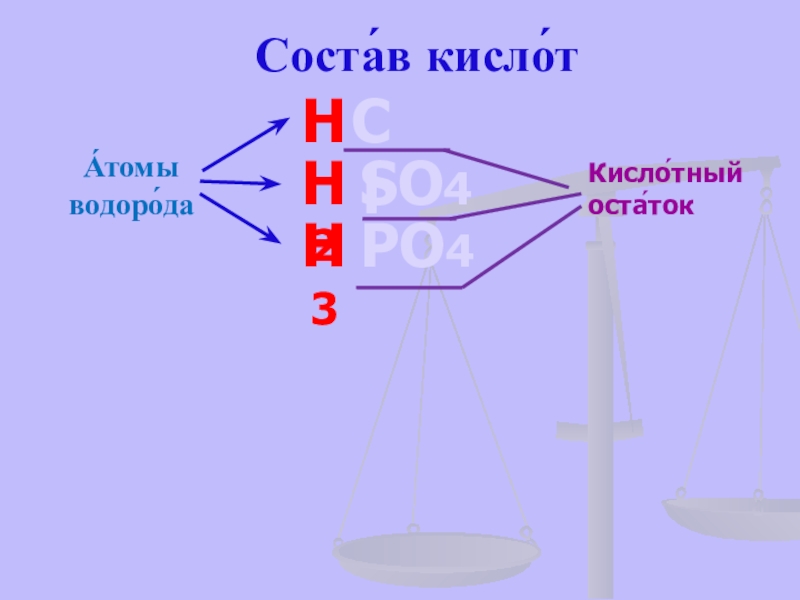
- 13. Соста́в кисло́тНСlН2SО4Н3РО4А́томыводоро́да Кисло́тный оста́ток
- 14. HCl – соля́ная кислота́ HNO2 – азо́тистая
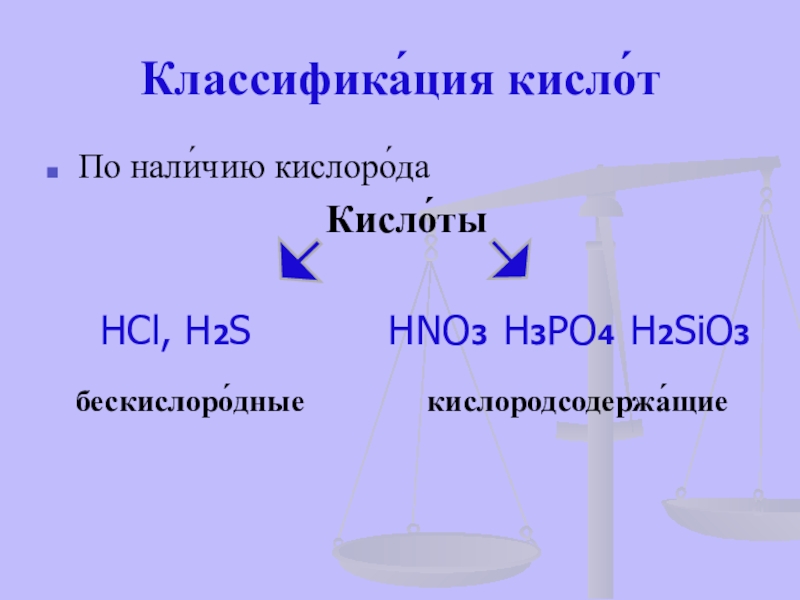
- 15. Классифика́ция кисло́тПо нали́чию кислоро́даКисло́ты HCl, H2S HNO3 H3PO4 H2SiO3бескислоро́дныекислородсодержа́щие
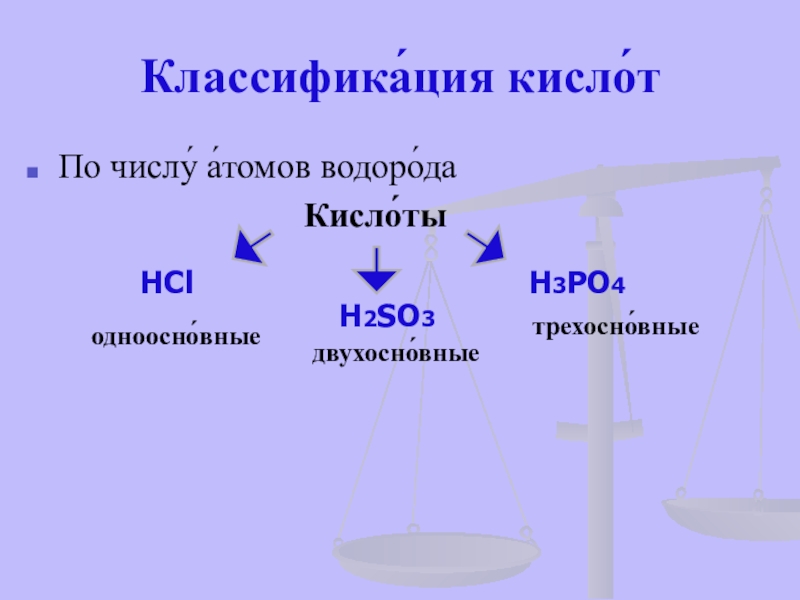
- 16. Классифика́ция кисло́тПо числу́ а́томов водоро́да
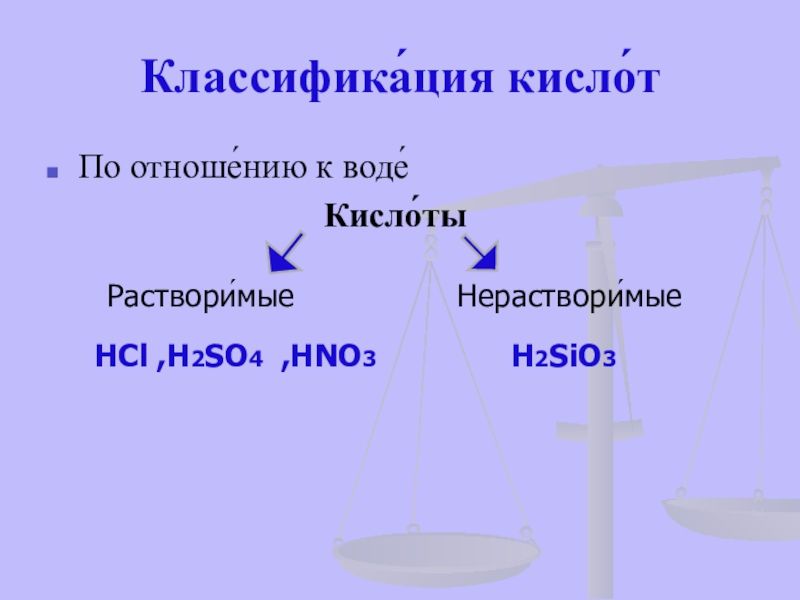
- 17. Классифика́ция кисло́тПо отноше́нию к воде́
- 18. Кисло́ты не существу́ющие в свобо́дном ви́де:H2CO3H2SO3Так как они разлага́ются на во́ду и газ (соотве́тствующий окси́д)
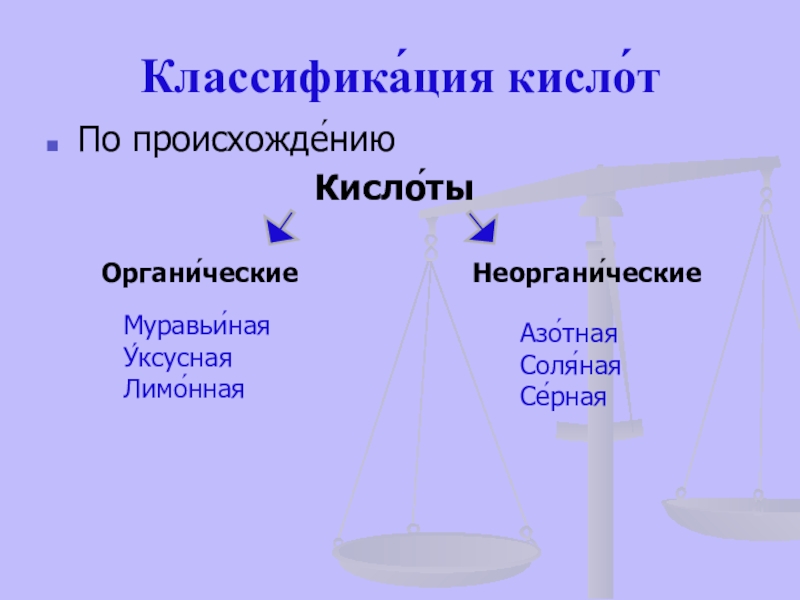
- 19. Классифика́ция кисло́тПо происхожде́нию
- 20. Определи́ть сте́пени окисле́ния элеме́нтов, входя́щих
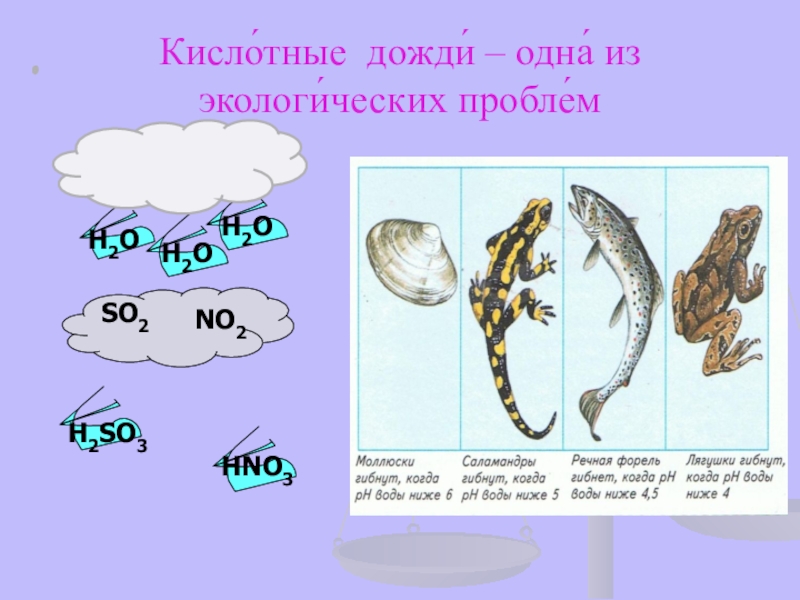
- 21. Кисло́тные дожди́ – одна́ из экологи́ческих пробле́мН2ОН2ОН2ОNО2 SО2 Н2SО3НNO3
- 22. Пра́вила те́хники безопа́сности при рабо́те с кисло́тами
- 23. Найди́те и назови́те фо́рмулы кисло́т кото́рые спря́таны в те́ксте CaCLKOHNO2H2SO3SiO2 P2O5NaOH2CO3NOHCL MgCO3HCLBaOH2SO4
- 24. В ка́ждом ряду́ найди́те ли́шнюю фо́рмулуH2SO3
- 25. Да́йте характери́стику сле́дующим кисло́там:HCl
- 26. Экспре́сс-тест 1.В соста́в кисло́т вхо́дит а́том водоро́да.2.Кисло́ты
- 27. Ключ к те́сту1+2+3-4+5-6-7+8-9-10+
- 28. Оце́нка «5»-10 пра́вильных отве́тов «4»-8-9 пра́вильных отве́тов «3»-6-7 пра́вильных отве́тов
- 29. Слайд 29
- 30. Рефлекси́я. Зако́нчи предложе́ния.
- 31. Выставление оценок за урок
Слайд 2 Е́сли в па́ре элеме́нтов
кислоро́д вторы́м стои́т ,
ты же
называ́ется …
СaO, SО2, Fе2О3 , Nа2О, Сl2О7
окси́д
Слайд 3 Е́сли фо́рмулы нача́ло представля́ется с мета́лла,
основа́ния
КОН,АI(OH)3,Ba(OH)2,Cu(OH)2
Слайд 5Распредели́ть фо́рмулы веще́ств по кла́ссам: Са(ОН) 2, AI2O3, Н2SО4 CaO,Na2O, Mg(OH)2 НNО3 HСI,
AI2O3,CaO,Na2O
Ca(OH)2,Mg(OH)2,
AI(OH)3
H2SO4,HNO3,HCI
Слайд 7 Те́ма: Кисло́ты.
Слайд 8Кисло́ты в приро́де
Лимо́нная кислота́
Муравьи́ная кислота́
Муравьи́ная кислота́
Аскорби́новая кислота́
Слайд 9Кисло́ты в проду́ктах пита́ния
При скиса́нии молока́, квашении капу́сты образу́ется моло́чная кислота.́
При
Слайд 10 Пра́вила те́хники безопа́сности. 1.Прове́рить нали́чие реакти́вов и обору́дования. 2.Не про́бовать вещества́
Слайд 14HCl – соля́ная кислота́
HNO2 – азо́тистая кислота́
HNO3 – азо́тная кислота́
H2SO3
H2SO4 – се́рная кислота́
H2CO3 – у́гольная кислота́
H3PO4 – фо́сфорная кислота́
H2SiO3 – кре́мниевая кислота́
Кисло́ты
Слайд 15Классифика́ция кисло́т
По нали́чию кислоро́да
Кисло́ты
HCl, H2S
бескислоро́дные
кислородсодержа́щие
Слайд 16Классифика́ция кисло́т
По числу́ а́томов водоро́да
HCl
H2SO3
H3PO4
одноосно́вные
двухосно́вные
трехосно́вные
Слайд 17Классифика́ция кисло́т
По отноше́нию к воде́
Раствори́мые
Нераствори́мые
HCl ,H2SO4 ,HNO3
H2SiO3
Слайд 18Кисло́ты не существу́ющие в свобо́дном ви́де:
H2CO3
H2SO3
Так как они разлага́ются на во́ду
Слайд 19Классифика́ция кисло́т
По происхожде́нию
Органи́ческие
Неоргани́ческие
Азо́тная
Соля́ная
Се́рная
Муравьи́ная
У́ксусная
Лимо́нная
Слайд 20 Определи́ть сте́пени окисле́ния элеме́нтов, входя́щих в соста́в кисло́т и
HNO3
H2CO3
H3PO4
Слайд 22Пра́вила те́хники безопа́сности при рабо́те с кисло́тами .
Концентри́рованные кисло́ты храня́т в
Пра́вила разбавле́ния концентри́рованных кисло́т.
Рис.64 с.123
Снача́ла вода́,
Зате́м кислота́,
Ина́че случи́тся беда́.
Слайд 23Найди́те и назови́те фо́рмулы кисло́т кото́рые спря́таны в те́ксте
CaCLKOHNO2H2SO3SiO2
MgCO3HCLBaOH2SO4
Слайд 25Да́йте характери́стику сле́дующим кисло́там:
HCl
По пла́ну:
-Нали́чие кислоро́да
-Осно́вность
-Раствори́мость
Слайд 26Экспре́сс-тест
1.В соста́в кисло́т вхо́дит а́том водоро́да.
2.Кисло́ты ки́слые на вкус.
3.Азо́тная кислота́ не
4.У́гольная кислота́ не существу́ет в свобо́дном ви́де.
5.Ла́кмус в кислоте́- бесцве́тный.
6.Сте́пень окисле́ния кислоро́да в кисло́тах- ми́нус 5.
7.Кисло́ты храня́тся в тёмных скля́нках.
8.Щёлочи не раствори́мые основа́ния.
9.Кисло́ты состоя́т из мета́лла и кисло́тного оста́тка.
10.Окси́ды это сло́жные вещества́.
Слайд 28Оце́нка
«5»-10 пра́вильных отве́тов
«4»-8-9 пра́вильных отве́тов
«3»-6-7 пра́вильных отве́тов
Слайд 29
Вы́учить назва́ния кисло́т .
Подгото́вить сообще́ние на тему:
«Кисло́ты в быту́»