- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку по теме
Содержание
- 1. Презентация к уроку по теме
- 2. Слайд 2
- 3. Шведский ученый.В 1771 году провел опыты по
- 4. Английский ученый.В 1774 году разложениемoксида ртути (
- 5. 1743 - 1794С целью
- 6. Oxygenium C лат. оxygenium – “ рождающий
- 7. 2 Н2O2 = 2 Н2O + O2
- 8. Условия реакций – нагревание ( t )
- 9. 2 KMnO4 = K2MnO4 + MnO2 +
- 10. Способы собирания и обнаружения кислорода а –
- 11. Выполнение и оформление практической работы. (стр70)Практическая
- 12. Кислород получают из воздуха
- 13. Используя анкетные данные вещества, определите свойства
- 14. Правильные ответыКритерии выставления оценки:«5»- 13-14 правильных ответов,«4»- 10-12 правильных ответов,«3»- 7-9 правильных ответов.
- 15. Домашнее заданиеСтраница 60 Упражнение 11,задача 2.
- 16. Кислород на
- 17. Кислород входит в состав воды, которая составляет
Слайд 2
КОРНЕЛИУС
Голландский алхимик и технолог.
Получил кислород примерно за 150 лет
до Пристли и Шееле при нагревании нитрата калия:
2КNO3 = 2KNO2 + O2 ↑
Его открытие было засекречено, т.к. использование полученного газа предполагалось для дыхания людей на подводных лодках
1572 - 1633
Слайд 3
Шведский ученый.
В 1771 году провел опыты
по разложению
оксида ртути (
2HgO = 2Hg + O2↑
изучил свойства
образующегося газа.
Однако результаты
его исследований
были опубликованы
лишь в 1777 году.
1742 - 1786
КАРЛ ВИЛЬГЕЛЬМ ШЕЕЛЕ
Слайд 4
Английский ученый.
В 1774 году разложением
oксида ртути ( II )
получил кислород
и
изучил
2HgO = 2Hg + O2↑
1733 - 1804
ДЖОЗЕФ ПРИСТЛИ
Слайд 5
1743 - 1794
С целью проверки опытов
Шееле и
в 1774 году получил кислород,
установил его природу и изучил
его способность соединяться
с фосфором и серой при горении
и металлами при обжиге.
Изучил состав атмосферного воздуха.
Создал кислородную теорию горения.
Совместно с Ж. Менье установил
сложный состав воды и получил
воду из кислорода и водорода.
2H2 + O2 = 2H2O
Лавуазье показал, что процесс дыхания
подобен процессу горения.
АНТУАН ЛОРАН ЛАВУАЗЬЕ
Слайд 6Oxygenium
C лат. оxygenium – “ рождающий кислоту”
С греч. oxygenes
Название кислороду Oxygenium
дал А. Лавуазье
Слайд 7
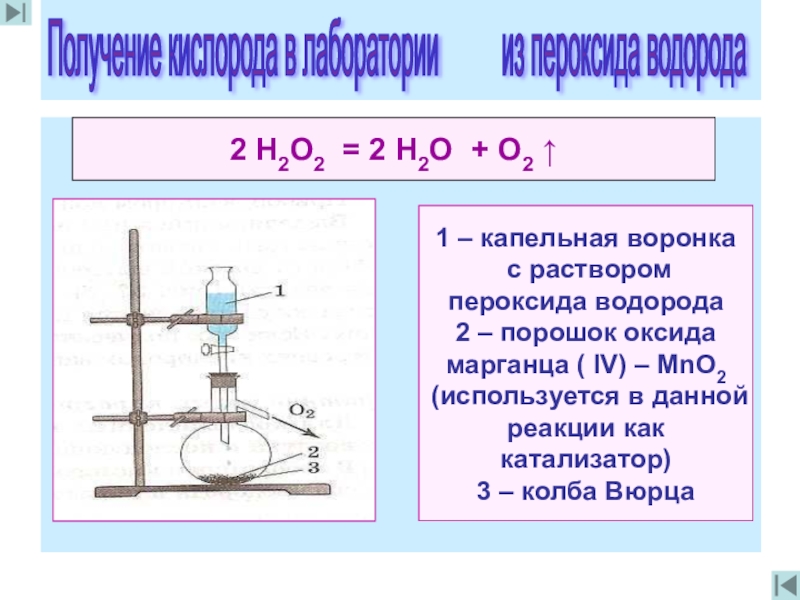
2 Н2O2 = 2 Н2O + O2 ↑
1 – капельная воронка
пероксида водорода
2 – порошок оксида
марганца ( IV) – МnO2
(используется в данной
реакции как катализатор)
3 – колба Вюрца
Получение кислорода в лаборатории из пероксида водорода
Слайд 8
Условия реакций – нагревание ( t )
3РbO2 = Рb3O4 + О2 ↑ 2KClO3 = 2KCl + 3О2 ↑
Условия реакции – действие электрического тока ( )
2Н2О = 2Н2 ↑ + О2 ↑
Реакции, идущие
с образованием кислорода.
Слайд 9
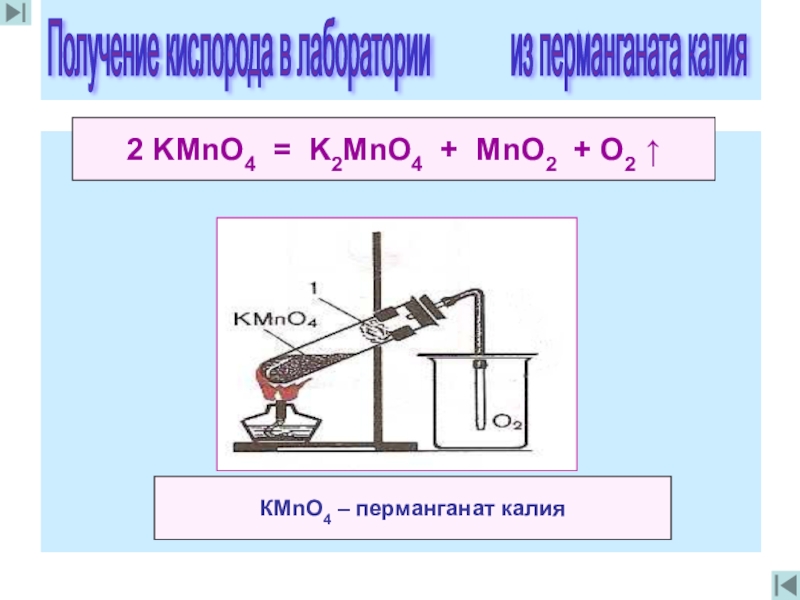
2 KMnO4 = K2MnO4 + MnO2 + O2 ↑
КМnO4 – перманганат
Получение кислорода в лаборатории из перманганата калия
Слайд 10
Способы собирания и обнаружения кислорода
а – вытеснением воды ( над
б – вытеснением воздуха;
1 – вспыхнувшая тлеющая лучина –доказательство наличия кислорода.
Слайд 11Выполнение и оформление
практической работы. (стр70)
Практическая работа №3
Получение кислорода, доказательство его
Цель:
Ход работы:
Заполнение таблицы:
При выполнении практической работы соблюдаем правила техники безопасности.
Слайд 12 Кислород получают из воздуха
газовой ректификацией
Воздух охлаждают
Далее жидкий воздух подвергают перегонке
Жидкий азот испаряется при – 196 ОС
( t кип. жидкого азота)
Жидкий кислород испаряется при – 183 ОС
( t кип. жидкого кислорода)
Газообразный кислород хранят в стальных баллонах, окрашенных в голубой цвет, под давлением 1 - 1,5 МПА
Получение в промышленности
Слайд 13Используя анкетные данные вещества,
определите свойства кислорода:
1.Входит в состав всех живых
2.Входит в состав воздуха.
3.Продукт фотосинтеза.
4.Газ при обычных условиях.
5.Без цвета, без запаха.
6.Без вкуса.
7.Малорастворим в воде.
8.Тяжелее воздуха.
9.Поддерживает дыхание.
10.Поддерживает горение.
11.Легче воздуха.
12.Не поддерживает дыхание.
13.Имеет запах, имеет цвет.
14.Характерна аллотропия.
Слайд 14Правильные ответы
Критерии выставления оценки:
«5»- 13-14 правильных ответов,
«4»- 10-12 правильных ответов,
«3»- 7-9
Слайд 16
Кислород на Земле является
т.к он обеспечивает протекание
таких важных процессов, как:
дыхание всех живых организмов
гниение органических масс
(помимо воздействия грибов и бактерий)
горение веществ
Какая cамая важная функция у кислорода на Земле ?
Слайд 17
Кислород входит в состав воды, которая составляет большую часть массы живых
Кислород входит в состав биологически важных молекул, образующих живую материю
(белки, углеводы, жиры, гормоны, ферменты и др. )
Кислород в виде простого вещества О2 необходим как окислитель для протекания реакций, дающих клеткам необходимую для жизнедеятельности энергию
Кислород - элемент жизни