Видный английский философ 17 века Ф. Бэкон сравнивал метод познания с фонарём, освещающим дорогу путнику, идущему в темноте.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии на тему Сравнительная характеристика галогенов(9 класс)
Содержание
- 1. Презентация к уроку химии на тему Сравнительная характеристика галогенов(9 класс)
- 2. Отгадай элементЭтот химический элемент входит в состав
- 3. Na +1 Cl -1 +1 -1 «Рождающие
- 4. Сравнительная характеристика галогенов.Урок химии в 9 классе.Учитель Петрова М.П.
- 5. Цель урокаДать общую характеристику галогенов на основе их строения, физических и химических свойств.
- 6. Задачи урокаОбразовательные:изучить строение, физические и химические свойства
- 7. Строение атомаAt – редко встречается в природеF271s²2s²2pCl2871s²2s²2p 3s²3pBr281871s²2s²2p 3s²3p 3d 4s²4pI28181871s²2s²2p 3s²3p 3d 4s²4p 4d 5s²5p
- 8. Физические свойства галогенов
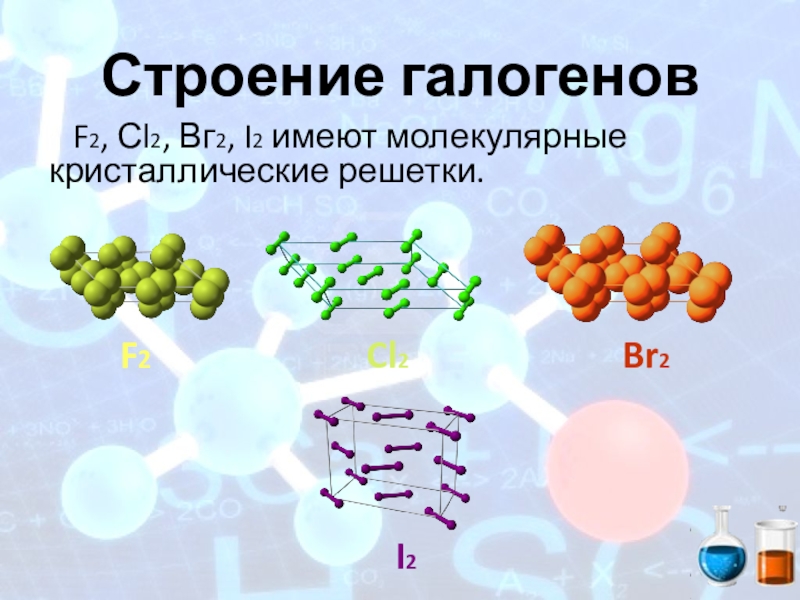
- 9. Строение галогеновF2, Сl2, Вг2, I2 имеют молекулярные кристаллические решетки.F2Cl2Br2I2
- 10. Определите тип связиCl2 - ковалентная неполярнаяClCl+ClClF2 - ковалентная неполярнаяBr2 I2 - ковалентная неполярная- ковалентная неполярная
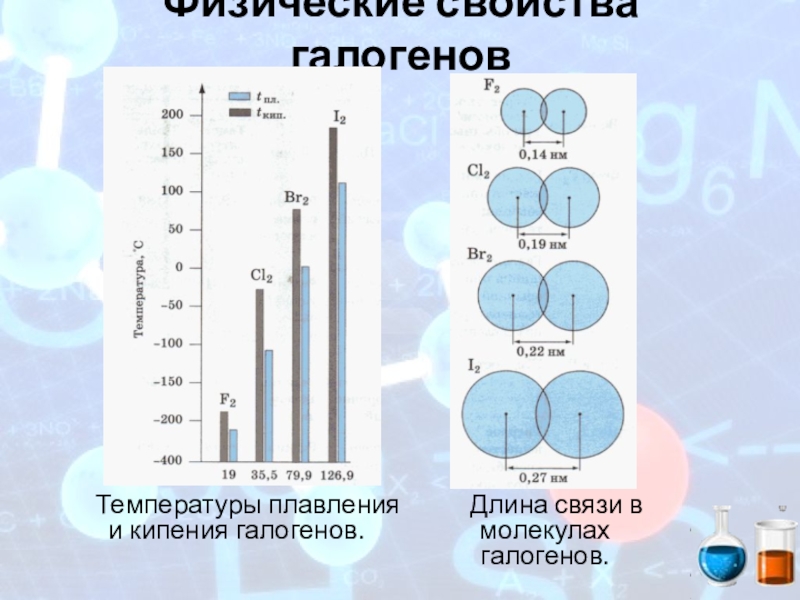
- 11. Физические свойства галогеновТемпературы плавления и кипения галогенов.Длина связи в молекулах галогенов.
- 12. Общая характеристика галогенов Все галогены имеют молекулярную
- 13. Химические свойства галогенов
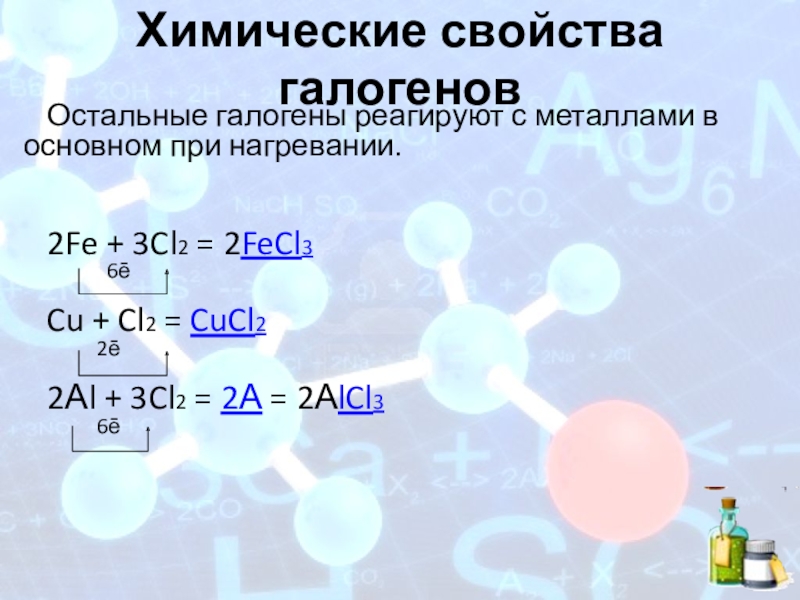
- 14. Химические свойства галогеновОстальные галогены реагируют с металлами
- 15. Ослабление окислительных свойств галогеновОслабление окислительных свойств галогенов
- 16. Более активные галогены вытесняют менее активные из
- 17. Получение В лаборатории*МnO2 + 4HCI = MnCI2
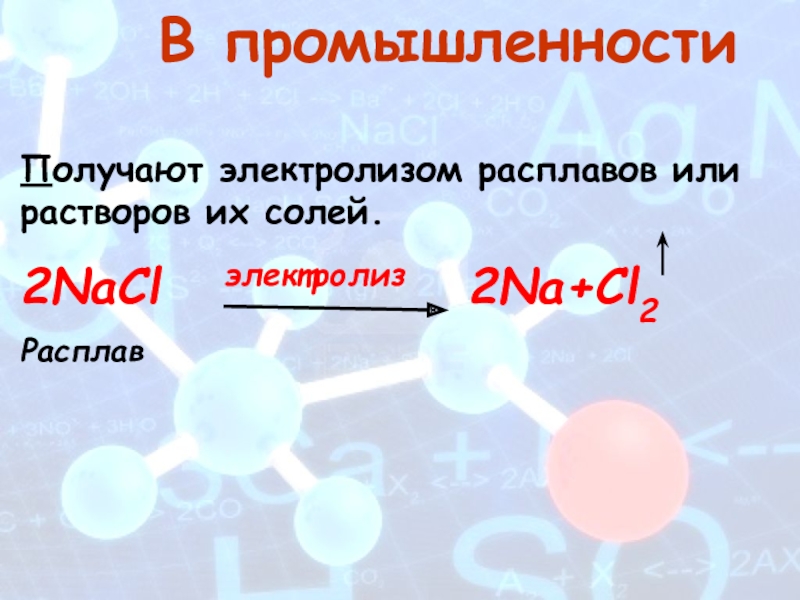
- 18. В промышленностиПолучают электролизом расплавов или растворов их солей.2NaCl электролиз 2Na+Cl2 Расплав
- 19. Качественные реакции на галогениды:Для определения
- 20. Критерии оценивания работы на уроке:17-20 баллов- «5»13-16 баллов- «4»10-12 баллов – «3»Менее 10 баллов- «2».
- 21. Домашнее задание Прочитать § 12, выполнить упр.2,4,5Приготовить
- 22. Спасибо за работу!
- 23. Решите кроссвордынноволзхлоридыьмесфнкаогзторкоислителивоастатазыг123456781. Агрегатное состояние первых двух представителей
Слайд 1«Познание – это солнечный свет, без которого человечество не может развиваться».
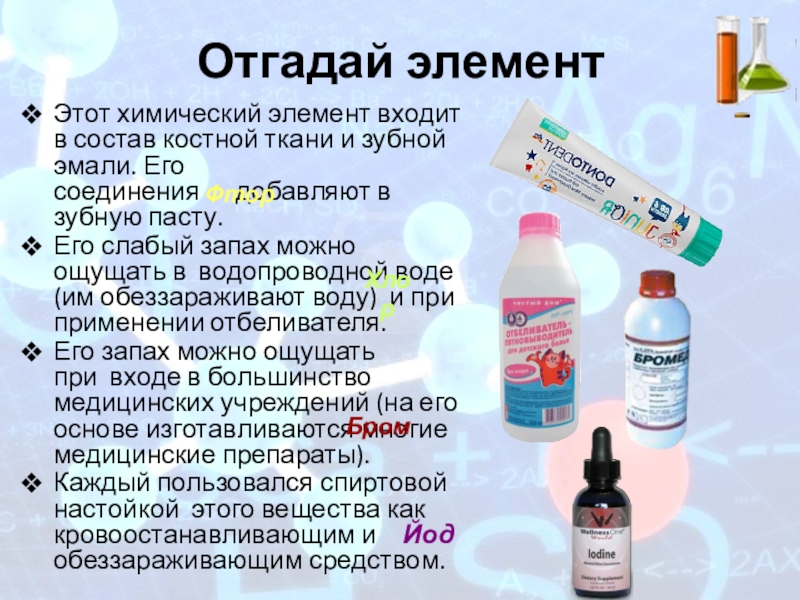
Слайд 2Отгадай элемент
Этот химический элемент входит в состав костной ткани и зубной
Его слабый запах можно ощущать в водопроводной воде (им обеззараживают воду) и при применении отбеливателя.
Его запах можно ощущать при входе в большинство медицинских учреждений (на его основе изготавливаются многие медицинские препараты).
Каждый пользовался спиртовой настойкой этого вещества как кровоостанавливающим и обеззараживающим средством.
Фтор
Хлор
Бром
Йод
Слайд 3
Na
+1
Cl
-1
+1
-1
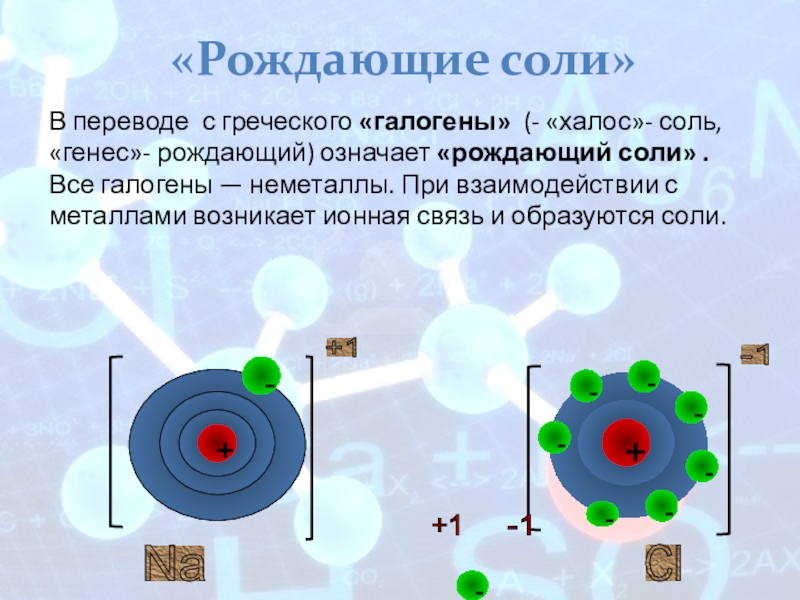
«Рождающие соли»
В переводе с греческого
Все галогены — неметаллы. При взаимодействии с металлами возникает ионная связь и образуются соли.
Слайд 5Цель урока
Дать общую характеристику галогенов на основе их строения, физических и
Слайд 6Задачи урока
Образовательные:
изучить строение, физические и химические свойства галогенов;
раскрыть взаимосвязь строения и
Развивающие:
развивать у учащихся умения выделять главное, существенное в изучаемом материале; сравнивать;
развивать самостоятельность учащихся, используя для этого проблемные ситуации.
Воспитательные:
содействовать в ходе урока формированию причинно-следственных и связей;
продолжить формирование научного мировоззрения;
формирование личностного смысла в изучении химии ( я должен знать свойства вещества, чтобы правильно к ним относиться, с должной аккуратностью и вниманием, чтобы не навредить ни себе, ни другим)
Слайд 7Строение атома
At – редко встречается в природе
F
2
7
1s²2s²2p
Cl
2
8
7
1s²2s²2p 3s²3p
Br
2
8
18
7
1s²2s²2p 3s²3p 3d 4s²4p
I
2
8
18
18
7
1s²2s²2p
Слайд 10Определите тип связи
Cl2
- ковалентная неполярная
Cl
Cl
+
Cl
Cl
F2
- ковалентная неполярная
Br2
I2
-
- ковалентная неполярная
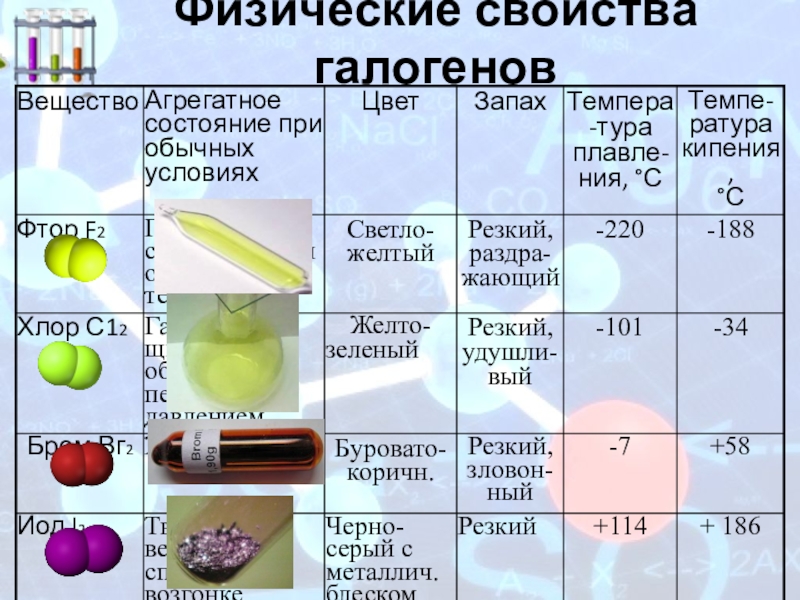
Слайд 11Физические свойства галогенов
Температуры плавления и кипения галогенов.
Длина связи в молекулах галогенов.
Слайд 12Общая характеристика галогенов
Все галогены имеют молекулярную кристаллическую решетку, ковалентную неполярную
На внешнем уровне 7 электронов
Увеличивается радиус атома
Неметаллические свойства ослабевают
Уменьшается окислительная способность
Самый сильный окислитель F2
(с. о. – 1)
Остальные галогены - -1, +1, +3, +5, +7
Слайд 13Химические свойства галогенов
2ē
2Ag + F2
2ē
Zn + F2 ZnF2
6ē
2Al + 3F2 2AlF3
С остальными металлами – при обычных условиях.
воспламеняются
Самый сильный окислитель F2
Слайд 14Химические свойства галогенов
Остальные галогены реагируют с металлами в основном при нагревании.
2Fe + 3Cl2 = 2FeCl3
6ē
Cu + Cl2 = CuCl2
2ē
2Аl + 3Cl2 = 2А = 2АlCl3
6ē
Слайд 15Ослабление окислительных свойств галогенов
Ослабление окислительных свойств галогенов от фтора к иоду
Н2 + Г2 = 2НГ
H2 + F2 = 2HF (в любых условиях со взрывом)
H2 + Cl2 = 2HCl (при поджигании или облучении прямым солнечным светом)
H2 + Br2 = 2HBr (при нагревании и без взрыва)
H2 + I2 = 2HI (протекает медленно даже при нагревании)
Слайд 16Более активные галогены вытесняют менее активные из растворов солей( это свидетельствует
Сl2 + 2NaBr(pp) = 2NaCl(p.p) + Br2
2ē
Вг2 + 2КI(р р) = 2КВг(р р) + I2
2ē
Для фтора эта реакция не характерна, так как она протекает в растворе, а фтор взаимодействует с водой, вытесняя из нее кислород:
2F2 + 2Н2OO = O = 4HF O = 4HF + O = 4HF + O2
2ē
Взаимодействие с растворами солей галогенов:
Слайд 17Получение
В лаборатории*
МnO2 + 4HCI = MnCI2 + CI2 + 2H2O
Mn+4 + 2e → Mn+2 окислитель
восстанавливается
(О.В.)
2CI-1 – 2e → CI20 восстановитель,
окисляется
(В.О.)
Слайд 18 В промышленности
Получают электролизом расплавов или растворов их солей.
2NaCl
Расплав
Слайд 19 Качественные реакции
на галогениды:
Для определения в растворе хлорид-, бромид-,
светло- желтый, желтый)
Для определения в растворе фторид - ионов используют реакцию с растворимыми солями кальция (выпадает белый осадок)
Слайд 20Критерии оценивания работы на уроке:
17-20 баллов- «5»
13-16 баллов- «4»
10-12 баллов –
Менее 10 баллов- «2».
Слайд 21Домашнее задание
Прочитать § 12, выполнить упр.2,4,5
Приготовить сообщения об истории
Выписать названия предметов и веществ, имеющихся у вас дома, в состав которых входят атомы галогенов.
Слайд 23Решите кроссворд
ы
н
н
о
в
о
л
з
х
л
о
р
и
д
ы
ь
м
е
с
ф
н
к
а
о
г
з
т
о
р
к
о
и
с
л
и
т
е
л
и
в
о
а
с
т
а
т
а
з
ы
г
1
2
3
4
5
6
7
8
1. Агрегатное состояние первых двух представителей галогенов при нормальных условиях.
2. Самый тяжелый галоген, полученный искусственно в 1940 г. с помощью ядерной реакции. Обнаружен в природе в 1943 году. По свойствам близок к йоду.
3. Наиболее характерное свойство галогенов – присоединение электрона, отдаваемого металлами. Поэтому о них говорят: «Галогены – сильные...»
4. Самый химически активный галоген. Впервые получен в 1886 году А.Муассаном (Франция).
5. Переход из твердого состояния непосредственно в пар, способный превращаться в твердое тело, минуя стадию жидкого состояния. Легко осуществляется для йода. Используется для очистки веществ.
6. Количество электронов на внешнем энергетическом уровне в атомах галогенов.
7. Значение слова «бром» в переводе с греческого языка на русский.
8. Название солей, которые получаются в результате взаимодействия хлора с металлами; соли хлороводородной кислоты.
й