2014 г.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Гидролиз
Содержание
- 1. Презентация к уроку Гидролиз
- 2. Цели урокаУчебные: сформировать основные понятия (гидролиз, классификация
- 3. Определить принадлежность солей к классам (по составу),
- 4. Проблема даны 3 пробирки Р-р фенолфталеина Р-р лакмуса
- 5. Среда растворанейтральная[OH-] = [H+]щелочная[OH-] > [H+]кислая[OH-] < [H+]лакмусметилоранжфенолфталеинИндикаторы
- 6. Понятие о водородном показателе ввел датский биохимик
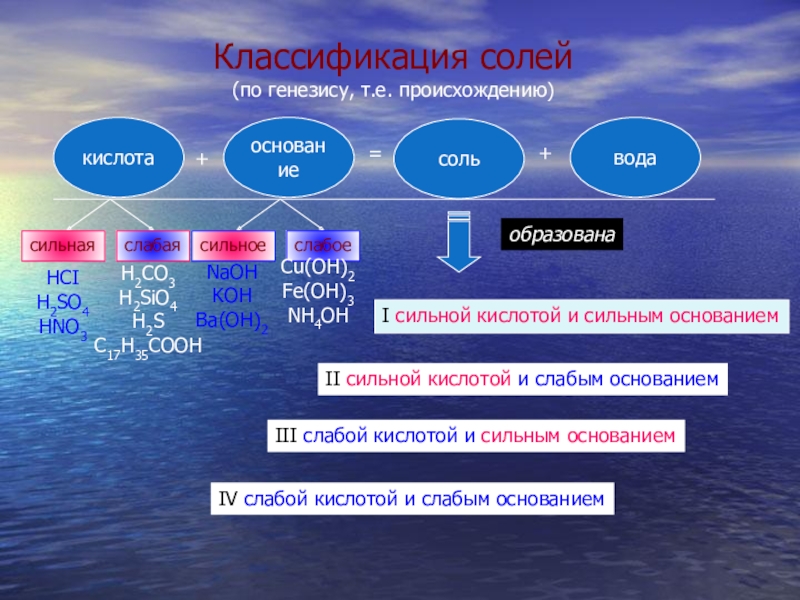
- 7. кислотаоснованиесольвода+=+сильнаяслабаясильноеслабоеHCIH2SO4HNO3H2CO3H2SiO4H2SC17H35COOHNaOHKOHBa(OH)2Сu(OH)2Fe(OH)3NH4OHI cильной кислотой и сильным основаниемII сильной
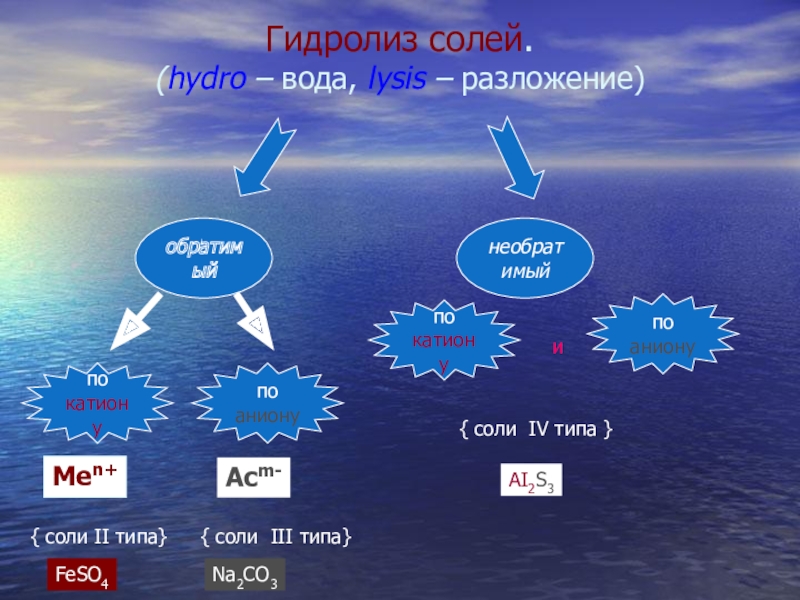
- 8. обратимыйнеобратимыйпокатионупоанионуМеn+{ соли II типа}Асm-{ соли III типа}покатионупоанионуи{
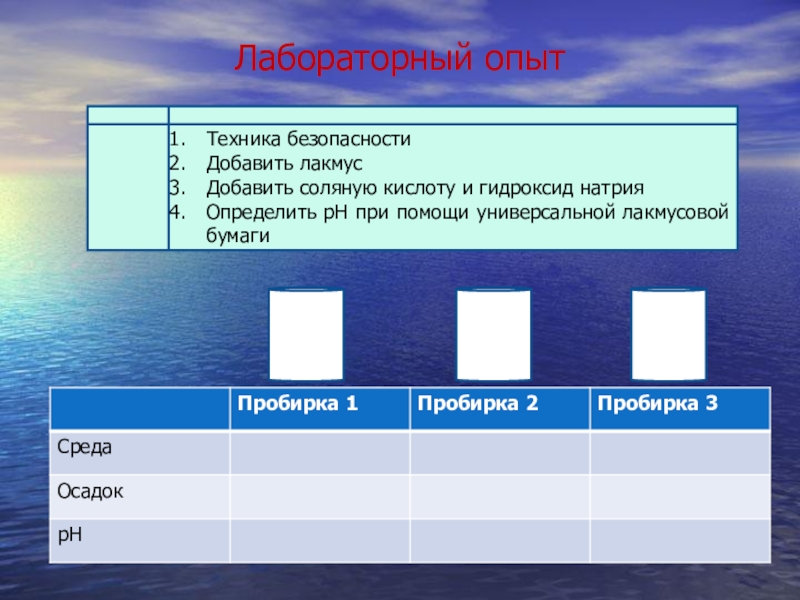
- 9. Лабораторный опыт Техника безопасностиДобавить лакмусДобавить соляную кислоту и гидроксид натрияОпределить рН при помощи универсальной лакмусовой бумаги
- 10. рН
- 11. Na2 CO32-NaOHсильноеоснованиеН2СО3слабаякислотаСО32-ион-инициатор 1. Сокращенное ионноеуравнениеCO32-
- 12. 2AICI3 + 3Na2CO3 = AI2
- 13. аг- степень гидролиза. Степень гидролиза показывает, какая
- 14. АНИОНЫ:F- > NO2 - >CH3COO- >HCO3- >HS-
- 15. Мылкость мыла и других моющих средств за
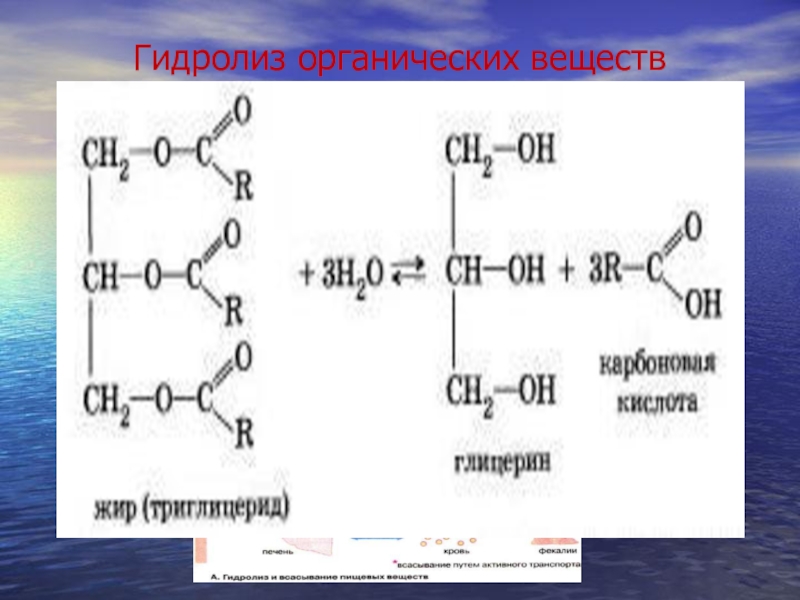
- 16. Гидролиз органических веществ
- 17. Гидролиз солей - Какую реакцию среды будут
- 18. Онлайн - тестирование (3 задания)http://school-collection.edu.ru/catalog/res/4a24c220-459f-834d-b554 dae8d0e6e131/view/ http://school-collection.edu.ru/catalog/res/a806e911-f330-1f06-2c50-d04ec2b2e82b/view/http://school-collection.edu.ru/catalog/res/f4e8b9a0-736a-d217-6b6f-7f06d4074a06/view/
- 19. I вариантА) кислая, рН7, по анионуII вариантА)
- 20. ЛИТЕРАТУРА Габриелян О. С. Химия. 11 кл.
- 21. Спасибо за внимание!
Слайд 1Гидролиз веществ
Урок по химии для 11 класса.
МБОУ «СОШ № 16»
Учитель
Слайд 2Цели урока
Учебные: сформировать основные понятия (гидролиз, классификация солей по силе кислоты
Развивающие: развивать творческое мышление, экспериментальные умения и навыки, развивать умения выдвигать гипотезы, проверять их, устанавливать закономерности, искать факты, которые подтвердили бы правильность выдвинутой гипотезы, развивать эмоциональную сферу учащихся, познавательную активность, умений наблюдать окружающий мир, сформировать понимание значения гидролиза в природе и жизни человека.
Воспитательные: формирование умений применять изученный материал в практических ситуациях, защищать свои убеждения, работать в группе.
Слайд 3Определить принадлежность солей к классам (по составу), дополнить схему классификации, назвать
NaNO3, NaHCO3, (CuOH)2SO4, [Ag(NH3)2]NO3, KAI(SO4)2, CaOCI2
Соли
средние
кислые
основные
двойные
смешанные
комплексные
Слайд 5Среда раствора
нейтральная
[OH-] = [H+]
щелочная
[OH-] > [H+]
кислая
[OH-] < [H+]
лакмус
метилоранж
фенолфталеин
Индикаторы
Слайд 6Понятие о водородном показателе ввел датский биохимик С.П.Серенсен (1868-1939),
разрабатывавший в это
пива.
рН = - lg[H+]
pH
[H+]
[H+]↔[OH-]
нейтральная
кислая
щелочная
[H+]=[OH-]
[H+]>[OH-]
[H+]<[OH-]
[H+]=10-7
моль/л
[H+]<10-7
моль/л
[H+]>10-7
моль/л
7
<7
>7
Водородный показатель рН
Слайд 7кислота
основание
соль
вода
+
=
+
сильная
слабая
сильное
слабое
HCI
H2SO4
HNO3
H2CO3
H2SiO4
H2S
C17H35COOH
NaOH
KOH
Ba(OH)2
Сu(OH)2
Fe(OH)3
NH4OH
I cильной кислотой и сильным основанием
II сильной кислотой и слабым основанием
III
IV cлабой кислотой и слабым основанием
образована
Классификация солей
(по генезису, т.е. происхождению)
Слайд 8
обратимый
необратимый
по
катиону
по
аниону
Меn+
{ соли II типа}
Асm-
{ соли III типа}
по
катиону
по
аниону
и
{ соли IV типа }
FeSO4
Na2CO3
AI2S3
Гидролиз
Слайд 9Лабораторный опыт
Техника безопасности
Добавить лакмус
Добавить соляную кислоту и гидроксид натрия
Определить рН при
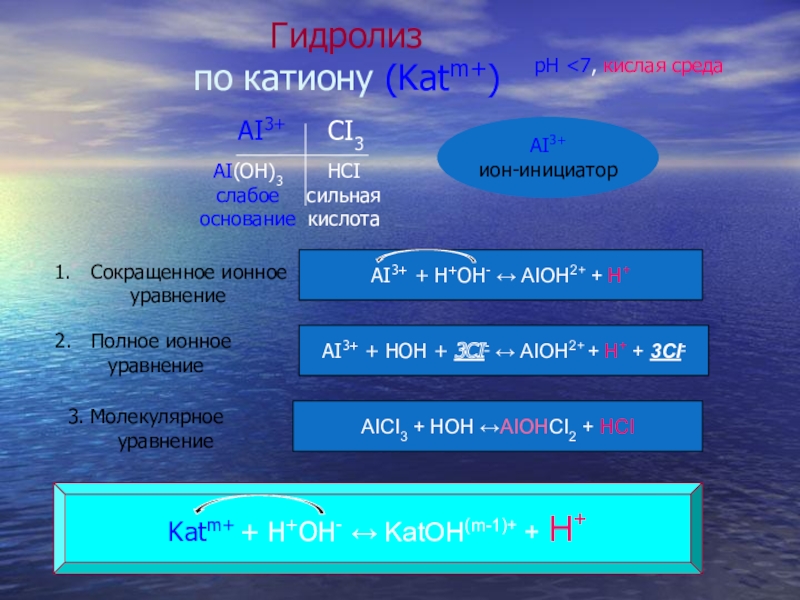
Слайд 10рН
AI3+ + H+OH- ↔ AIOH2+ + H+
Полное ионное
уравнение
AI3+ + HOH + 3CI- ↔ AIOH2+ + H+ + 3CI-
3. Молекулярное
уравнение
AICI3 + HOH ↔AIOHCI2 + HCI
Katm+ + H+OH- ↔ KatOH(m-1)+ + H+
Гидролиз
по катиону (Katm+)
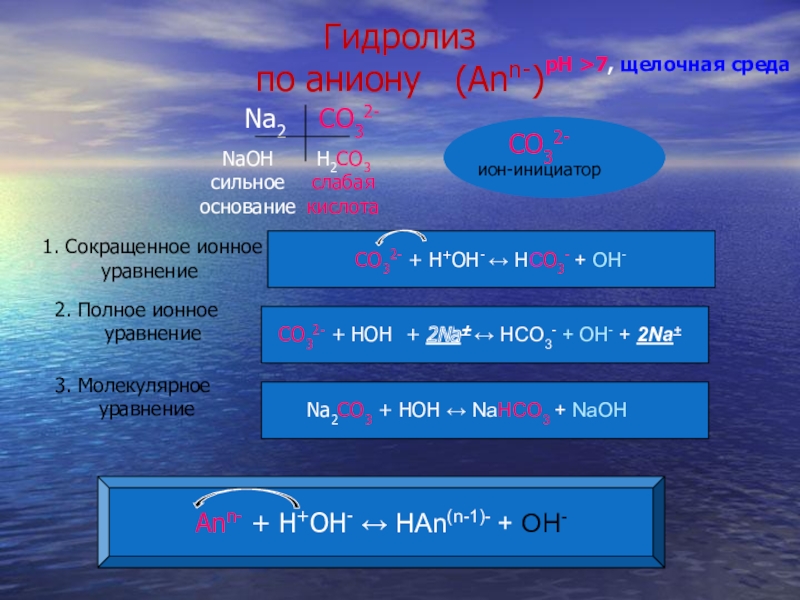
Слайд 11Na2 CO32-
NaOH
сильное
основание
Н2СО3
слабая
кислота
СО32-
ион-инициатор
1. Сокращенное ионное
уравнение
CO32- + H+OH- ↔ HСO3-
2. Полное ионное
уравнение
CO32- + HOH + 2Na+ ↔ HCO3- + OH- + 2Na+
3. Молекулярное
уравнение
Na2CO3 + HOH ↔ NaHCO3 + NaOH
pH >7, щелочная среда
Ann- + H+OH- ↔ HAn(n-1)- + OH-
Гидролиз
по аниону (Ann-)
Слайд 122AICI3 + 3Na2CO3 = AI2 (CO3)3 + 6NaCI
AI(OH)3↓
слабое
основание
H2CO3
слабая
кислота
H2O
CO2↑
В
Ы
В
О
Д
ы
1.
2. «Слабый» ион является инициатором процесса гидролиза.
3. Гидролиз «по катиону» и «по аниону» - обратимый процесс.
Гидролиз
по катиону и аниону (полный гидролиз
Слайд 13
аг- степень гидролиза. Степень гидролиза показывает, какая часть от общего
аг = n/N * 100%
n – число гиролизованных
молекул
N – общее число молекул
соли в данном растворе
Зависит от :
1.Температуры
2.Концентрации раствора
3.Природы растворенного вещества
Степень гидролиза по
зависит от степени
диссоциации продуктов
гидролиза
чем СЛАБЕЕ основание или кислота,
тем ВЫШЕ степень гидролиза
Степень гидролиза
Слайд 14
АНИОНЫ:
F- > NO2 - >CH3COO- >HCO3- >HS- > SO32- >HPO42- >CO32-
КАТИОНЫ
Cd2+>Mg2+>Mn2+ >Fe2+>Co2+>Ni2+>NH4+>Cu2+>Pb2+>Zn2+>Al3+>Cr3+>Fe2+
Расположены в порядке уменьшения силы кислоты и оснований им
сооответствующим
Если соль образована слабой кислотой и слабым основанием , то среда раствора
определяется тем ионом соли, у которого степень гидролиза выше
СuF2 - слабокислая среда
NH4F – cлабокислая среда
CH3COONH4 – нейтральная среда
NH4CN – слабощелочная среда
NaHCO3 –щелочная среда
NaHSO3 – кислая среда
Степень гидролиза
Слайд 15
Мылкость мыла и других моющих средств за счет щелочной
среды: С17Н35СООNa +
Фотографический проявитель имеет щелочную среду
за счет гидролиза Na2CO3, Na4B2O7
Минеральные воды (Майкопская) («источник нартов», «вода героев») –имеет щелочную среду (гидрокарбонатно-натриевая)
Удобрение (NH4)2SO4 используют также для повышения
кислотности щелочных почв
Гидроортофосфат натрия Nа2НРО4 обеспечивает гомеостаз
(постоянство среды) крови и слюны.
Значение гидролиза
Слайд 17Гидролиз солей
- Какую реакцию среды будут
иметь растворы следующих солей:
I
А) нитрат цинка
Б) хлорид калия
В) карбонат железа(II)
Г) сульфид натрия
II вариант
А) силикат натрия
Б) нитрат бария
В) ацетат меди (II)
Г) сульфат железа (II)
- Определите тип гидролиза
Составьте уравнения реакций
для солей А).
Слайд 18Онлайн - тестирование (3 задания)
http://school-collection.edu.ru/catalog/res/4a24c220-459f-834d-b554 dae8d0e6e131/view/
http://school-collection.edu.ru/catalog/res/a806e911-f330-1f06-2c50-d04ec2b2e82b/view/
http://school-collection.edu.ru/catalog/res/f4e8b9a0-736a-d217-6b6f-7f06d4074a06/view/
Слайд 19
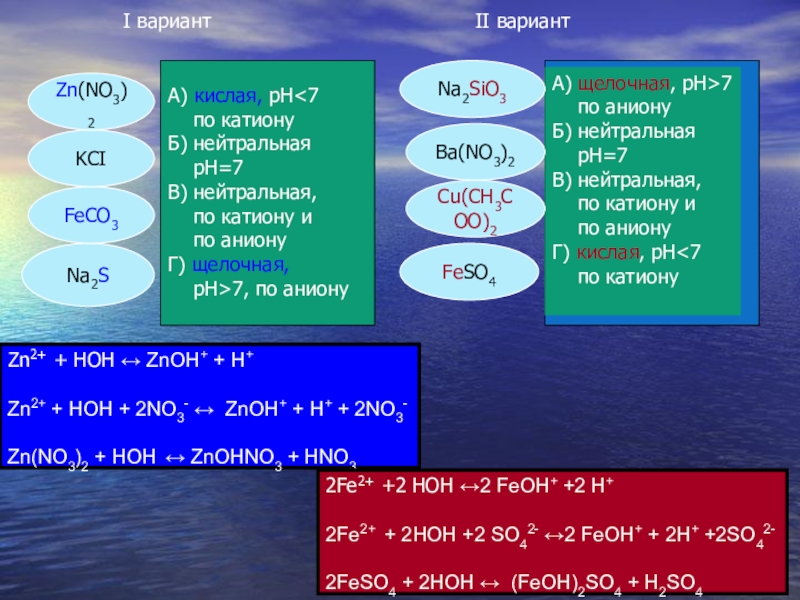
I вариант
А) кислая, рН
по аниону
Г) щелочная,
рН>7, по аниону
II вариант
А) щелочная, рН>7
по аниону
Б) нейтральная
рН=7
В) нейтральная,
по катиону и
по аниону
Г) кислая, рН<7
по катиону
Na2SiO3
Ba(NO3)2
FeSO4
Cu(CH3COO)2
Na2S
FeCO3
KCI
Zn(NO3)2
Zn2+ + HOH ↔ ZnOH+ + H+
Zn2+ + HOH + 2NO3- ↔ ZnOH+ + H+ + 2NO3-
Zn(NO3)2 + HOH ↔ ZnOHNO3 + HNO3
2Fe2+ +2 HOH ↔2 FeOH+ +2 H+
2Fe2+ + 2HOH +2 SO42- ↔2 FeOH+ + 2H+ +2SO42-
2FeSO4 + 2HOH ↔ (FeOH)2SO4 + H2SO4
Слайд 20ЛИТЕРАТУРА
Габриелян О. С. Химия. 11 кл. Базовый уровень: Методическое пособие.- М.:
А.А. Каверина, Д. Ю. Добротин, А.С. Корощенко, Ю.Н. Медведев. Учебно-тренировочные материалы для подготовки к ЕГЭ. Химия. М. Интеллект – центр. 2004.
http://school-collection.edu.ru Единая коллекция цифровых образовательных ресурсов.
http://window.edu.ru/ Единое окно доступа к образовательным ресурсам
http://www.school.edu.ru/default.asp Российский общеобразовательный портал


![Презентация к уроку Гидролиз Определить принадлежность солей к классам (по составу), дополнить схему классификации, назвать Определить принадлежность солей к классам (по составу), дополнить схему классификации, назвать соли. NaNO3, NaHCO3, (CuOH)2SO4, [Ag(NH3)2]NO3,](/img/thumbs/f0341de597884953d3af1dee9f59668e-800x.jpg)

![Презентация к уроку Гидролиз Среда растворанейтральная[OH-] = [H+]щелочная[OH-] > [H+]кислая[OH-] < [H+]лакмусметилоранжфенолфталеинИндикаторы Среда растворанейтральная[OH-] = [H+]щелочная[OH-] > [H+]кислая[OH-] < [H+]лакмусметилоранжфенолфталеинИндикаторы](/img/thumbs/03c133efdf4bff299ae295f02969bd6a-800x.jpg)