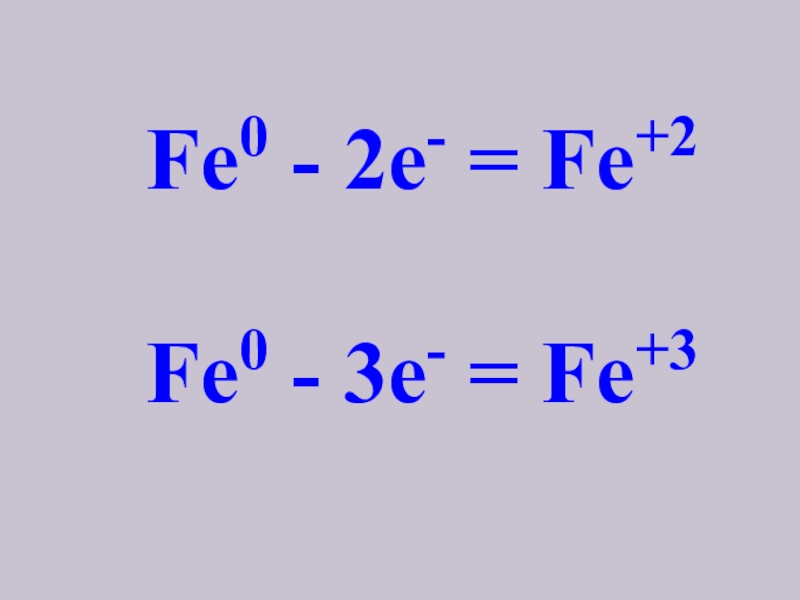- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к открытому уроку по химии в 9 классе Железо.
Содержание
- 1. Презентация к открытому уроку по химии в 9 классе Железо.
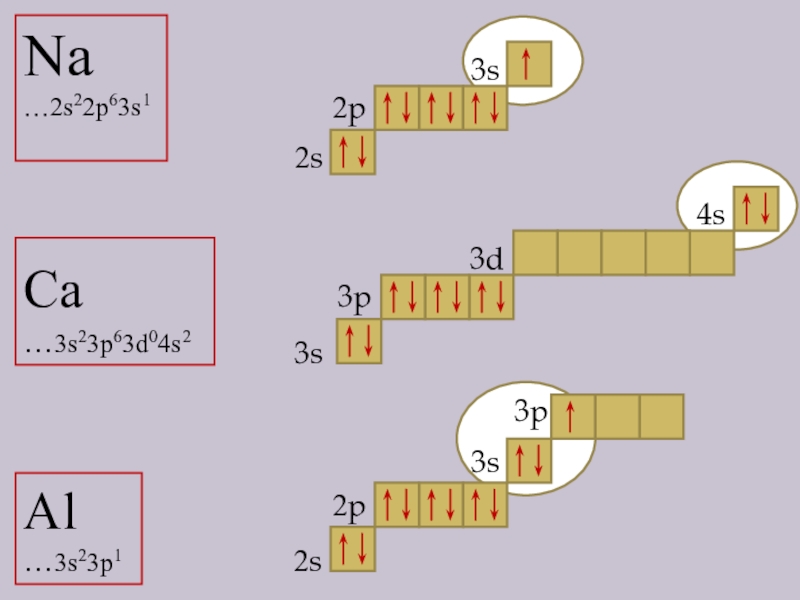
- 2. Na …2s22p63s1 Ca …3s23p63d04s2Al …3s23p12s3s2p3s3p2p3d4s2s3p3s
- 3. Значение железа
- 4. Тема урока:Железо Цель -изучить свойства элементов побочных
- 5. Fe 1s22s22p63s23p63d64s2Ca 1s22s22p63s23p63d04s2
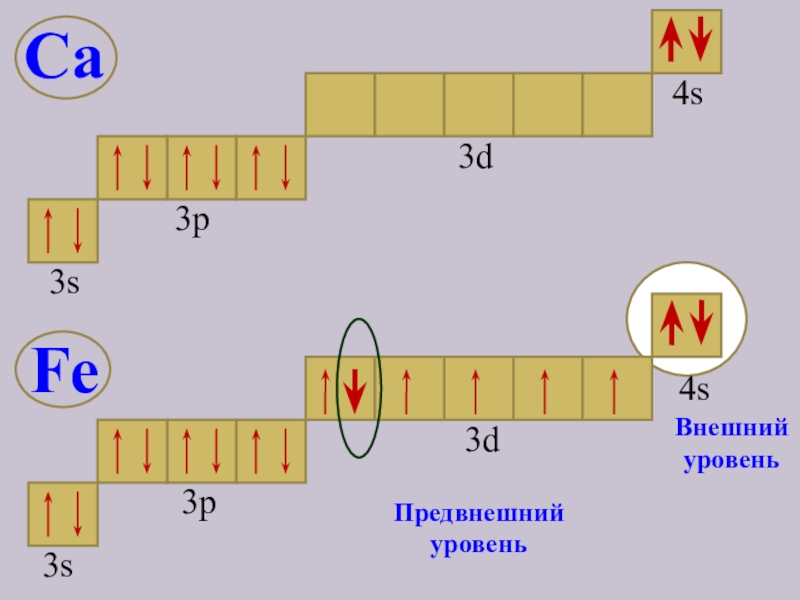
- 6. 3s3p4s3dПредвнешний уровеньВнешний уровеньFe Ca4s3d3р3s
- 7. Fe0 - 2e- = Fe+2Fe0 - 3e- = Fe+3
- 8. Выводы: В атоме железа электронами заполняется предвнешний
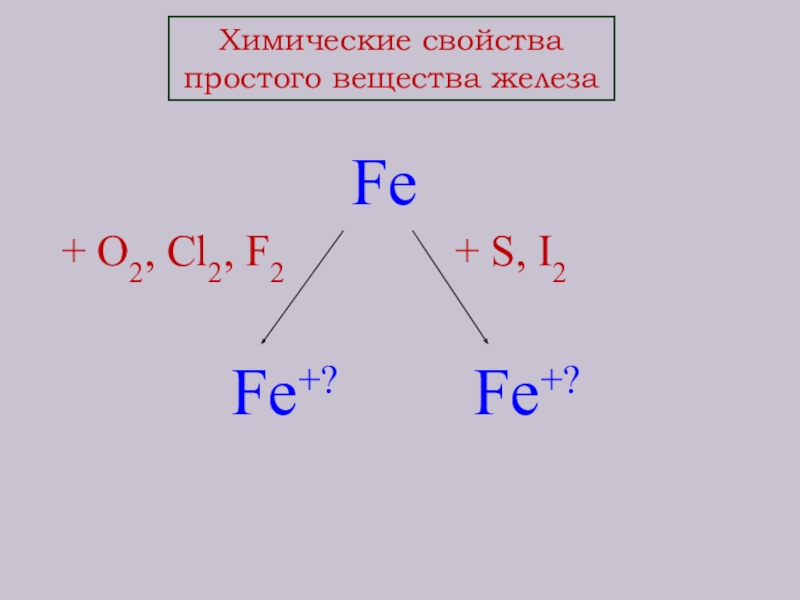
- 9. Химические свойства простого вещества железа Fe+ O2,
- 10. Химические свойства простого вещества железа Fe+ O2,
- 11. 2Na + 2Н2О = 2NaOH + H2↑Сa
Слайд 4Тема урока:
Железо
Цель
-изучить свойства элементов
побочных подгрупп Периодической системы химических
Д. И. Менделеева на примере железа.
Слайд 8Выводы:
В атоме железа электронами заполняется
предвнешний энергетический уровень;
2. Валентными являются
и, частично, предвнешнего энергетических
уровней;
3. Атомы железа проявляют переменную
степень окисления (+2 и + 3).
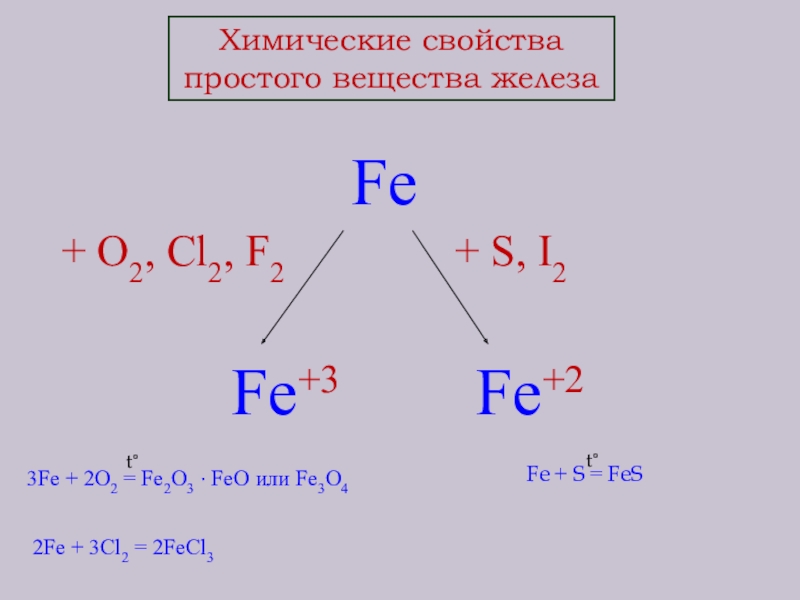
Слайд 10Химические свойства
простого вещества железа
Fe
+ O2, Cl2, F2
Fe+3 Fe+2
3Fe + 2O2 = Fe2O3 · FeO или Fe3O4
2Fe + 3Cl2 = 2FeCl3
t°
Fe + S = FeS
t°
Слайд 112Na + 2Н2О = 2NaOH + H2↑
Сa + 2Н2О = Са(OH)2
2Al + 6Н2О = 2Al(OH)3 ↓ + H2↑
3Fe + 4Н2О = Fe3O4 + 4H2↑
Cравнение продуктов реакции:
малорастворимое
основание
нерастворимое
основание
растворимое
основание (щелочь)
Реагирует энергично.
Выделяется большое
количество теплоты
Протекает
значительно медленнее.
Выделяется большое
количество теплоты