- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Открытый урок по химии с презентацией на тему Уравнения химических реакций (8 класс)
Содержание
- 1. Открытый урок по химии с презентацией на тему Уравнения химических реакций (8 класс)
- 2. Определи,
- 3. Превращение льда в воду
- 4. «…Люблю я пышное
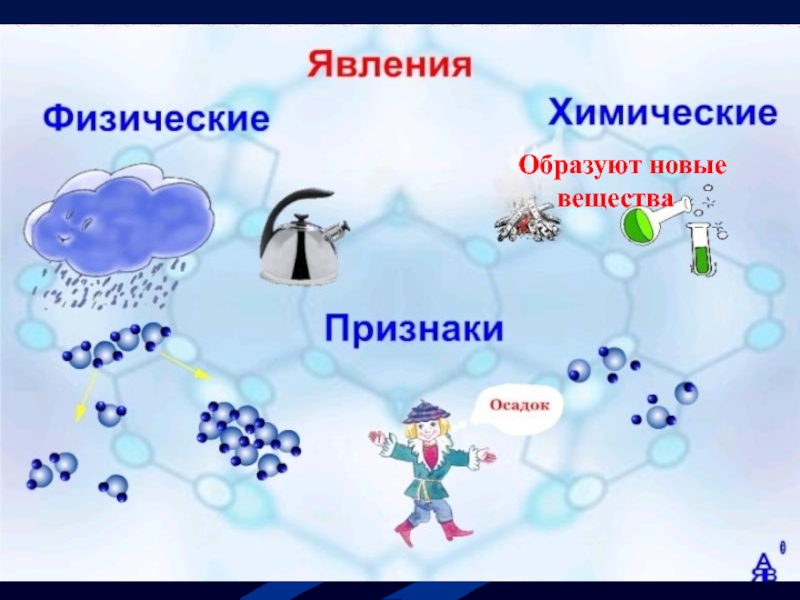
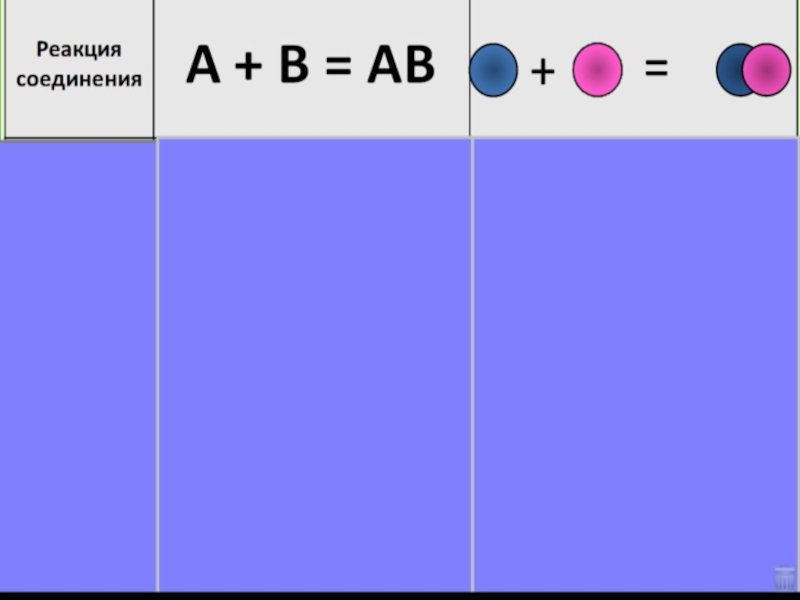
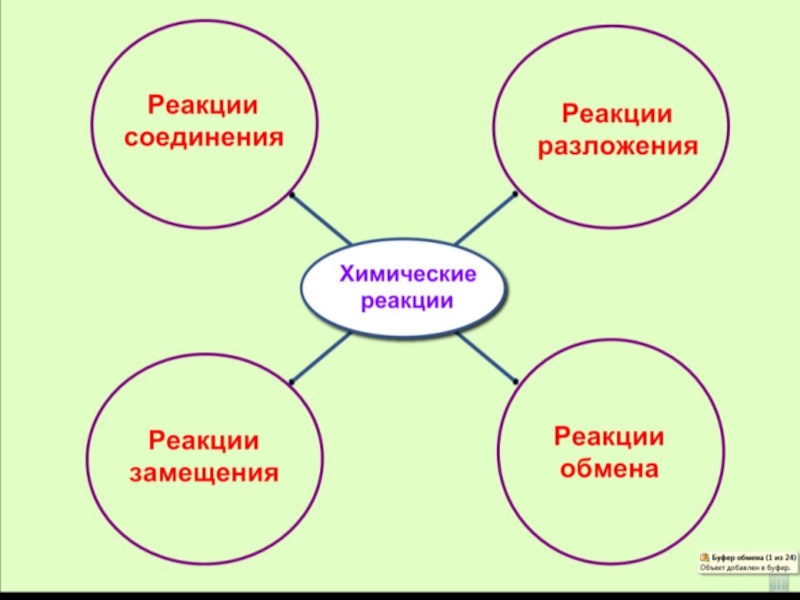
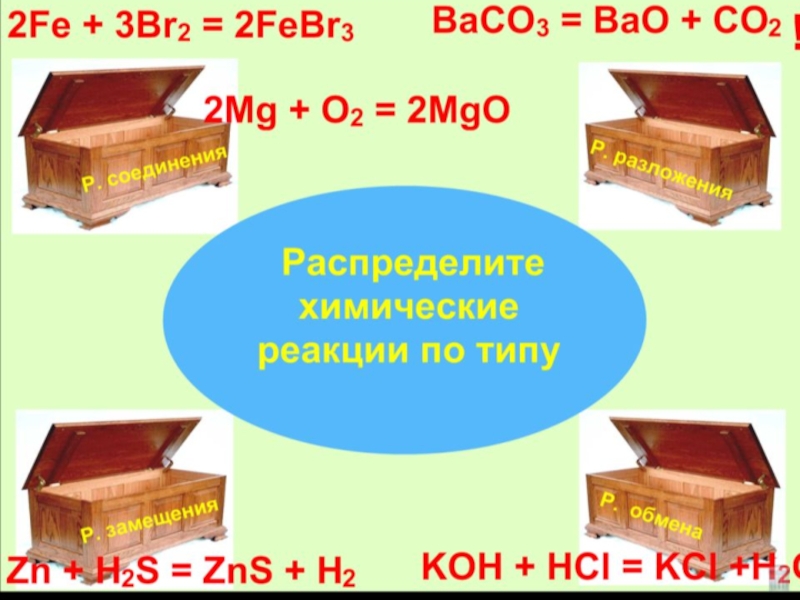
- 5. Образуют новые вещества
- 6. Задание №1 Тесты
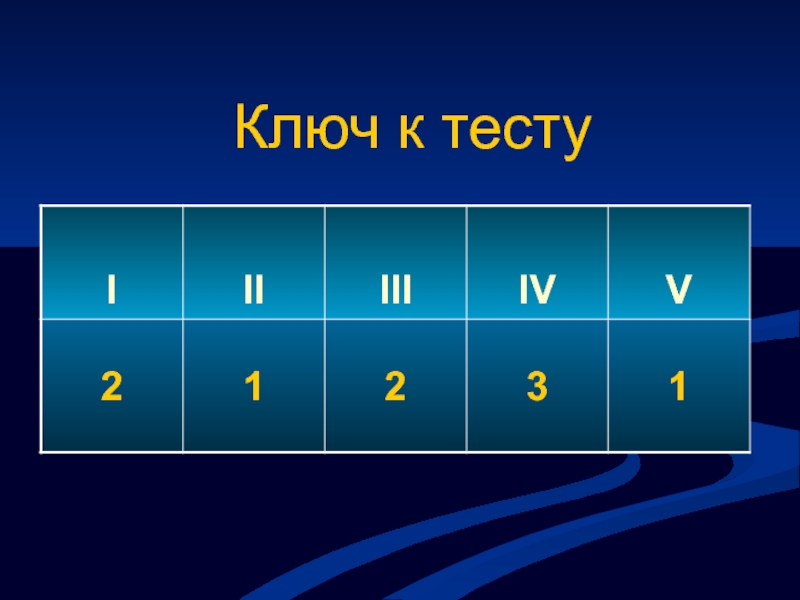
- 7. Ключ к тесту
- 8. Оценочный лист
- 9. Физкультминутка
- 10. А теперь все дружно встали,
- 11. Тема урока: « .?. »
- 12. Тема : «Составление уравнений химических реакций»
- 13. Фонетическая зарядка
- 14. Слайд 14
- 15. Задание Составить химическое уравнение реакции между
- 16. Закончить фразы: 1).Химическое уравнение представляет собой
- 17. Слайд 17
- 18. При составлении
- 19. Задание №2
- 20. Опыт №1 ·Прокалить медный провод на
- 21. Опыт №2 ·Провести реакцию магния
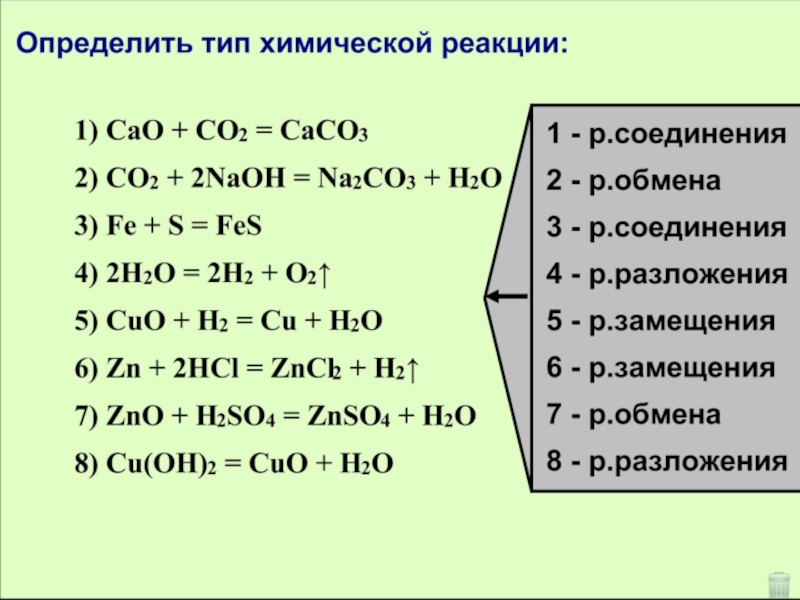
- 22. Задание №3
- 23. Ключ к заданию №2
- 24. Ключ к заданию №3 1). 2Сa+
- 25. Оценочный лист
- 26. Оценка за урокЕсли вы набрали:
- 27. Домашнее задание§19, упр. 3-4 – для тех,
- 28. Минута
- 29. Слайд 29
- 30. Как уравнивать левую и правую части уравнения?
- 31. Правила определения коэффициентов: Считаем число атомов
- 32. Слева кислорода -2, а справа- 3
- 33. 4Al+3O2 = 2Al2O3 Уравнение составлено верно, с учётом …
- 34. Расставить самостоятельно коэффициенты в уравнениях:
- 35. Проверяй: 1). 2Сa+ O2 = 2
- 36. Оценка за урокЕсли вы набрали: 7 -
- 37. Домашнее задание§19, упр. 3-4 – для тех,
- 38. Таблица настроенияМне было на уроке интересно, я
- 39. В ходе реакции число атомов исходных веществ
- 40. Проблема Почему в реакциях массы исходных веществ и продуктов реакции равны?
- 41. Слайд 41
- 42. Слайд 42
- 43. Слайд 43
- 44. Слайд 44
- 45. Слайд 45
- 46. Слайд 46
- 47. Слайд 47
- 48. Слайд 48
- 49. Слайд 49
- 50. Слайд 50
- 51. Слайд 51
- 52. Слайд 52
Определи, о каких явлениях природы идёт речь?
Слайд 9 Физкультминутка
На двери висит замок.
Кто его открыть бы мог?
Повертели, покрутили,
Постучали и открыли…
Слайд 10 А теперь все дружно встали, Быстро руки вверх подняли,
В стороны, вперёд, назад – 2
Повернулись вправо, влево-2
Сделали глубокий вдох.
А теперь спокойно сели,
Продолжается урок.
Слайд 15Задание Составить химическое уравнение реакции между веществами: Калий + хлор
→ хлорид
(газ) калия
Слайд 16Закончить фразы: 1).Химическое уравнение представляет собой … 2).В левой части уравнения пишут
…, а в правой - …
3).Коэффициенты в уравнении
рассчитывают на основании…
Слайд 17
Михаил Васильевич Ломоносов
в 1748
году открыл закон
Сохранения Массы веществ
Масса Масса
исходных веществ = продукта реакции
веществ
S + O2 = SO2 Число атомов элементов слева и справа равно.
Масса Масса
исходных веществ = продукта реакции
веществ
S + O2 = SO2 Число атомов элементов слева и справа равно.
Слайд 18При составлении
уравнений следует
ставить нужные коэффициенты
перед формулами веществ
( уравнивать левую и правую части уравнения)
Слайд 20Опыт №1 ·Прокалить медный провод на пламени спиртовки. ·Что будем
делать?
·Что наблюдали? Вывод. ·Составить уравнение реакции
Слайд 21 Опыт №2 ·Провести реакцию магния с соляной кислотой. Определить вид
выделенного газа
·Что будем делать?
·Что наблюдали? Вывод.
·Составить уравнение реакции.
Слайд 22 Задание №3
Поставить коэффициенты в уравнениях реакций:
1). Сa+ O2 → CaO
2). Zn + HCl → ZnCl2 + H2
3). Na + S → Na2S
Слайд 26Оценка за урок
Если вы набрали:
14 – 15 баллов
– оценка «5»
12 – 13 баллов – оценка «4»
10 – 11 баллов – оценка «3»
меньше 10 баллов – повтори тему и разбери те задания, которые вызвали затруднения.
12 – 13 баллов – оценка «4»
10 – 11 баллов – оценка «3»
меньше 10 баллов – повтори тему и разбери те задания, которые вызвали затруднения.
Слайд 27Домашнее задание
§19, упр. 3-4 – для тех, кто получил
оценку «3»
§19, упр.6– для тех, кто получил
оценку «4»
§19, упр. 7 – для тех, кто получил
оценку «5»
§19, упр.6– для тех, кто получил
оценку «4»
§19, упр. 7 – для тех, кто получил
оценку «5»
Слайд 28 Минута настроения
Мне было интересно
на уроке, я всё понял(а) и много узнал(а) нового.
На уроке я понял(а) не всё .
Мне на уроке было скучно, я не понял(а) ничего.
На уроке я понял(а) не всё .
Мне на уроке было скучно, я не понял(а) ничего.
F
F
F
Слайд 31
Правила определения коэффициентов:
Считаем число атомов каждого элемента в уравнении слева и
справа.
Определяем , у какого элемента число атомов меняется больше и находим НОК.
Делим НОК на индексы – получаем коэффициенты и ставим их перед формулами веществ.
Проверяем число атомов слева и справа в уравнении (их должно быть поровну)
Коэффициент «1»не ставим!
Определяем , у какого элемента число атомов меняется больше и находим НОК.
Делим НОК на индексы – получаем коэффициенты и ставим их перед формулами веществ.
Проверяем число атомов слева и справа в уравнении (их должно быть поровну)
Коэффициент «1»не ставим!
Слайд 32 Слева кислорода -2, а справа- 3 Определяем НОК 2 и 3
= 6
Узнаём коэффициент слева
6 : 2 =3
Узнаём коэффициент справа
6 : 3 =2
Уравниваем атомы алюминия
2 · 2 = 4
Слайд 34 Расставить самостоятельно коэффициенты в уравнениях: 1). Сa+ O2 →
CaO
2). Zn + HCl → ZnCl2 + H2
3). Fe + O2 → Fe2O3
Слайд 36Оценка за урок
Если вы набрали:
7 - 8 баллов
– оценка«5»
5 – 6 баллов – оценка«4»
3-4 балла – оценка«3»
меньше 3 баллов - повторите данную тему и разберите задания, которые вызвали у вас затруднения.
3-4
5 – 6 баллов – оценка«4»
3-4 балла – оценка«3»
меньше 3 баллов - повторите данную тему и разберите задания, которые вызвали у вас затруднения.
3-4
Слайд 37Домашнее задание
§19, упр. 3-4 – для тех, кто получил
оценку «3»
§19, упр.6– для тех, кто получил
оценку «4»
§19, упр. 7 – для тех, кто получил
оценку «5»
§19, упр.6– для тех, кто получил
оценку «4»
§19, упр. 7 – для тех, кто получил
оценку «5»
Слайд 38Таблица настроения
Мне было на уроке интересно, я много узнал(а) нового и
всё понял(а).
На уроке я понял(а) не всё.
Мне на уроке было скучно, я ничего не понял.
На уроке я понял(а) не всё.
Мне на уроке было скучно, я ничего не понял.
F
F
F
Слайд 39В ходе реакции число атомов исходных веществ сохраняется, но
происходит их перестановка
(образование новых веществ)