- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Окислительно-восстановительные реакции
Содержание
- 1. Окислительно-восстановительные реакции
- 2. Al2(SO3)3 - найдите степень окисления серы? Расставляем
- 3. 1.Степень окисления любого элемента в простом веществе
- 4. 5.Для простых ионов их заряд совпадает
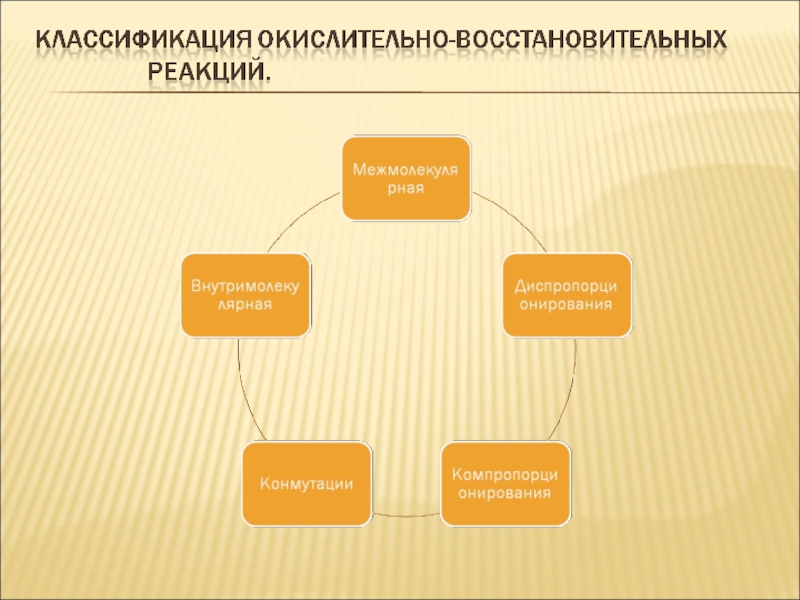
- 5. Схема присоединения или отдачи электронов
- 6. Группа окислителей
- 7. Группа восстановителей
- 8. Любая окислительно–восстановительная реакция протекает в сторону образования
- 9. Составить схему реакции.
- 10. Определить восстановитель и окислитель.
- 11. Слайд 11
- 12. Окислительно-восстановительные реакции зависят:От водородного показателя:
- 13. Окислительно-восстановительные реакции в органической химии связано
- 14. Пример 1: C2H5OH + KMnO4 + H2SO4
- 15. Пример 2: СН2=СН2 + KМnO4 + Н2О
- 16. 1. K2Cr2O7 + KNO2 + …….= KNO3
Al2(SO3)3 - найдите степень окисления серы? Расставляем нам известные степени окисления. Неизвестную с.о. обозначим за Х. +3 х -2
Слайд 1
Работу выполнил: учитель химии
МОУ «Красногвардейской средней
общеобразовательной школы №1»
Уткин Е. А.
Слайд 2Al2(SO3)3 - найдите степень окисления серы?
Расставляем нам известные степени окисления.
Неизвестную с.о. обозначим за Х. +3 х -2
Al2(SO3)3
Мы знаем, что сумма с.о. в простом веществе =0. Получаем уравнение с одной неизвестной. +3•2+(х+(-2) •3) •3=0 х=+4
Al2(SO3)3
Мы знаем, что сумма с.о. в простом веществе =0. Получаем уравнение с одной неизвестной. +3•2+(х+(-2) •3) •3=0 х=+4
Слайд 31.Степень окисления любого элемента в простом веществе равна 0.
2.Сумма степеней
окисления всех атомов, входящих в состав частицы (молекул, ионов и т. Д. ) равна заряду этой частицы. В частности, сумма степеней окисления всех атомов в составе нейтральной молекулы равна 0. (К2МnО4 – определите степень окисления марганца. (+1)• 2 + Х + (-2)• 4 = 0 Х=+6, NH4+ – определите степень окисления азота. Х+(+1) • 4 = +1 Х=-3
3.Если соединение образовано двумя элементами, то у элемента с большей электроотрицательностью степень окисления меньше нуля, а у элемента с меньшей электроотрицательностью – больше нуля. (Ca+2,N-3, C+4, S-2, I+1, Cl-1 ).
4.Максимальная положительная степень окисления любого элемента равна номеру группы в периодической системе элементов, а минимальная отрицательная равна N – 8, где N – номер группы.
3.Если соединение образовано двумя элементами, то у элемента с большей электроотрицательностью степень окисления меньше нуля, а у элемента с меньшей электроотрицательностью – больше нуля. (Ca+2,N-3, C+4, S-2, I+1, Cl-1 ).
4.Максимальная положительная степень окисления любого элемента равна номеру группы в периодической системе элементов, а минимальная отрицательная равна N – 8, где N – номер группы.
Слайд 4 5.Для простых ионов их заряд совпадает со степенью окисления атома
Al2(SO4)3 - заряд иона алюминия+3, степень окисления
6.Степень окисления фтора в соединениях равна-1. 7.Степень окисления щелочных металлов (лития, натрия, калия, рубидия, цезия) равна +1, металлов главной подгруппы II группы периодической системы (магния, кальция, стронция, бария) равна +2, степень окисления алюминия равна +3.
8.Степень окисления водорода в соединениях равна +1(исключение – соединения с металлами NaH, CaH2, в этих соединениях степень окисления у водорода равна -1).
9.Степень окисления кислорода равна –2 (исключения – перекиси H2O2, Na2O2, BaO2 в них степень окисления водорода равна -1, а в соединении с фтором - +2).
6.Степень окисления фтора в соединениях равна-1. 7.Степень окисления щелочных металлов (лития, натрия, калия, рубидия, цезия) равна +1, металлов главной подгруппы II группы периодической системы (магния, кальция, стронция, бария) равна +2, степень окисления алюминия равна +3.
8.Степень окисления водорода в соединениях равна +1(исключение – соединения с металлами NaH, CaH2, в этих соединениях степень окисления у водорода равна -1).
9.Степень окисления кислорода равна –2 (исключения – перекиси H2O2, Na2O2, BaO2 в них степень окисления водорода равна -1, а в соединении с фтором - +2).
Слайд 5Схема присоединения или отдачи электронов
Отдача электронов, окисление, -ne
Присоединение электронов, восстановление, +nе
Х
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7
Слайд 6Группа окислителей
Химические элементы Примеры веществ
Электрический ток на аноде - -
Галогены в высших положительных + 7 +7 +7
степенях окисления CI, Br, I НClO4, HBr04,HJO4
Галогены в промежуточных + 1 +3 +5 +5 +5
положительных степенях окисления CI, CI, Cl, Br, I. КClO3, HClO, NaBr03
Халькогены и другие неметаллы в +6 + 4 +5
положительных степенях окисления S, S, N H2S04, S02, HN03
Неметаллы – простые вещества 0 0 0 0 0
(нулевая степень окисления) F, С, О, S, Вг F2, Cl2, 03, 02, S, Br2
Неметаллы в промежуточных -1 -2
отрицательных степенях окисления O, N H202, Ba02, N2H4
Металлы в высших положительных + 7 +6 +4
степенях окисления Mn, Cr, Sn KMn04, K2Cr04, H2Cr207, SnCl4
Металлы в промежуточных + 2 +1 +2
положительных степенях окисления Fe, Cu, Sn FeCl2, Cu2Cl2, SnS04
Электрический ток на аноде - -
Галогены в высших положительных + 7 +7 +7
степенях окисления CI, Br, I НClO4, HBr04,HJO4
Галогены в промежуточных + 1 +3 +5 +5 +5
положительных степенях окисления CI, CI, Cl, Br, I. КClO3, HClO, NaBr03
Халькогены и другие неметаллы в +6 + 4 +5
положительных степенях окисления S, S, N H2S04, S02, HN03
Неметаллы – простые вещества 0 0 0 0 0
(нулевая степень окисления) F, С, О, S, Вг F2, Cl2, 03, 02, S, Br2
Неметаллы в промежуточных -1 -2
отрицательных степенях окисления O, N H202, Ba02, N2H4
Металлы в высших положительных + 7 +6 +4
степенях окисления Mn, Cr, Sn KMn04, K2Cr04, H2Cr207, SnCl4
Металлы в промежуточных + 2 +1 +2
положительных степенях окисления Fe, Cu, Sn FeCl2, Cu2Cl2, SnS04
Слайд 7Группа восстановителей
Химические элементы Примеры веществ
Электрический ток на катоде - -
Металлы – простые вещества 0 0 0
(нулевая степень окисления) Na, Ba, Fe Na, Ba, Fe
Неметаллы в низшей -1 -3 -2
отрицательной степени окисления Cl, N, S НCl, NH3, ZnS
Металлы в промежуточных +2 +2 +1
положительных степенях окисления Fe, Cr, Cu FeSO4, CrCl2, Cu2Cl2
Неметаллы в промежуточных - 1 -2
отрицательной степени окисления О, N H2O2, N2H4
Неметаллы – простые вещества 0 0 0 0
(нулевая степень окисления) S, P, C, I S, P4, C, I2
Неметаллы в промежуточных +3 +4 +2
положительных степенях окисления Р, S, C PCl3, SO2, CO
Электрический ток на катоде - -
Металлы – простые вещества 0 0 0
(нулевая степень окисления) Na, Ba, Fe Na, Ba, Fe
Неметаллы в низшей -1 -3 -2
отрицательной степени окисления Cl, N, S НCl, NH3, ZnS
Металлы в промежуточных +2 +2 +1
положительных степенях окисления Fe, Cr, Cu FeSO4, CrCl2, Cu2Cl2
Неметаллы в промежуточных - 1 -2
отрицательной степени окисления О, N H2O2, N2H4
Неметаллы – простые вещества 0 0 0 0
(нулевая степень окисления) S, P, C, I S, P4, C, I2
Неметаллы в промежуточных +3 +4 +2
положительных степенях окисления Р, S, C PCl3, SO2, CO
Слайд 8Любая окислительно–восстановительная реакция протекает в сторону образования более слабого окислителя, и
более слабого восстановителя.
По сравнительной способности принимать электроны вещества располагаются в ряд окислителей:
KМnO4 → H2O2 → Cl2 → K2Cr2O7 → Br2 → KIO3 → HNO3 → I2
По сравнительной способности отдавать электроны вещества располагаются в ряд восстановителей:
H2S → SnCl2 → HI → HBr → FeSO4 → Cr2(SO4)3 → HCl → MnSO4
По сравнительной способности принимать электроны вещества располагаются в ряд окислителей:
KМnO4 → H2O2 → Cl2 → K2Cr2O7 → Br2 → KIO3 → HNO3 → I2
По сравнительной способности отдавать электроны вещества располагаются в ряд восстановителей:
H2S → SnCl2 → HI → HBr → FeSO4 → Cr2(SO4)3 → HCl → MnSO4
Слайд 9Составить схему реакции.
Mg
+ H2SO4 → MgSO4 + H2S + Н2О
Определить степени окисления элементов в реагентах и продуктах реакции.
Mg0 + H2+1S+6O4-2 → Mg+2S+6O4-2 + H2+1S-2 +Н2+1О-2
Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов.
Подчеркнуть элементы, степени, окисления которых изменяются.
Mg0 + H2+1S+6O4-2 → Mg+2S+6O4-2 + H2+1S-2 + Н2+1О-2
Определить, какой элемент окисляется, (его степень окисления повышается) и какой элемент восстанавливается (его степень окисления понижается), в процессе реакции.
Mg0 → Mg+2 окисляется
S+6 → S-2 восстанавливается
В левой части схемы обозначить с помощью стрелок процесс окисления (смещение электронов от атома элемента) и процесс восстановления (смещение электронов к атому элемента)
Mg0 – 2 ē → Mg+2 окисление
S+6 + 8 ē → S-2 восстановление
Определить степени окисления элементов в реагентах и продуктах реакции.
Mg0 + H2+1S+6O4-2 → Mg+2S+6O4-2 + H2+1S-2 +Н2+1О-2
Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов.
Подчеркнуть элементы, степени, окисления которых изменяются.
Mg0 + H2+1S+6O4-2 → Mg+2S+6O4-2 + H2+1S-2 + Н2+1О-2
Определить, какой элемент окисляется, (его степень окисления повышается) и какой элемент восстанавливается (его степень окисления понижается), в процессе реакции.
Mg0 → Mg+2 окисляется
S+6 → S-2 восстанавливается
В левой части схемы обозначить с помощью стрелок процесс окисления (смещение электронов от атома элемента) и процесс восстановления (смещение электронов к атому элемента)
Mg0 – 2 ē → Mg+2 окисление
S+6 + 8 ē → S-2 восстановление
Слайд 10
Определить восстановитель и окислитель.
Mg0 – 2 ē → Mg+2 восстановитель
S+6 + 8 ē → S-2 окислитель
Сбалансировать число электронов между окислителем и восстановителем.
Mg0 – 2 ē → Mg+2
8
S+6 + 8 ē → S-2
Определить коэффициенты для окислителя и восстановителя, продуктов окисления и восстановления.
Mg0 – 2 ē → Mg+2 4
8
S+6 + 8 ē → S-2 1
Расставить коэффициенты перед формулами окислителя и восстановителя.
4Mg + 5H2SO4 → 4MgSO4 + H2S + 4H2O
Проверить уравнение реакции. Посчитаем количество атомов кислорода справа и слева, если их будет равное количество – уравнение мы уравняли.
5 • 4 = 20 4 • 4 + 4 = 20
S+6 + 8 ē → S-2 окислитель
Сбалансировать число электронов между окислителем и восстановителем.
Mg0 – 2 ē → Mg+2
8
S+6 + 8 ē → S-2
Определить коэффициенты для окислителя и восстановителя, продуктов окисления и восстановления.
Mg0 – 2 ē → Mg+2 4
8
S+6 + 8 ē → S-2 1
Расставить коэффициенты перед формулами окислителя и восстановителя.
4Mg + 5H2SO4 → 4MgSO4 + H2S + 4H2O
Проверить уравнение реакции. Посчитаем количество атомов кислорода справа и слева, если их будет равное количество – уравнение мы уравняли.
5 • 4 = 20 4 • 4 + 4 = 20
Слайд 12Окислительно-восстановительные реакции зависят:
От водородного показателя:
Например:
КМnО4 в кислой среде восстанавливается до Mn2+
(бесцвет)
в нейтральной среде до MnO2 (бурокоричневый)
в щелочной среде до MnO42- (зеленый)
К2Сr2O7 в кислой среде восстанавливается до Cr3+
в нейтральной среде до Сr2O3
в щелочной среде до CrO42-
Слайд 13 Окислительно-восстановительные реакции в органической химии связано либо с образованием связей
по кислороду, либо с отщеплением водорода.
Правило образование связей: - ОН → -1е
=О → -2е
отщепление 1атома Н → -1е
Правило образование связей: - ОН → -1е
=О → -2е
отщепление 1атома Н → -1е
Слайд 14Пример 1: C2H5OH + KMnO4 + H2SO4 → C2H4O + K2SO4
+ MnSO4 + H2O
C – 2e → C 2 5 восстановитель
Mn+7 + 5e → Mn+2 5 2 окислитель
углерод потерял один атом водорода
и образовалась еще 1связь с кислородом
5C2H5OH + 2KМnO4 + 3H2SO4 → 5C2H4O + K2SO4 + 2MnSO4 + 8H2O
C – 2e → C 2 5 восстановитель
Mn+7 + 5e → Mn+2 5 2 окислитель
углерод потерял один атом водорода
и образовалась еще 1связь с кислородом
5C2H5OH + 2KМnO4 + 3H2SO4 → 5C2H4O + K2SO4 + 2MnSO4 + 8H2O
Слайд 15Пример 2: СН2=СН2 + KМnO4 + Н2О → СН2=СН2 + MnO2
+ KOH
| |
ОН ОН
C – 2e → C 2 3 восстановитель
Mn+7 + 3e → Mn+4 3 2 окислитель
два атома углерода образовали по одно связи с кислородом
3СН2=СН2 + 2KМnO4 + 4Н2О → 3СН2=СН2 +
| |
2MnO2 + 2KOH ОН ОН
| |
ОН ОН
C – 2e → C 2 3 восстановитель
Mn+7 + 3e → Mn+4 3 2 окислитель
два атома углерода образовали по одно связи с кислородом
3СН2=СН2 + 2KМnO4 + 4Н2О → 3СН2=СН2 +
| |
2MnO2 + 2KOH ОН ОН
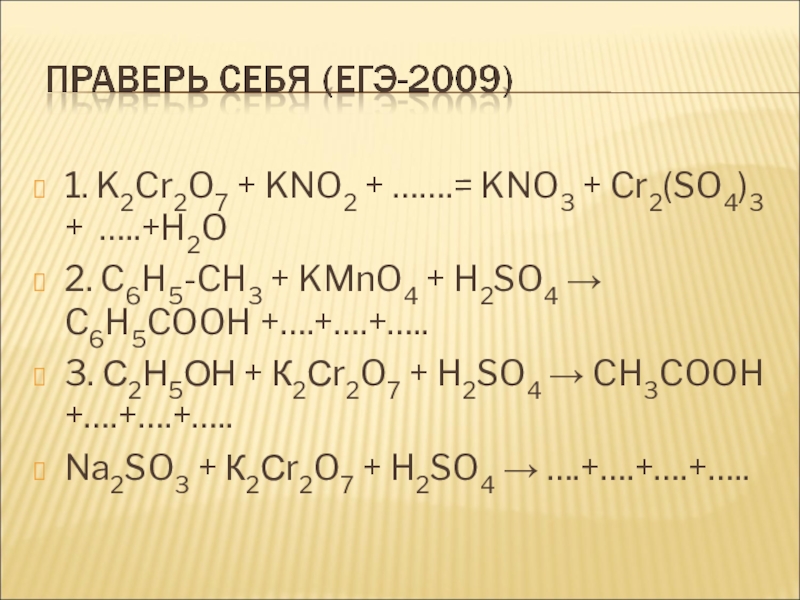
Слайд 161. K2Cr2O7 + KNO2 + …….= KNO3 + Cr2(SO4)3 + …..+H2O
2.
C6H5-CH3 + KMnO4 + H2SO4 → C6H5COOH +….+….+…..
3. С2Н5ОН + К2Сr2O7 + H2SO4 → CH3COOH +….+….+…..
Na2SO3 + К2Сr2O7 + H2SO4 → ….+….+….+…..
3. С2Н5ОН + К2Сr2O7 + H2SO4 → CH3COOH +….+….+…..
Na2SO3 + К2Сr2O7 + H2SO4 → ….+….+….+…..