- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Обратимость химических реакций. Смещение химического равновесия
Содержание
- 1. Обратимость химических реакций. Смещение химического равновесия
- 2. Цель урока: Изучить понятие химическое равновесие. Сформировать знания о факторах, влияющих на смещение химического равновесия
- 3. Какие реакции называются обратимыми?Реакции, протекающие одновременно в двух противоположных направлениях, называются обратимыми.
- 4. 2HI = H2+ I22HI = H2+ I2
- 5. Способы смещения химического равновесия.Принцип Ле-Шателье (1884 г.):
- 6. 1. Концентрация.– увеличение концентрации исходных веществ смещает
- 7. 2. Температура – увеличение температуры в
- 8. 3. Давление– увеличение давления смещает равновесие в
- 9. ! Катализатор не влияет на положение равновесия, а только ускоряет его достижение.
- 10. Выполните задания:1. Дана реакция: 3Н2 + N2
- 11. 2. Дана реакция: N2 + О2 =
- 12. 3. Дана реакция: S + О2
- 13. 4. Дана реакция: 2NО + О2 =
- 14. Спасибо за работу на уроке!
Цель урока: Изучить понятие химическое равновесие. Сформировать знания о факторах, влияющих на смещение химического равновесия
Слайд 2Цель урока:
Изучить понятие химическое равновесие.
Сформировать знания о факторах, влияющих
на смещение химического равновесия
Слайд 3Какие реакции называются обратимыми?
Реакции, протекающие одновременно в двух противоположных направлениях, называются
обратимыми.
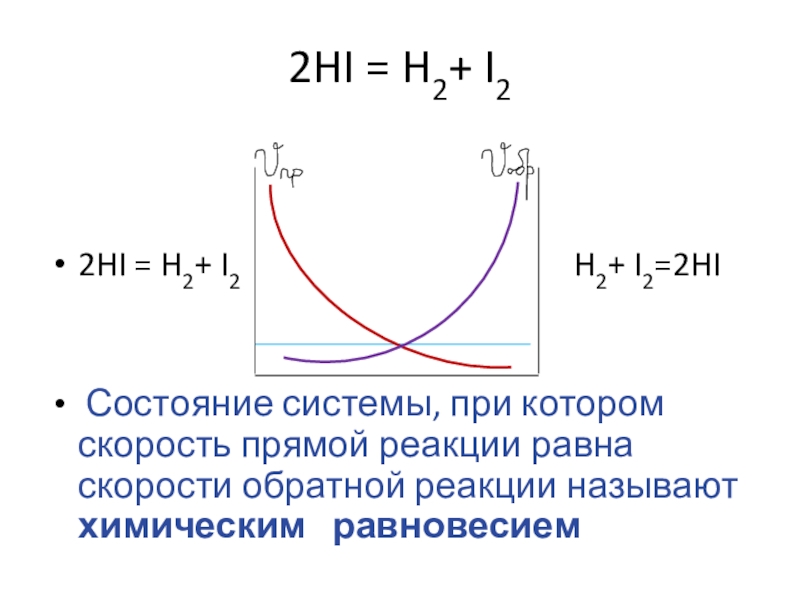
Слайд 42HI = H2+ I2
2HI = H2+ I2
H2+ I2=2HI
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции называют химическим равновесием
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции называют химическим равновесием
Слайд 5Способы смещения химического равновесия.
Принцип Ле-Шателье (1884 г.): если на систему, находящуюся
в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие.
А + В = С
А + В = С
Слайд 61. Концентрация.
– увеличение концентрации исходных веществ смещает равновесие в сторону продуктов
реакции (увеличивается скорость прямой реакции)
– увеличение концентрации продуктов реакции смещает равновесие в сторону продуктов реакции (увеличивается скорость обратной реакции)
– увеличение концентрации продуктов реакции смещает равновесие в сторону продуктов реакции (увеличивается скорость обратной реакции)
Слайд 72. Температура
– увеличение температуры в эндотермических реакциях смещает равновесие в
сторону продуктов реакции (увеличивается скорость прямой реакции)
– увеличение в экзотермических реакциях смещает равновесие в сторону продуктов реакции (увеличивается скорость обратной реакции)
– увеличение в экзотермических реакциях смещает равновесие в сторону продуктов реакции (увеличивается скорость обратной реакции)
Слайд 83. Давление
– увеличение давления смещает равновесие в сторону реакции, ведущей к
образованию меньшего числа молекул газообразных веществ.
-уменьшение давления смещает равновесие в сторону той реакции, при которой число молекул образовавшихся газообразных продуктов увеличивается.
-уменьшение давления смещает равновесие в сторону той реакции, при которой число молекул образовавшихся газообразных продуктов увеличивается.
Слайд 10Выполните задания:
1. Дана реакция: 3Н2 + N2 ═ 2NH3 + Q
Как
повлияет на химическое равновесие:
увеличение температуры,
уменьшение давления,
увеличение концентрации аммиака.
увеличение температуры,
уменьшение давления,
увеличение концентрации аммиака.
Слайд 112. Дана реакция: N2 + О2 = 2NО - Q
Как повлияет
на химическое равновесие:
уменьшение температуры,
уменьшение давления,
уменьшение концентрации азота.
уменьшение температуры,
уменьшение давления,
уменьшение концентрации азота.
Слайд 123. Дана реакция: S + О2 ═ SО2 - Q
Как
повлияет на химическое равновесие
увеличение температуры,
уменьшение давления,
увеличение концентрации оксида серы.
увеличение температуры,
уменьшение давления,
увеличение концентрации оксида серы.
Слайд 134. Дана реакция: 2NО + О2 = 2NО2 - Q
Как повлияет
на химическое равновесие
уменьшение температуры,
уменьшение давления,
уменьшение концентрации азота.
уменьшение температуры,
уменьшение давления,
уменьшение концентрации азота.