Нахождение металлов в природе
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Коррозия металлов
Содержание
- 1. Коррозия металлов
- 2. Пирометаллургия - получение металлов и сплавов под
- 3. Гидрометаллургия - получение металлов из водных растворов.1
- 4. Электрометаллургия - получение металлов под действием электрического
- 5. Сплавы – это гомогенная система, образованная сплавлением
- 6. Сплавы на основе железаЧугун – это сплав
- 7. Бронза – сплав на основе меди с
- 8. У металлов есть враг, который
- 9. Коррозия металлов
- 10. 1. Коррозия – это процесс самопроизвольного разрушения
- 11. Ущерб, наносимый коррозиейМировая потеря 20 млн. тонн металла в годЕще более значимы косвенные потери
- 12. Что является символом Парижа? –Эйфелева
- 13. Сущность коррозии. Коррозия состоит из двух процессов:
- 14. Виды коррозии
- 15. Коррозия По виду коррозионной средыПо характеруразрушенияПо процессамГазоваяЖидкостная
- 16. По виду коррозионной среды
- 17. Газовая Атмосферная Жидкостная Почвенная Блуждающими токами
- 18. По характеру разрушений
- 19. Сплошная коррозияРавномерная Неравномерная
- 20. Местная коррозияЯзвенная Точечная Пятнами
- 21. Причины возникновения местной коррозииСоль на дорогахМорская водаМежкристаллитная коррозияВозникает на границе зерен кристаллов
- 22. По процессам
- 23. Химическая коррозияХимическая коррозия – самопроизвольное разрушение металлов
- 24. Электрохимическая коррозияЭлектрохимическая коррозия металлов – самопроизвольный процесс
- 25. Защита металлов от коррозии
- 26. Применение ингибиторовИнгибиторы - это вещества, способные замедлять
- 27. Нанесение защитных покрытийПластмасса Краска ЛакГрунтовкаСмолаЭмаль Масло
- 28. Покрытие антикоррозионным металломХромирование Никелирование Оцинковка
- 29. Позолота Покрытие антикоррозионным металломЛужение Покрытие алюминием
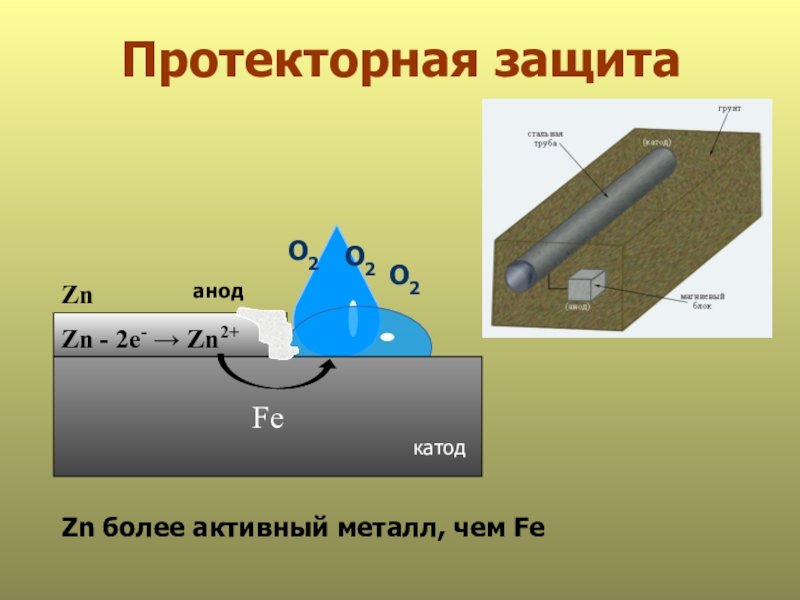
- 30. Протекторная защита анодFeО2О2Zn - 2е- → Zn2+катодZn более активный металл, чем FeZnО2
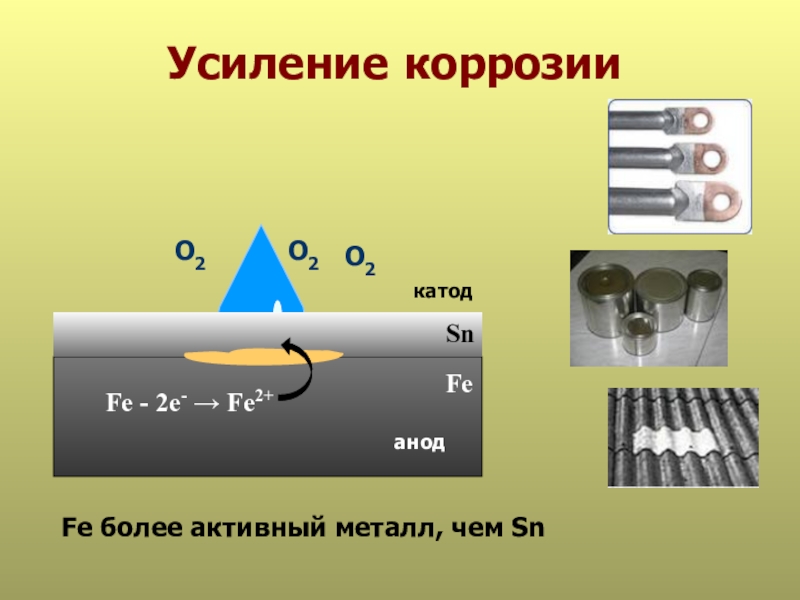
- 31. Усиление коррозии SnанодкатодFe - 2е- → Fe2+FeFe более активный металл, чем Sn О2О2О2
- 32. Запомни:- катионы водорода и растворенный кислород- важнейшие
- 33. Коррозионные свойства металлов на основании
- 34. Задача 1Сантехника попросили поставить водопроводный кран, на
- 35. Задача 2Человек поставил на зуб золотую коронку,
Слайд 1Самым распространенным Ме в земной коре является алюминий. За ним следует
Слайд 2Пирометаллургия - получение металлов и сплавов под действием высоких температур.
Восстановление
2PbO + C = CO2 + 2Pb
Восстановление алюминием (кальцием):
2Al + Fe2O3 = Al2O3 + 2Fe
Восстановление водородом:
СuO + H2 = Cu + H2O
Способы получения металлов
Слайд 3Гидрометаллургия - получение металлов из водных растворов.
1 стадия: растворение в кислоте
CuS + 2HCl = CuCl2 + H2S
2 стадия: вытеснение металлов из растворов их солей более активными металлами:
CuCl2 + Fe = FeCl2 + Cu
Способы получения металлов
Слайд 4Электрометаллургия - получение металлов под действием электрического тока.
Этим способом в
Способы получения металлов
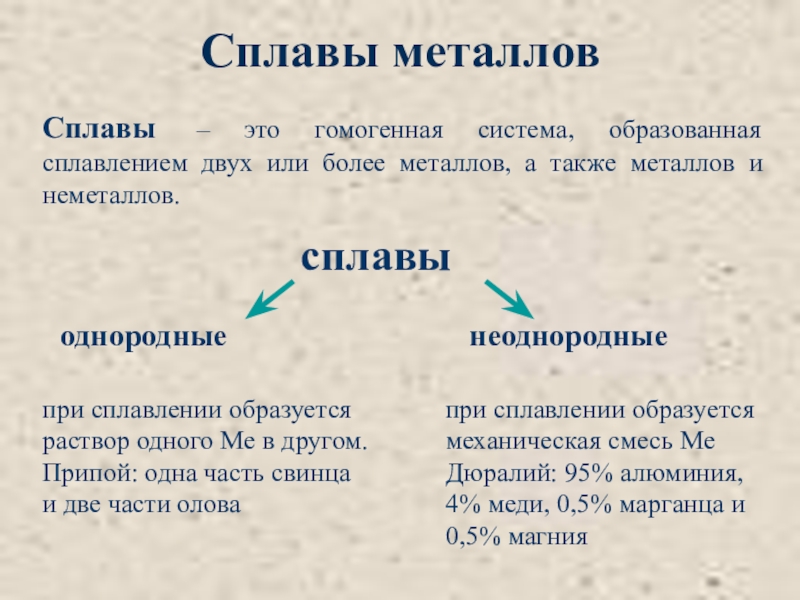
Слайд 5Сплавы – это гомогенная система, образованная сплавлением двух или более металлов,
Сплавы металлов
Слайд 6Сплавы на основе железа
Чугун – это сплав железа, содержащий более 1,7
Сталь - это сплав железа, содержащий 0,1-2 % углерода и небольшие количества кремния, марганца, фосфора и серы.
Черные сплавы
Слайд 7Бронза – сплав на основе меди с добавлением (20%) олова.
Латунь –
Мельхиор – сплав, содержащий около 80% меди и 20% никеля
Дюралюминий – сплав на основе алюминия, содержащий медь, марганец, магний и никель.
Цветные сплавы
Слайд 8 У металлов есть враг, который приводит к огромным безвозвратным
Слайд 101. Коррозия – это процесс самопроизвольного разрушения металлов и сплавов под
2. Коррозия– это процесс перехода металла в то природное, естественное состояние, в котором
мы встречаем его в земной коре.
Слайд 11Ущерб, наносимый коррозией
Мировая потеря 20 млн. тонн металла в год
Еще более
Слайд 12 Что является символом Парижа? –Эйфелева башня. Она неизлечима больна,
её красили 18 раз, отчего её масса 9000 т каждый раз увеличивается на 70 т.
Слайд 13Сущность коррозии.
Коррозия состоит из двух процессов: химического – это отдача
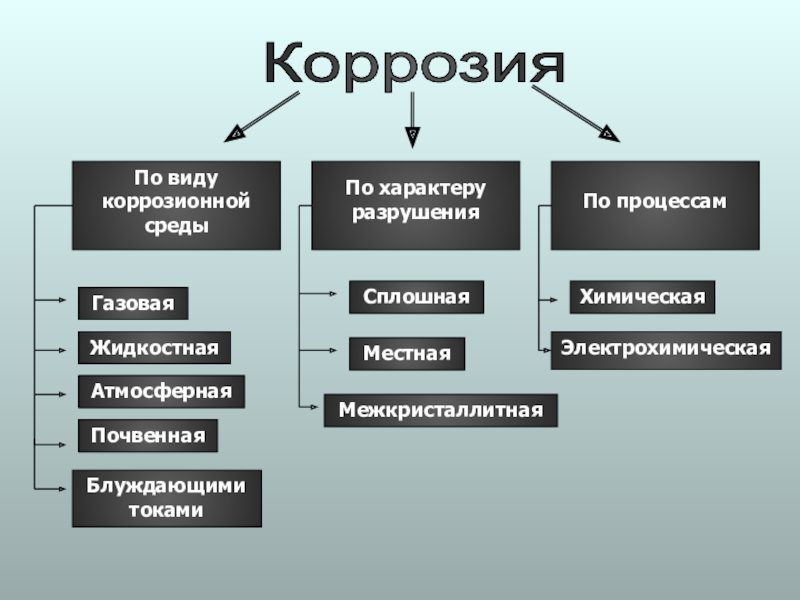
Слайд 15Коррозия
По виду
коррозионной среды
По характеру
разрушения
По процессам
Газовая
Жидкостная
Атмосферная
Почвенная
Сплошная
Местная
Химическая
Электрохимическая
Межкристаллитная
Блуждающими токами
Слайд 21Причины возникновения местной коррозии
Соль на дорогах
Морская вода
Межкристаллитная коррозия
Возникает на границе зерен
Слайд 23Химическая коррозия
Химическая коррозия – самопроизвольное разрушение металлов
в среде окислительного газа
повышенных температурах или в жидких неэлектролитах.
2Fe + 3Cl2 = 2FeCl3
4Fe + 3О2 = 2Fe2 О3
Газовая
В жидких
не электролитах
В нефти
В сере
В органических веществах
Cu + S = CuS
2 Ag + S = Ag2S
2Al + 6ССl4 = 3C2Cl6 + 3AlCl3
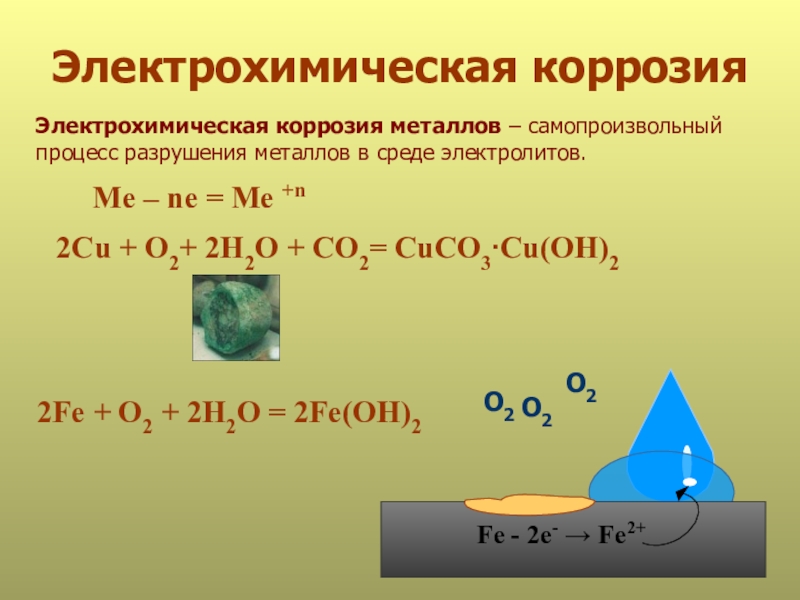
Слайд 24Электрохимическая коррозия
Электрохимическая коррозия металлов – самопроизвольный
процесс разрушения металлов в среде
2Fe + O2 + 2H2O = 2Fe(OH)2
Me – ne = Me +n
Fe - 2е- → Fe2+
О2
О2
2Сu + O2+ 2H2O + CO2= CuCO3∙Cu(OH)2
О2
Слайд 26Применение ингибиторов
Ингибиторы - это вещества,
способные замедлять протекание
химических процессов или
останавливать их.
Известно более 5 тысяч
Слайд 32Запомни:
- катионы водорода и растворенный кислород- важнейшие окислители, вызывающие электрохимическую коррозию;
( металл и примеси) по своей активности(для металлов – чем дальше они
располагаются в ряду активности);
коррозия усиливается при увеличении температуры;
электролитом может служить морская или речная вода,
конденсированная влага, растворы кислот, солей, щелочей;
- при электрохимической коррозии разрушается металл с более сильными
восстановительными свойствами. Он выполняет роль анода. На катоде
идет восстановление ионов Н+ до Н2 или молекул кислорода с образованием
гидроксид-ионов.
Слайд 33Коррозионные свойства металлов на основании
их положения в
I группа. Щелочные металлы имеют наименьшую коррозионную стойкость, на воздухе
покрываются пленкой оксидов, пероксидов, а так же их соединений с CO2 и Н2О .
Cu, Ag, Au – очень стойкие к коррозии металлы.
II группа. Металлы главной п/гр малоустойчивы к коррозии.
Металлы побочной п/гр Zn, Cd, Pb образуют на поверхности тонкие прочные
пленки оксидов, предохраняющие от дальнейшего разрушения.
III группа Al образует тонкую защитную оксидную пленку, которая разрушается
в растворах кислот и щелочей (пассивируетя H2SO4(конц.) и HNO3(конц.)
IV группа Sn и Pb – стойкие к коррозии металлы, благодаря оксидным пленкам
V, VI, VII, VIII группы Металлы побочных п/гр V, Cr, Co, Mo, Ru, W,Os Ir,Pt
обладают высокой коррозионной стойкостью
Слайд 34Задача 1
Сантехника попросили поставить водопроводный кран,
на стальную трубу. В наличии
Слайд 35Задача 2
Человек поставил на зуб золотую коронку, по истечении
некоторого времени
коронке, но средств на коронку у него нет.
Возможен ли вариант, чтобы поставить на зуб
стальную коронку?
Что Вы можете предложить в решении данной проблемы?