- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Электролитическая диссоциация
Содержание
- 1. Электролитическая диссоциация
- 2. Электролитическая диссоциация
- 3. Вопросы для исследования:3. Степень диссоциации. Слабые и
- 4. Понятие об электролитах и диссоциации.
- 5. Вещества ЭлектролитыНеэлектролитыВещества, водные растворы или расплавы которых
- 6. Слайд 6
- 7. Ионная или сильнополярная ковалентная связьОснованияКислотыСолиКовалентная неполярная или малополярная связьОрганические соединенияГазыНеметаллыЭлектролитыНеэлектролиты
- 8. Строение молекулы воды. Механизм электролитической диссоциации.
- 9. Причины диссоциации веществ в воде 2. Вода
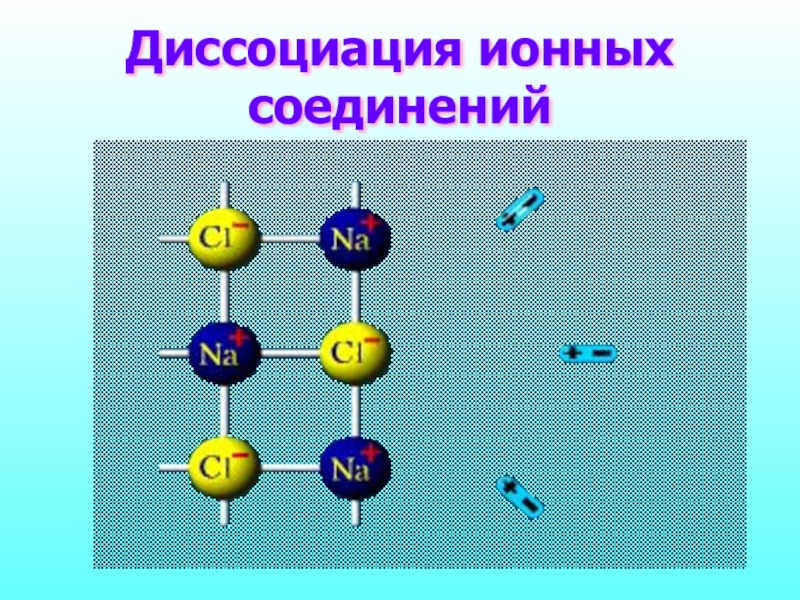
- 10. Диссоциация ионных соединений
- 11. Степень диссоциации. Слабые и сильные электролиты.
- 12. Количественная характеристика процесса диссоциацииОтношение числа распавшихся молекул к общему числу молекул в раствореСила электролита
- 13. Количественная характеристика процесса диссоциацииПри уменьшении концентрации электролита
- 14. Кислоты как электролиты.
- 15. Кислоты - это сложные вещества, при диссоциации
- 16. Основания как электролиты.
- 17. Основания - это сложные вещества, при диссоциации
- 18. Соли как электролиты.
- 19. Соли как электролиты.Соли- это сложные вещества, при
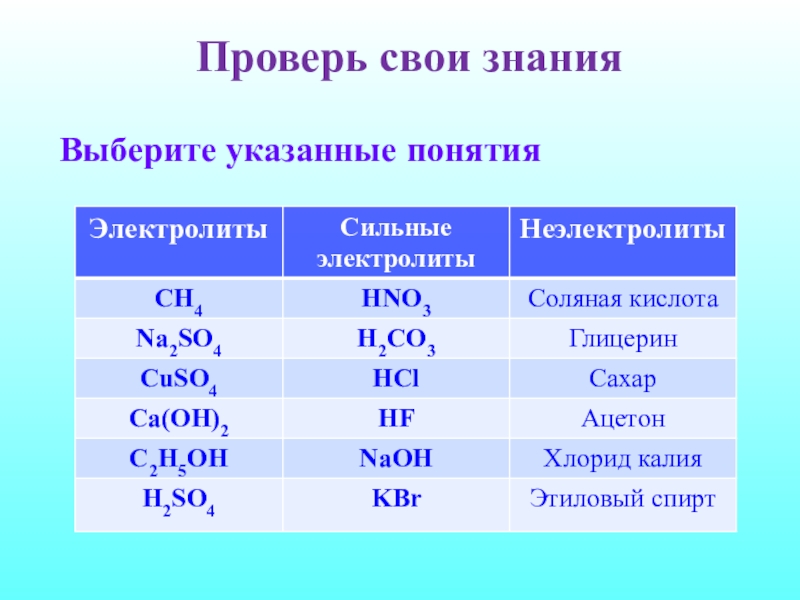
- 20. Проверь свои знанияВыберите указанные понятия
- 21. Проверь свои знания
- 22. Самооценка своей деятельностиЗадание на дом: §15Поставь оценку
- 23. Спасибо за работу!
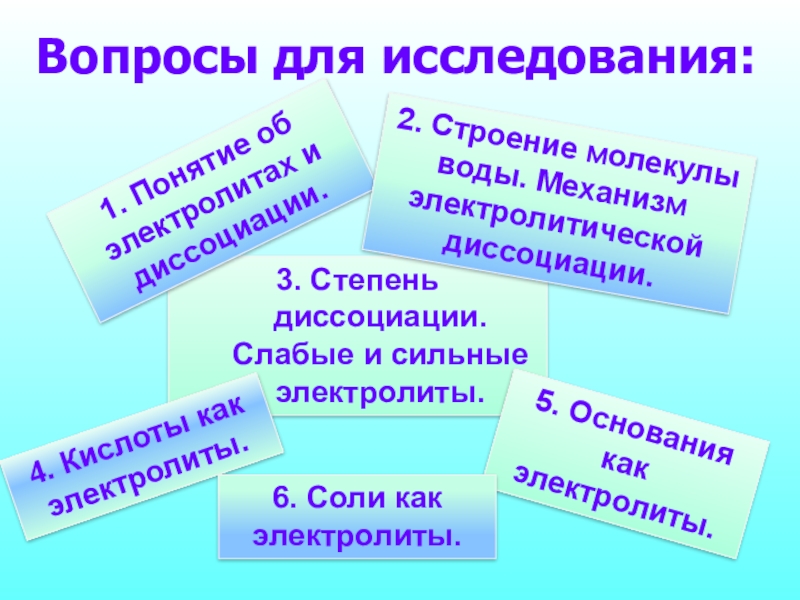
Слайд 3Вопросы для исследования:
3. Степень диссоциации. Слабые и сильные электролиты.
4. Кислоты как
5. Основания как электролиты.
6. Соли как электролиты.
1. Понятие об электролитах и диссоциации.
2. Строение молекулы воды. Механизм электролитической диссоциации.
Слайд 5
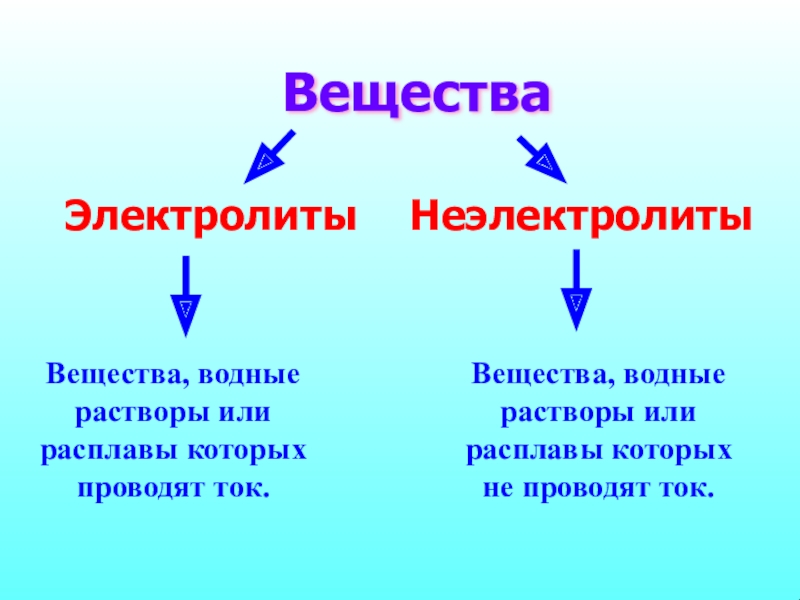
Вещества
Электролиты
Неэлектролиты
Вещества, водные растворы или расплавы которых проводят ток.
Вещества, водные растворы
Слайд 7Ионная или сильнополярная ковалентная связь
Основания
Кислоты
Соли
Ковалентная неполярная или малополярная связь
Органические соединения
Газы
Неметаллы
Электролиты
Неэлектролиты
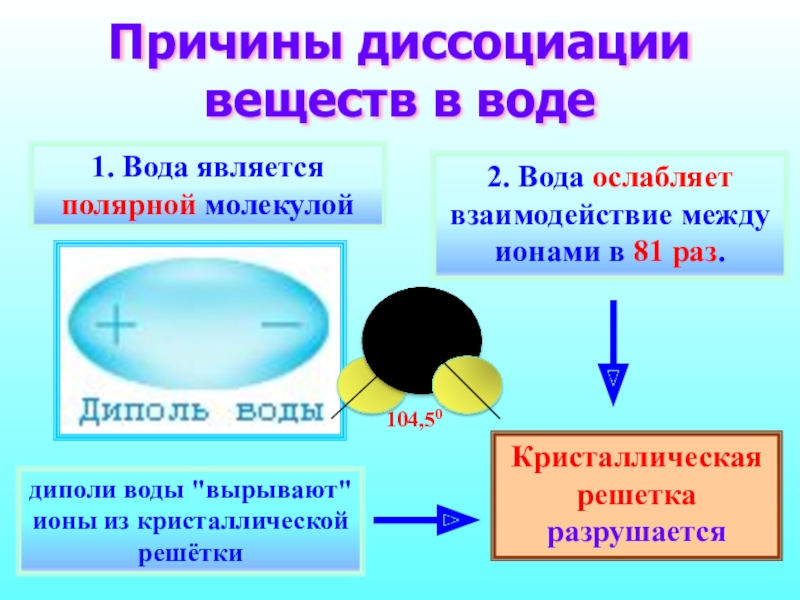
Слайд 9Причины диссоциации веществ в воде
2. Вода ослабляет взаимодействие между ионами
Кристаллическая решетка разрушается
1. Вода является полярной молекулой
диполи воды "вырывают" ионы из кристаллической решётки
Слайд 12Количественная характеристика процесса диссоциации
Отношение числа распавшихся молекул к общему числу молекул
Сила электролита
Слайд 13Количественная характеристика процесса диссоциации
При уменьшении концентрации электролита степень его диссоциации увеличивается
При
Слайд 15Кислоты - это сложные вещества, при диссоциации которых в водных растворах
НCl → H+ + Cl -
Н2SO4 → H+ + НSO4 -
НSO4 - → H+ + SO4 2-
Н+
Кислоты как электролиты.
НCl → H+ + Cl -
Слайд 17Основания - это сложные вещества, при диссоциации которых в водных растворах
Основания как электролиты.
KOH → K + + OH-
Ca(OH)2 → Ca2+ + 2OH-
ОН-
Слайд 19Соли как электролиты.
Соли- это сложные вещества, при диссоциации которых в водных
Fe2(SO4)3→2Fe3++3SO42-
(кислотный остаток)в-
Men+