- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Электив: Атомная кристаллическая решетка
Содержание
- 1. Электив: Атомная кристаллическая решетка
- 2. ОпределениеКристалли́ческая решётка — вспомогательный геометрический образ, вводимый для
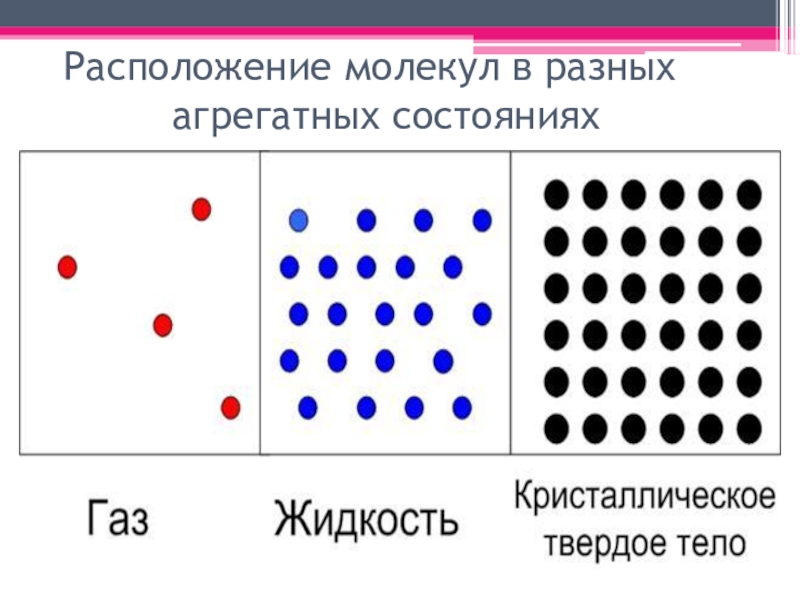
- 3. Расположение молекул в разных агрегатных состояниях
- 4. В атомных кристаллах атомы связаны ковалентной неполярной
- 5. Слайд 5
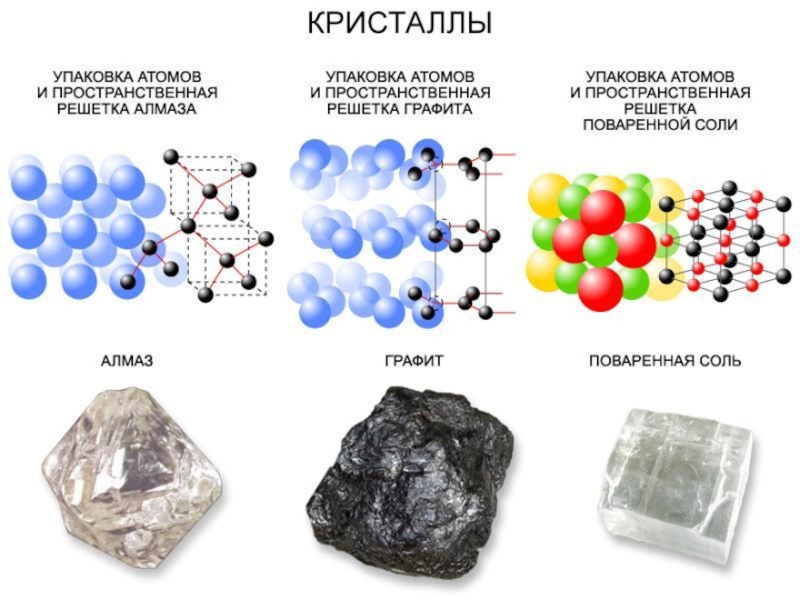
- 6. Алмаз.
- 7. ОпределениеАлмаз – чрезвычайно устойчивая форма углерода, и
- 8. БриллиантыИз алмазов особой огранкой, специально выявляющей его
- 9. определениеГрафит – черное, пачкающее бумагу и руки
- 10. Электропроводность графита наилучшим образом объясняется тем, что
- 11. В графите слои атомов легко скользят относительно
- 12. Графит и алмаз – это различные кристаллические
- 13. В общем случае способность простого вещества существовать
ОпределениеКристалли́ческая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла. Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. В зависимости от типов химической связи между узлами различают следующие типы решёток:ионные,атомные,молекулярные,металлические.
Слайд 2Определение
Кристалли́ческая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла. Решётка
имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. В зависимости от типов химической связи между узлами различают следующие типы решёток:
ионные,
атомные,
молекулярные,
металлические.
ионные,
атомные,
молекулярные,
металлические.
Слайд 4В атомных кристаллах атомы связаны ковалентной неполярной связью. Характерным примером таких
веществ является алмаз, в кристаллической решетке которого все наиближайшие межъядерные расстояния и все углы между четырьмя связями атома углерода равны. Тетраэдрический угол между этими связями свидетельствует об sp3-гибридном состоянии валентных электронных орбиталей атома углерода.
Модель кристаллической решетки алмаза показана на рис.
Слайд 7Определение
Алмаз – чрезвычайно устойчивая форма углерода, и не известно ни одного
случая самопроизвольного перехода при обычных условиях алмаза в графит. Мы говорим о кинетической устойчивости алмаза, т. к. термодинамически более устойчивой формой углерода является графит. При нагревании алмаза без доступа воздуха выше температуры 1200 °С начинается его переход в графит.
Слайд 8Бриллианты
Из алмазов особой огранкой, специально выявляющей его блеск, изготовляют бриллианты, сверкающие
всеми цветами радуги в отраженном свете. Бриллианты – очень дорогие драгоценные камни (масса бриллианта измеряется в каратах, 1 карат = 0,2 г). Алмаз не проводит электрический ток.
Слайд 9определение
Графит – черное, пачкающее бумагу и руки вещество, проводящее электрический ток.
Кристаллическая структура графита совсем не похожа на структуру алмаза. Атомы углерода в графите расположены плоскими сетками, причем углы между связями равны 120°. Это позволяет предположить, что валентные электронные орбитали атома углерода находятся в sp2-гибридном состоянии и каждый атом связан с тремя другими атомами Интересно заметить, что связи С–С в графите более прочные, чем связи в алмазе.
Слайд 10
Электропроводность графита наилучшим образом объясняется тем, что негибридная р-орбиталь атома углерода,
располагающаяся перпендикулярно плоскости перекрывания sp2-гибридных орбиталей, перекрывается своими боковыми областями с тремя подобными орбиталями трех соседних атомов. Таким образом, выше и ниже этой плоскости находятся единые для всех атомов углерода зоны -перекрывания. В этом общем электронном облаке электроны уже не относятся к какому-либо определенному атому углерода, а принадлежат всем атомам, находящимся на плоскости. Графит проводит электрический ток по слою атомов, но не между слоями. Это прекрасный пример анизотропии кристалла!
Слайд 11
В графите слои атомов легко скользят относительно друг друга. Когда вы
пишете графитовым карандашом по бумаге, на ней остаются сместившиеся и прилипшие к бумаге слои атомов. В то же время графит не рассыпается на слои атомов, это свидетельствует о том, что они взаимодействуют между собой. Связи между плоскостями (слоями) очень слабы, их длина почти в 2,5 раза больше, чем межъядерное расстояние С–С в плоскости. За эти связи ответственны силы Ван-дер-Ваальса.
Слайд 12
Графит и алмаз – это различные кристаллические формы, построенные из одинаковых
атомов. Явление изменения кристаллической структуры одного и того же вещества при изменении внешних условий называется полиморфизмом, а сами эти вещества с различной кристаллической структурой называются полиморфными модификациями. Алмаз и графит – полиморфные модификации углерода. Полиморфизм относится только к кристаллическим веществам.
Слайд 13
В общем случае способность простого вещества существовать в различных формах называется
аллотропией. Графит и алмаз можно назвать аллотропными модификациями углерода и одновременно его полиморфными модификациями.
Газообразные кислород О2 и озон О3 – это аллотропные модификации кислорода, но не полиморфные.
http://him.1september.ru/2003/21/4.htm
http://him.1september.ru/2003/21/4.htm