- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Алкины.
Содержание
- 1. Алкины.
- 2. Изомерия Ацетиленовыми углеводородами (алкинами) называются непредельные
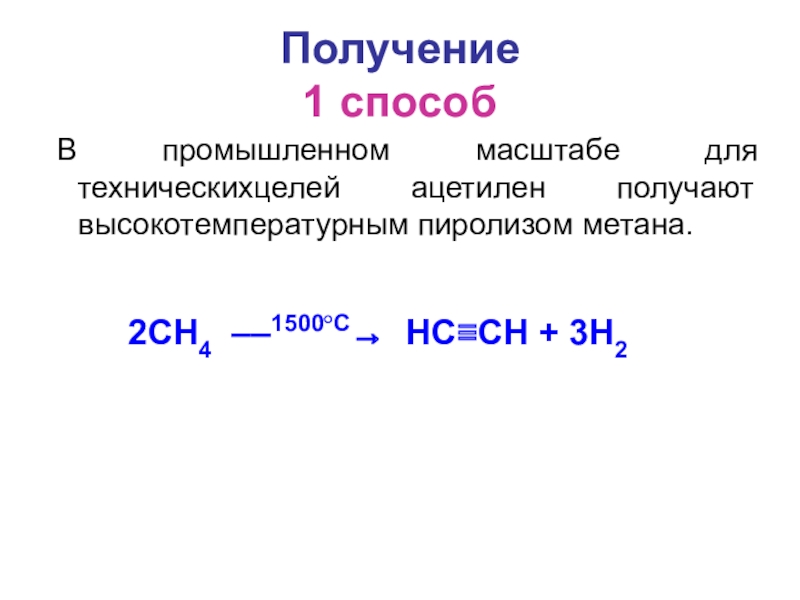
- 3. Получение 1 способ В промышленном масштабе для техническихцелей ацетилен получают высокотемпературным пиролизом метана.2CH4 ––1500°C→ HC≡CH + 3H2
- 4. Получение 2 способ Алкины можно получить
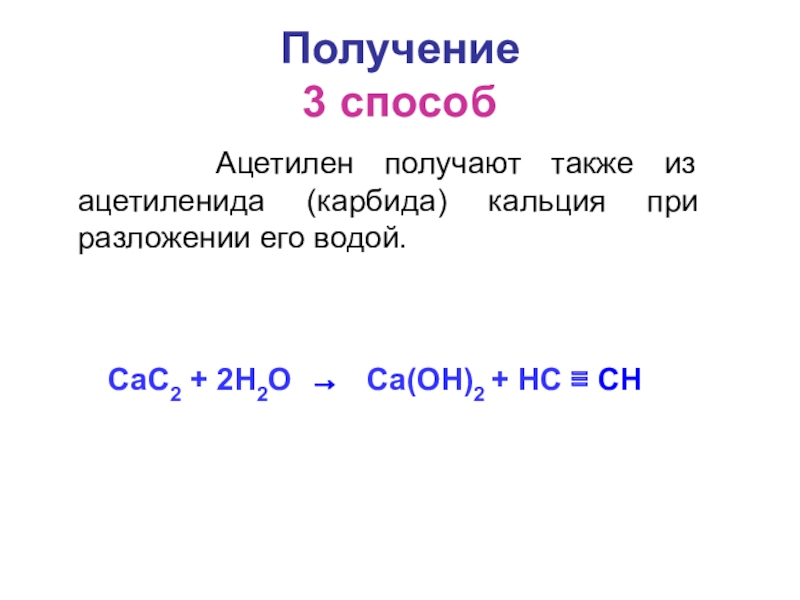
- 5. Получение 3 способ Ацетилен получают
- 6. Физические свойства По физическим свойствам
- 7. Таблица. Физические свойства некоторых алкинов
- 8. Химические свойстваУглеродные атомы в молекуле ацетилена находятся
- 9. Химические свойстваПо одной из двух гибридных орбиталей
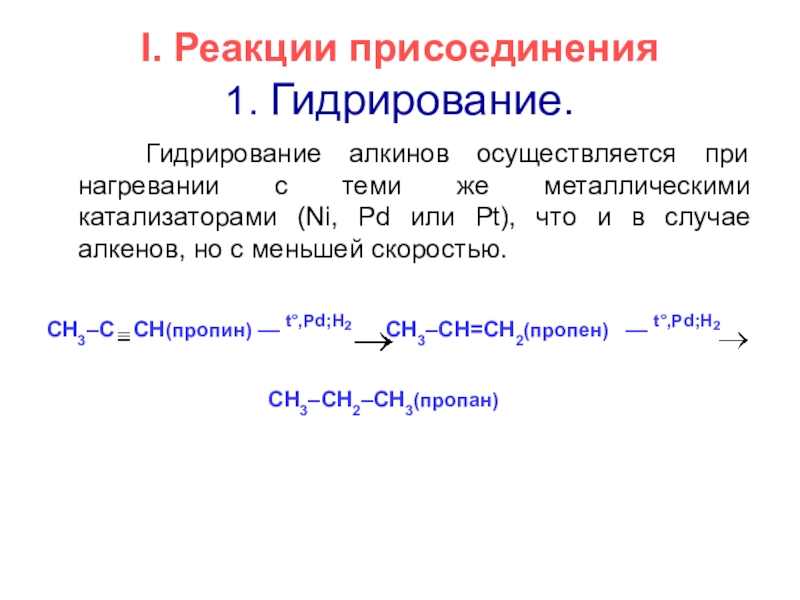
- 10. I. Реакции присоединения 1. Гидрирование. Гидрирование
- 11. I. Реакции присоединения 2. Галогенирование Алкины
- 12. I. Реакции присоединения 3.Гидрогалогенирование. Образующиеся продукты определяются
- 13. I. Реакции присоединения 4.Гидратация Присоединение воды
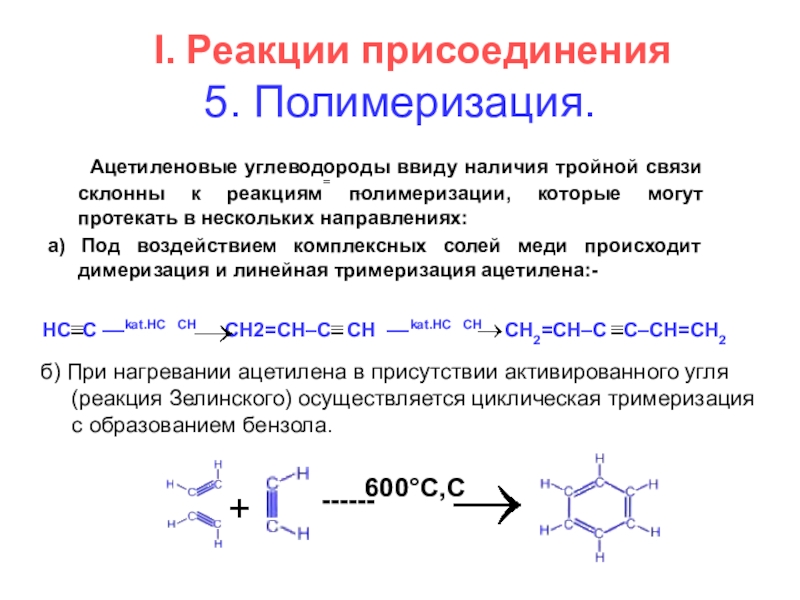
- 14. I. Реакции присоединения 5. Полимеризация.
- 15. II . Кислотные свойстваВодородные атомы ацетилена способны
- 16. АЦЕТИЛЕН Ацетилен (этин) – углеводород
- 17. АЦЕТИЛЕН Историческая справка Впервые ацетилен
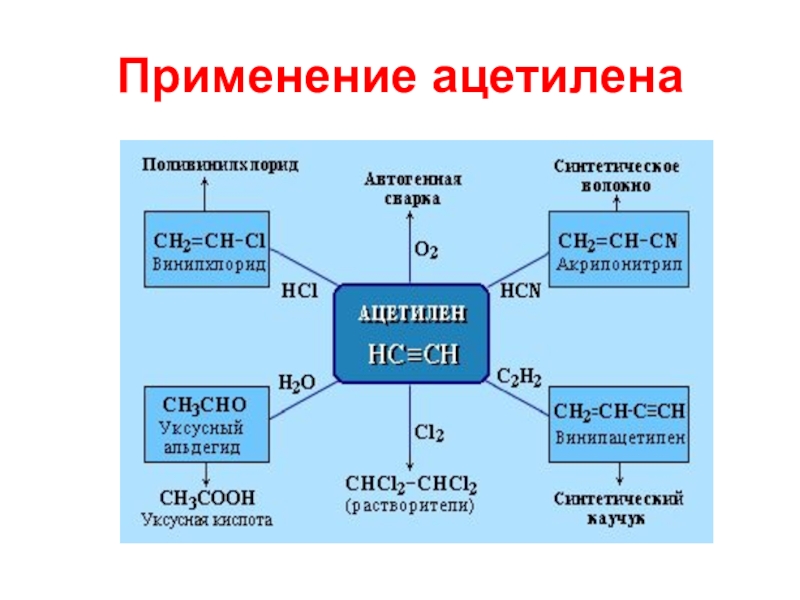
- 18. Применение ацетилена
Слайд 2Изомерия
Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в
Алкинам свойственна изомерия углеродного скелета (начиная с C5H8), изомерия положения тройной связи (начиная с C4H6) и межклассовая изомерия с алкадиенами.
Слайд 3Получение
1 способ
В промышленном масштабе для техническихцелей ацетилен получают высокотемпературным пиролизом метана.
2CH4 ––1500°C→ HC≡CH
Слайд 4Получение
2 способ
Алкины можно получить из дигалогенопроизводных парафинов отщеплением галогеноводорода
Слайд 5Получение
3 способ
Ацетилен получают также из ацетиленида (карбида) кальция
CaC2 + 2H2O → Ca(OH)2 + HC ≡ CH
Слайд 6Физические свойства
По физическим свойствам алкины напоминают алкены и
Слайд 8Химические свойства
Углеродные атомы в молекуле ацетилена находятся в состоянии sp-гибридизации. Это
sp- Гибридные орбитали двух атомов углерода в состоянии, предшествующем образованию тройной связи и связей C–H
Слайд 9Химические свойства
По одной из двух гибридных орбиталей каждого атома углерода взаимно
Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой, две p- связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях
Слайд 10I. Реакции присоединения
1. Гидрирование.
Гидрирование алкинов осуществляется при нагревании с
CH3–C CH(пропин) –– t°,Pd;Н2 CH3–CH=CH2(пропен) –– t°,Pd;H2
CH3–CH2–CH3(пропан)
Слайд 11I. Реакции присоединения 2. Галогенирование
Алкины обесцвечивают бромную воду (качественная
HC CH–– Br 2 CHBr = CHBr( 1,2- дибромэтен) –– Br2
CHBr2 – CHBr2 (1,1,2,2- тетрабромэтан)
Слайд 12I. Реакции присоединения 3.Гидрогалогенирование.
Образующиеся продукты определяются правилом Марковникова.
CH3–C CH ––HBr
–– HBr CH3–CBr2–CH3 (2,2- дибромпропан)
Слайд 13I. Реакции присоединения 4.Гидратация
Присоединение воды осуществляется в присутствии сульфата
В случае гидратации собственно ацетилена конечным продуктом является альдегид
HC≡CH + H2O ––HgSO4→ [CH2=
CH](енол) CH3– С (уксусный альдегид)
I I
НО Н
O
II
Слайд 14 I. Реакции присоединения
5. Полимеризация.
Ацетиленовые углеводороды ввиду наличия
a) Под воздействием комплексных солей меди происходит димеризация и линейная тримеризация ацетилена:-
HC C ––kat.HC CH CH2=CH–C CH ––kat.HC CH CH2=CH–C C–CH=CH2
б) При нагревании ацетилена в присутствии активированного угля
(реакция Зелинского) осуществляется циклическая тримеризация
с образованием бензола.
600°C,C
+
------
Слайд 15II . Кислотные свойства
Водородные атомы ацетилена способны замещаться металлами с образованием
HC CH ––NaNH2 HC CNa + NH3
Ацетилениды серебра и меди получают взаимодействием с
аммиачными растворами соответственно оксида серебра и
хлорида меди.
HC CH + 2[Ag(NH3)2]OH AgC CAg + 4NH3 + 2H2O
Ацетилениды серебра, меди обладают исключительной
взрывчатостью. Они легко разлагаются при действии соляной
кислоты.
AgC CAg + 2HCl HC CH + 2AgCl
Данным свойством ацетиленидов пользуются при выделении ацетиленовых углеводородов из смесей с другими газами