Радиоактивность и радиоактивные
превращения .
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок - презентация по физике для 9 класса Радиоактивные превращения.
Содержание
- 1. Урок - презентация по физике для 9 класса Радиоактивные превращения.
- 2. Цель урока:Познакомиться с историей величайшего
- 3. 2500 лет назад древнегреческие философы Левкипп и
- 4. Слайд 4
- 5. Именно это решил проверить Беккерель.
- 6. Беккерель начал ставить множество опытов, чтобы лучше
- 7. Он получил, что результаты всех прежних опытов
- 8. Неизвестное невидимое излучение, которое самопроизвольно испускал уран назвали радиоактивным.
- 9. Слайд 9
- 10. Когда в руках исследователей появились мощные источники
- 11. Мария Склодовская-Кюри и Пьер Кюри. Полоний Радий
- 12. Слайд 12
- 13. Эрнест Резерфорд и Фредерик Содди.Экспериментируя с торием обнаружили новое радиоактивное вещество – радон.
- 14. Слайд 14
- 15. В 1899 г. группа учёных под руководством Эрнеста Резерфорда экспериментально обнаружила, что радиоактивное излучение неоднородно.
- 16. Что происходит с веществом при радиоактивном излучении?Радиоактивное
- 17. Слайд 17
- 18. Эксперимент, доказывающий, что атом имеет сложный
- 19. Пьер Кюри обнаружил, что при действии
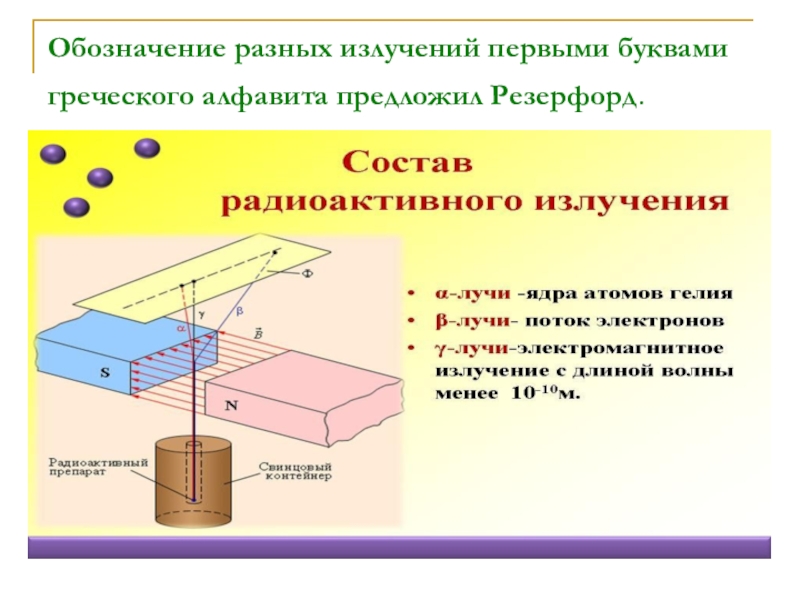
- 20. Обозначение разных излучений первыми буквами греческого алфавита предложил Резерфорд.
- 21. Слайд 21
- 22. Радиоактивные лучи обладают различной способностью проникать через разные материалы
- 23. Можно погибнуть от невидимогоОсновные источники радиации:Космические телаНедра
- 24. Слайд 24
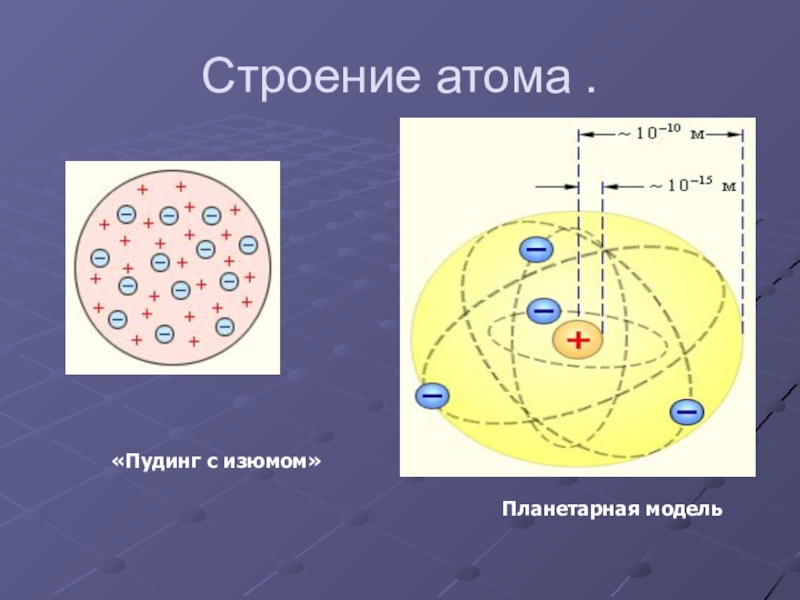
- 25. Строение атома .«Пудинг с изюмом»
- 26. Модель атома ТомсонаДжозеф Джон Томсон(1856 – 1940)Атом
- 27. Эрнест Резерфорд (строение атома).
- 28. Эрнест Резерфорд (30 августа 1871 г. –
- 29. Эрнест Резерфорд Родился в семье колесного мастера
- 30. В Новой Зеландии в 1889 году
- 31. Одно из первых открытий Резерфорда заключалось
- 32. Открытие Резерфорда также привело к появлению новой
- 33. Почти до конца жизни он отличался крепким
- 34. Личность Резерфорда постоянно поражала всех, кто с
- 35. Слайд 35
- 36. Слайд 36
- 37. Резерфорд обнаружил, что некоторые альфа-частицы, проходя сквозь
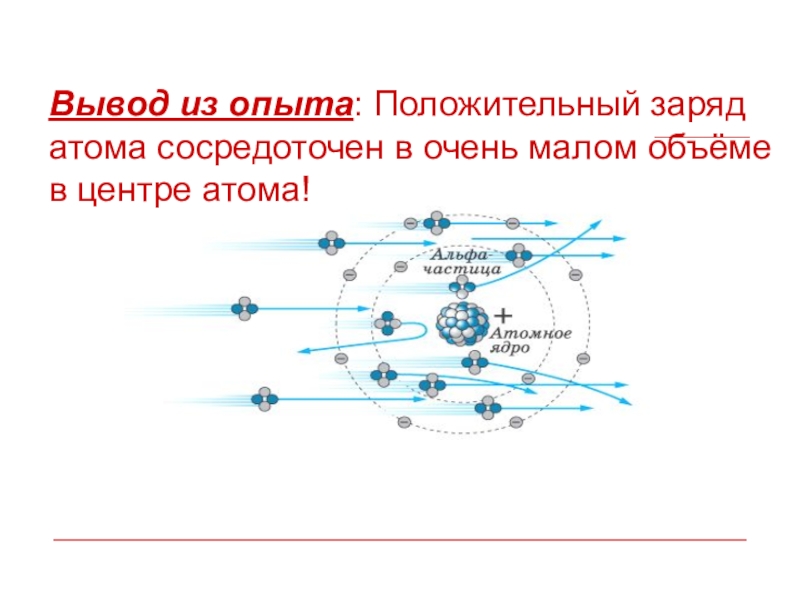
- 38. Вывод из опыта: Положительный заряд атома сосредоточен в очень малом объёме в центре атома!
- 39. Атомное ядро – тело малых размеров, в
- 40. Недостатки атома РезерфордаЭта модель не согласуется с
- 41. Постулаты БораНильс Бор1885-1962атомная система может находится только
- 42. Второй постулат Бора: излучение света происходит при
- 43. Поглощение света – процесс, обратный излучению.Атом, поглощая
- 44. Структура атома
- 45. Атомные частицы и их свойстваАтом состоит из
- 46. По строению атом похож…на Солнечную систему!
- 47. Планетарная модель атомаВ центре атома находится ядро, состоящее из протонов и нейтроновЭлектроны вращаются вокруг ядра
- 48. Упрощённая
- 49. Количество протонов равно количеству электроноватом нейтраленАтом, потерявший один или несколько электронов, называется ПОЛОЖИТЕЛЬНЫМ ИОНОМ
- 50. Как образуется отрицательный ион?Протон очень прочно связан
- 51. Введём обозначения:МZ Х или АZ ХZ –
- 52. Слайд 52
- 53. Периодическая система элементов Д.И. МенделееваПЕРИОДЫ
- 54. Планетарная модель атома
- 55. Планетарная модель атома
- 56. Планетарная модель атома
- 57. Планетарная модель атома
- 58. Планетарная модель атома
- 59. Планетарная модель атома
- 60. Планетарная модель атома
- 61. Планетарная модель атома
- 62. Планетарная модель атома
- 63. Планетарная модель атома
- 64. Изотопы.ЕстественныеИскусственные - «рукотворные» ядра
- 65. Обозначения частиц, часто встречающихся
- 66. Слайд 66
- 67. Реакция альфа – распада:22688 Ra
- 68. Слайд 68
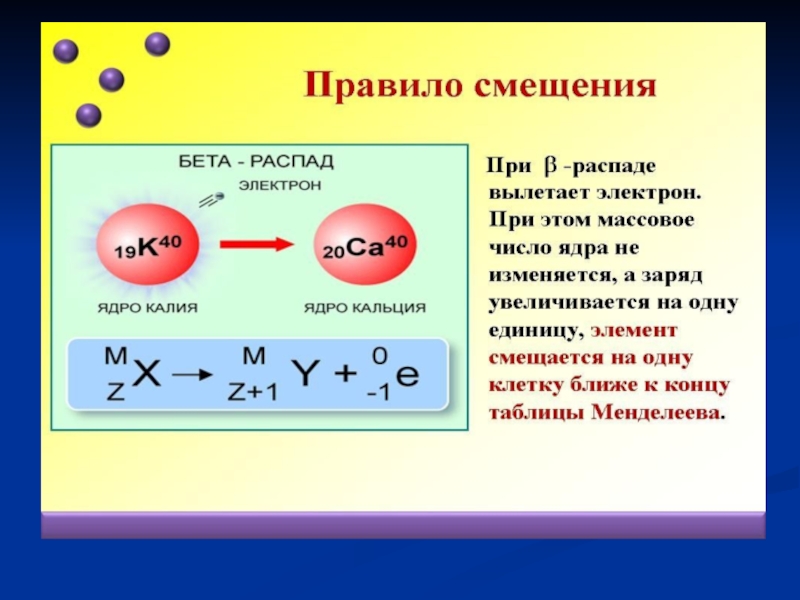
- 69. Бета - распады
- 70. При радиоактивном распаде происходит цепочка последовательных превращений атомов и при этом излучается большая энергия.
- 71. Альберт Эйнштейн сравнил открытие радиоактивности с открытием
- 72. Решение задачЗадача 1: Изотоп тория Th -
- 73. Подведение итоговКак переводится слово радиоактивность? Кто из
- 74. Домашнее задание§ 65, 66, 67, 71, читать,
Слайд 1Строение атома и атомного ядра
Учитель физики МОУ СОШ № 55
г.Тверь
Винокурова Лариса
Слайд 2Цель урока:
Познакомиться с историей
величайшего открытия
Изучить строение атома и
Рассмотреть три вида радиоактивных распадов
записать формулы, по которым рассчитываются химические элементы, полученные в результате радиоактивных распадов
закрепить полученные знания путем решения конкретных задач.
Слайд 32500 лет назад древнегреческие философы Левкипп и Демокрит высказали предположение о
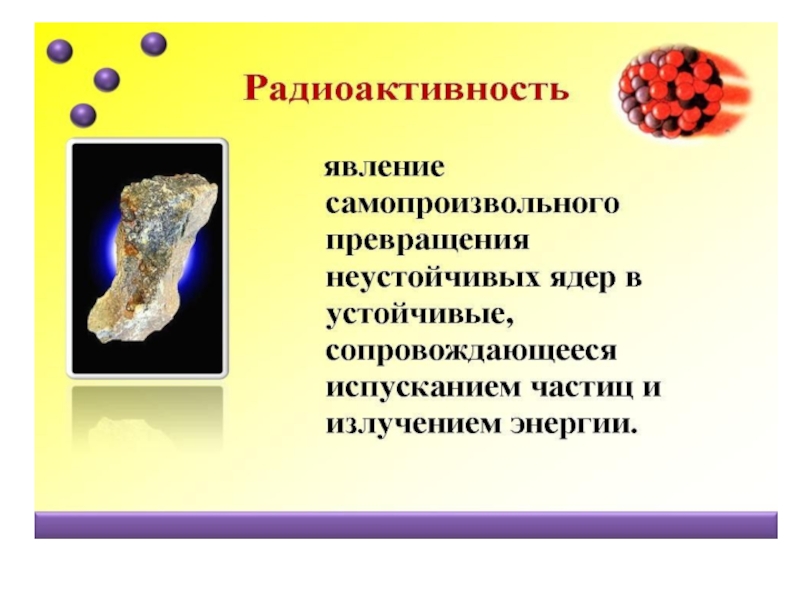
1896 г Анри Беккерель открыл явление радиоактивности – это послужило ярким свидетельством сложного строения атома.
Слайд 4 Беккерель обнаружил, что
С препаратами урана работал еще его отец, который показал, что после прекращения действия солнечного света их свечение исчезает очень быстро – менее чем за сотую долю секунды.
Однако никто не проверял, сопровождается ли это свечение испусканием каких-то других лучей, способных проходить сквозь непрозрачные материалы.
Слайд 5
Именно это решил проверить Беккерель.
24 февраля 1896
заседании Академии он рассказал,
что если взять фотопластинку, завернутую в два слоя плотной черной бумаги, положить на нее кристаллы урана и выставить все это на несколько часов на солнечный свет, то после проявления фотопластинки на ней можно видеть несколько размытый контур кристаллов.
Если между пластинкой и кристаллами поместить монету или вырезанную из жести фигуру, то после проявления на пластинке появляется четкое изображение этих предметов.
Слайд 6
Беккерель начал ставить множество опытов, чтобы лучше понять условия, при которых
Он помещал между кристаллами урана и фотопластинкой разные вещества – бумагу, стекло, пластинки алюминия, меди, свинца разной толщины и всё это освещал солнцем.
Слайд 7Он получил, что результаты всех прежних опытов никак не были связаны
имело значение лишь то, как долго урановая соль находилась вблизи фотопластинки.
Слайд 8
Неизвестное невидимое излучение, которое самопроизвольно испускал уран назвали радиоактивным.
Слайд 10Когда в руках исследователей появились мощные источники радиации, в миллионы раз
(это были препараты радия, полония, актиния),
можно было более подробно ознакомиться со свойствами радиоактивного излучения.
В первых исследованиях на эту тему самое активное участие приняли
Эрнест Резерфорд,
супруги Мария и Пьер Кюри.
Слайд 11Мария Склодовская-Кюри и Пьер Кюри.
Полоний
Радий (лучистый)
Радий – редкий
Слайд 13Эрнест Резерфорд и
Фредерик Содди.
Экспериментируя с торием обнаружили новое радиоактивное вещество
Слайд 15
В 1899 г. группа учёных под руководством Эрнеста Резерфорда экспериментально обнаружила,
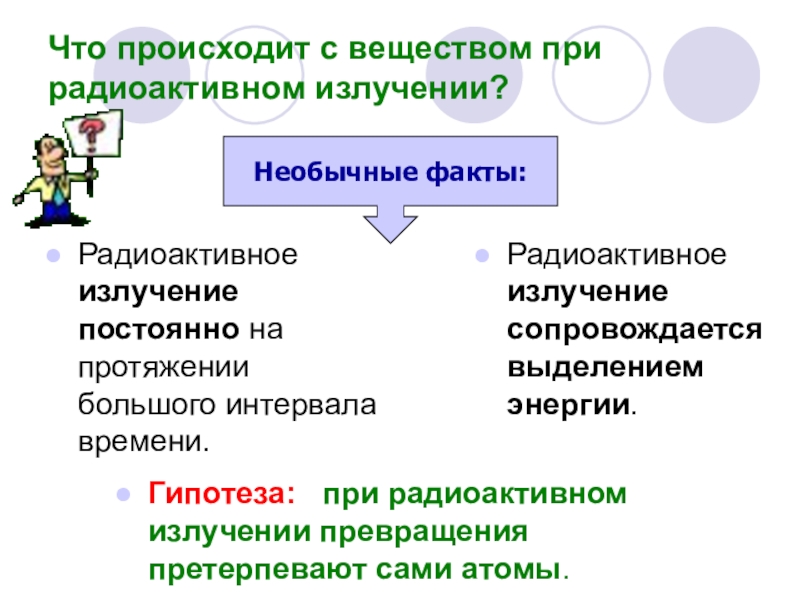
Слайд 16Что происходит с веществом при радиоактивном излучении?
Радиоактивное излучение сопровождается выделением энергии.
Радиоактивное
Необычные факты:
Гипотеза: при радиоактивном излучении превращения претерпевают сами атомы.
Слайд 17 Вывод, сформулированный
Атомы радиоактивного вещества подвержены спонтанным видоизменениям.
В каждый момент небольшая часть атомов становится неустойчивой и взрывообразно распадается.
При этом выбрасывается с огромной скоростью альфа-частица или электрон – бета – частица.
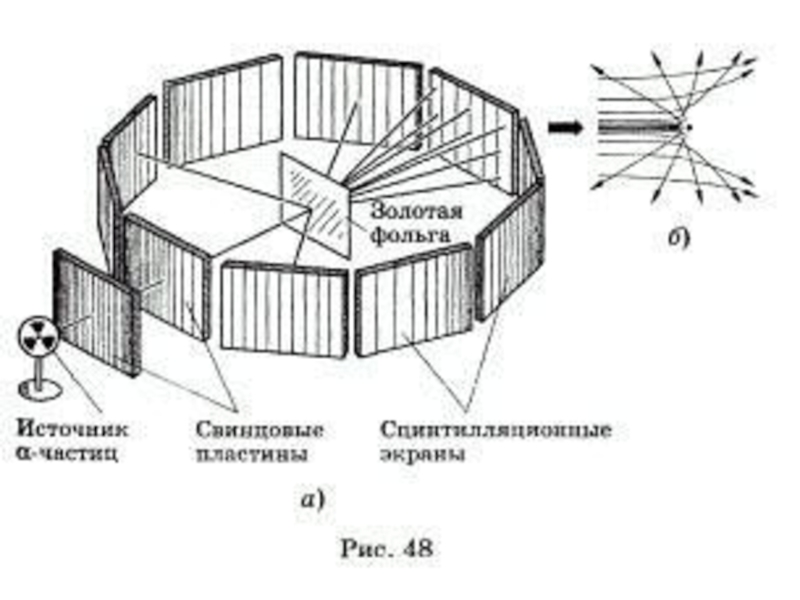
Слайд 18Эксперимент, доказывающий,
что атом имеет сложный состав:
Толстостенный свинцовый сосуд с
Пучок радиоактивного излучения радия выходит из узкого отверстия и попадает на фотопластинку.
Слайд 19 Пьер Кюри обнаружил, что при действии магнитного поля на излучение
Было известно, что магнитное поле отклоняет только заряженные летящие частицы, причем положительные и отрицательные в разные стороны.
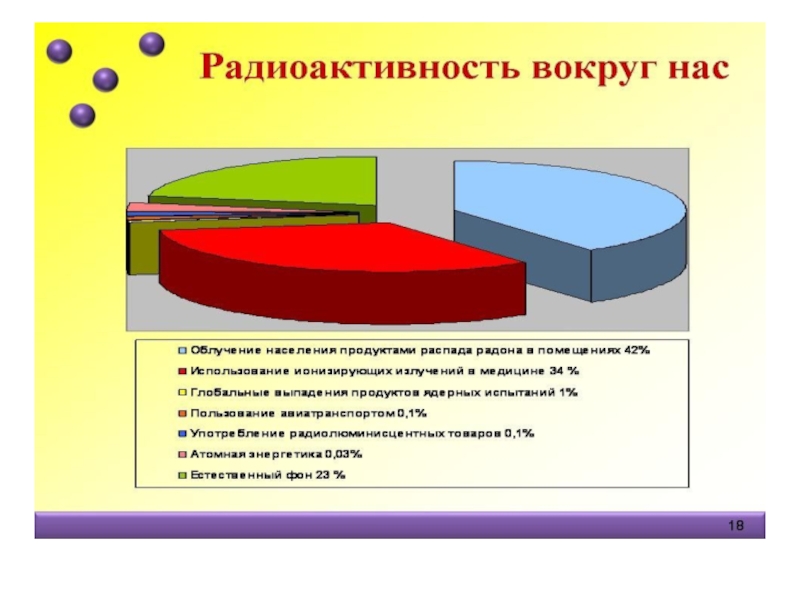
Слайд 23Можно погибнуть от невидимого
Основные источники радиации:
Космические тела
Недра Земли
Рентгеновские препараты
Телевизор и т.п.
Тело
0,01г радиоактивного калия
период распада
4000 делений в секунду
Обозначение радиации
Слайд 26Модель атома Томсона
Джозеф Джон Томсон
(1856 – 1940)
Атом представляет собой непрерывно заряженный
Недостатки модели:
не объясняла дискретный характер излучения атома и его устойчивость;
не дает возможности понять, что определяет размеры атомов;
оказалась в полном противоречии с опытами по исследованию распределения положительного заряда в атоме (опыты, проводимые Эрнестом Резерфордом).
Слайд 28Эрнест Резерфорд
(30 августа 1871 г. – 19 октября 1937
считается величайшим
физиком-экспериментатором
двадцатого столетия.
Он является центральной
фигурой в наших познаниях в области
радиоактивности, а также человеком,
который положил начало ядерной физике.
Помимо теоретического
значения его открытия получили широкий спектр
применения, включая:
ядерное оружие, атомные электростанции,
радиоактивные исчисления и
исследования радиации.
Слайд 29Эрнест Резерфорд
Родился в семье колесного мастера Джеймса Резерфорда и его
Кроме Эрнеста в семье
было еще 6 сыновей
и 5 дочерей.
Слайд 30 В Новой Зеландии в 1889 году он поступил в Кентерберийский
и оставался на этом посту
до конца жизни.
Слайд 31 Одно из первых открытий Резерфорда заключалось в том, что радиоактивное
и третий компонент, который
назвал гамма-лучами.
Слайд 32Открытие Резерфорда также привело к появлению новой ветви науки: изучение атомного
Слайд 33Почти до конца жизни он отличался крепким здоровьем и умер в
Слайд 34Личность Резерфорда постоянно поражала всех, кто с ним встречался. Он был
Немногие ученые стали
бы возражать против
этого утверждения.
Слайд 37Резерфорд обнаружил, что некоторые альфа-частицы, проходя сквозь золотую фольгу, отклоняются очень
Слайд 39Атомное ядро – тело малых размеров, в котором сконцентрированы почти вся
Диаметр ядра порядка 10-12 – 10-13 см.
В атоме водорода вокруг ядра обращается всего один электрон. Ядро водорода было названо протоном.
mp = 1836,1·me
Размер атома – это радиус орбиты его электрона.
Слайд 40Недостатки атома Резерфорда
Эта модель не согласуется с наблюдаемой стабильностью атомов. По
Эта модель не объясняет наблюдаемые на опыте оптические спектры атомов. Оптические спектры атомов не непрерывны, как это следует из теории Резерфорда, а состоят из узких спектральных линий, т.е. атомы излучают и поглощают электромагнитные волны лишь определенных частот, характерных для данного химического элемента.
К явлениям атомных масштабов законы классической физики неприемлемы.
Слайд 41Постулаты Бора
Нильс Бор
1885-1962
атомная система может находится только в особых стационарных, или
В стационарном состоянии
атом не излучает.
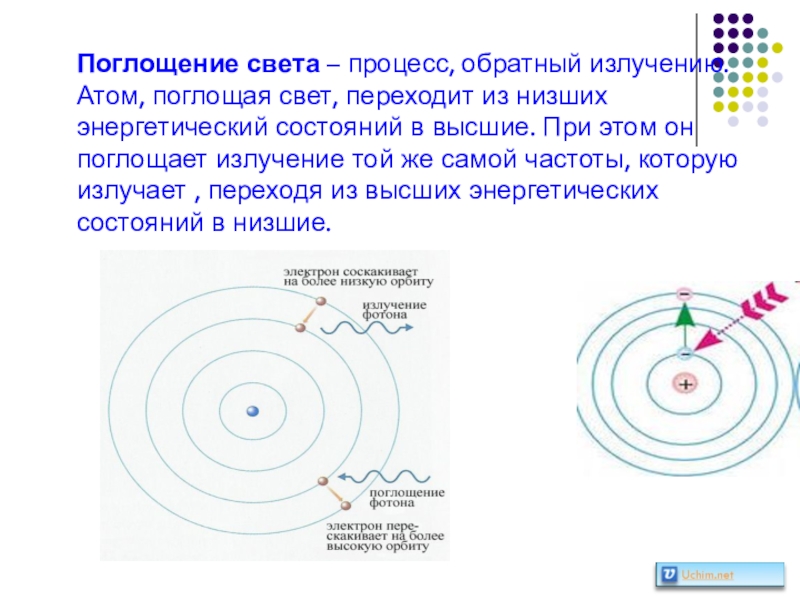
Слайд 42Второй постулат Бора:
излучение света происходит при переходе атома
из стационарного
энергией Ek в стационарное состояние
с меньшей энергией En.
Энергия излученного фотона равна
разности энергий стационарных
состояний.
Слайд 43Поглощение света – процесс, обратный излучению.
Атом, поглощая свет, переходит из низших
Слайд 45Атомные частицы и их свойства
Атом состоит из трёх видов частиц:
Электрон -
Протон – (р)- заряд положительный . q = 1,6 . 10-19Кл, . Масса mр = 1840 mе
Нейтрон –(n)- не заряжен, . Масса mn≈ mр
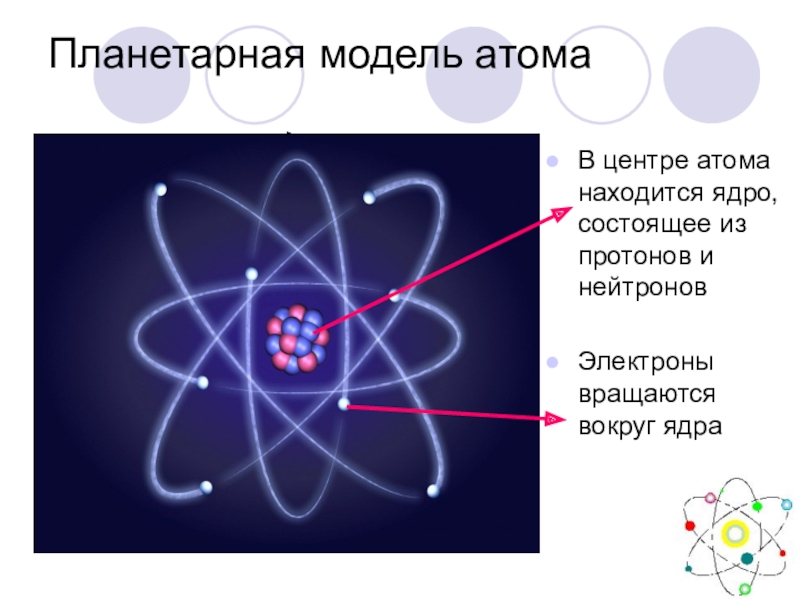
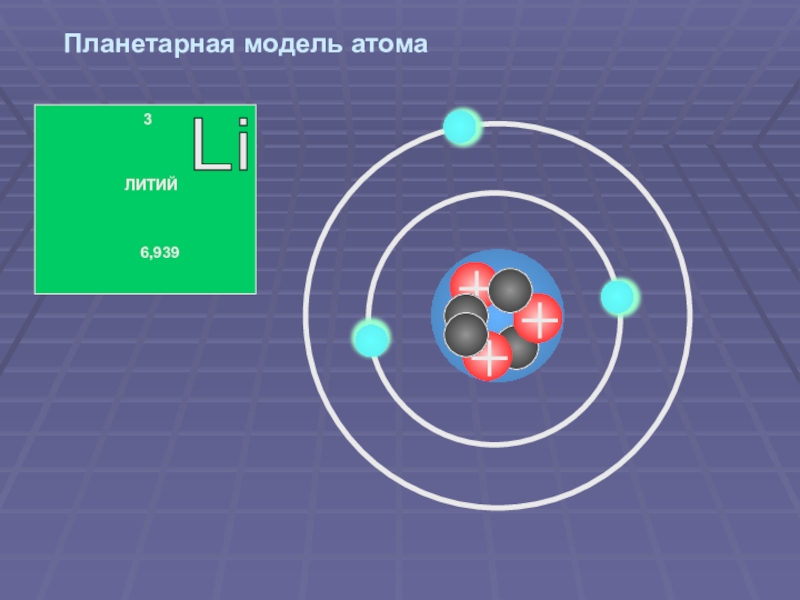
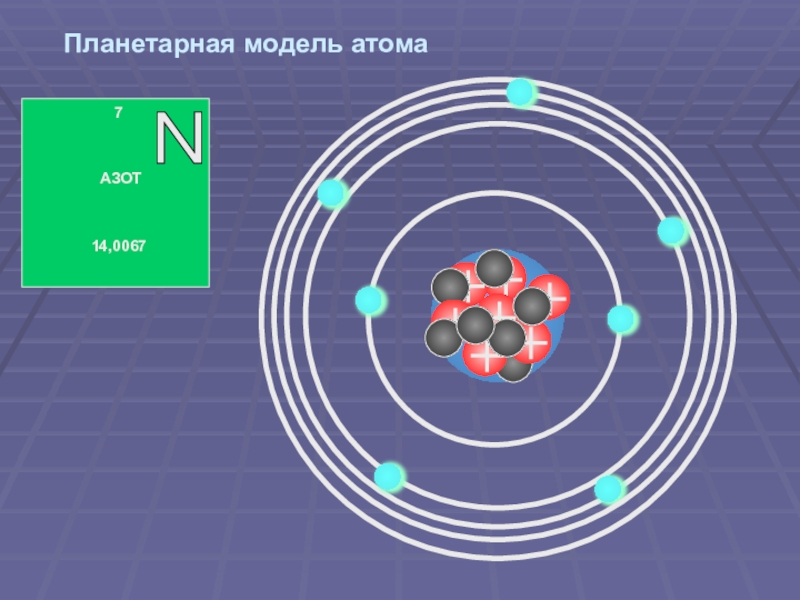
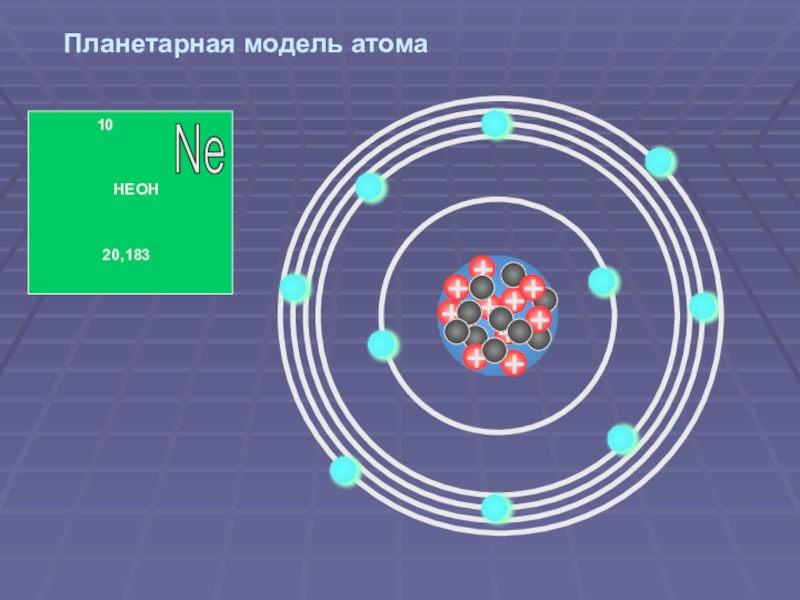
Слайд 47Планетарная модель атома
В центре атома находится ядро, состоящее из протонов и
Электроны вращаются вокруг ядра
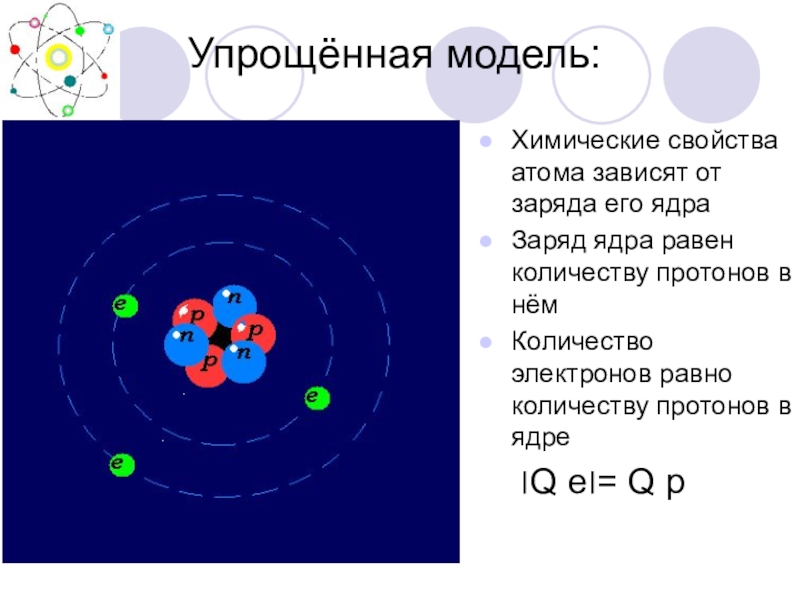
Слайд 48 Упрощённая модель:
Химические свойства атома зависят
Заряд ядра равен количеству протонов в нём
Количество электронов равно количеству протонов в ядре
׀Q е׀= Q p
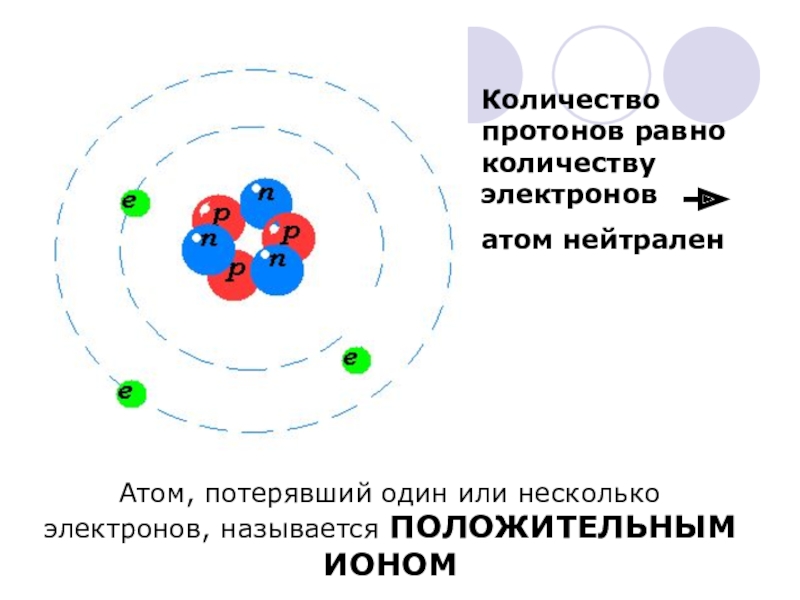
Слайд 49Количество протонов равно количеству электронов
атом нейтрален
Атом, потерявший один или несколько электронов,
Слайд 50Как образуется отрицательный ион?
Протон очень прочно связан с ядром, для его
Атом, захвативший один или несколько лишних электронов, называется отрицательным ионом
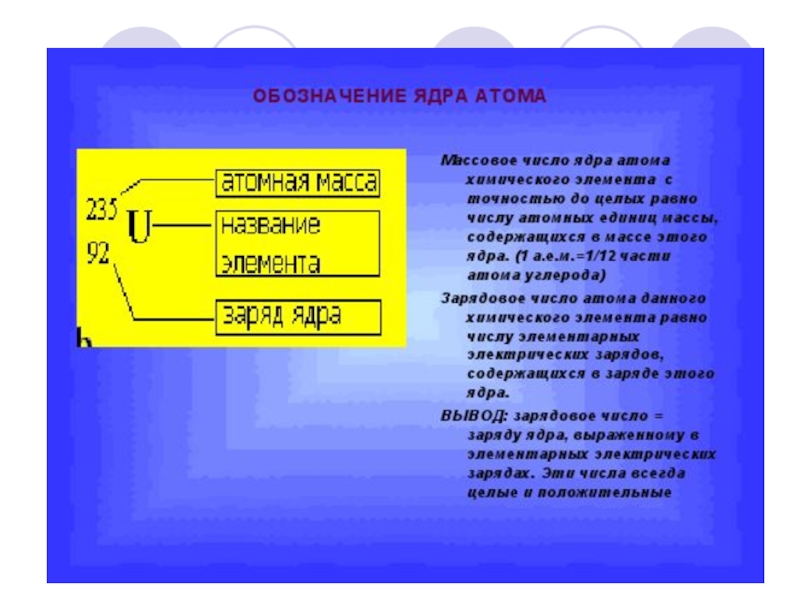
Слайд 51Введём обозначения:
МZ Х или АZ Х
Z – заряд ядра( количество протонов,
N - количество нейтронов
(М) А – атомная масса ядра ( количество нуклонов – протонов и нейтронов )
А = N + Zр
Слайд 65
Обозначения частиц,
часто встречающихся радиоактивных превращениях:
42 Не – альфа – частица.
0-1
0+1 е – позитрон.
11 Н – протон.
10 n – нейтрон.
0 0γ - гамма излучение
Схема
радиоактивного распада:
Неустойчивый атом – Х.
Взрывообразно
распадается.
чаще бета-частица и гамма – луч.
Альфа-частица.
Х
У
Слайд 67
Реакция альфа – распада:
22688 Ra 22286 Rn
Радий превратился в радон, при этом выделяется одна альфа – частица.
Слайд 70При радиоактивном распаде происходит цепочка последовательных превращений атомов и при этом
Слайд 71Альберт Эйнштейн сравнил открытие радиоактивности с открытием огня, так как считал,
Слайд 72Решение задач
Задача 1: Изотоп тория Th - 230 испускает α-частицу. Какой
Задача 2: Изотоп тория Th- 230 β-радиоактивен. Какой элемент при этом образуется?
Задача 3 : В какой элемент превращения уран U - 239 после двух β – распадов и одного α – распада?
Задача 4 : Ядро изотопа урана U - 235 испытав серию α – и β – распадов, превратилось в ядро висмута Bi - 211 Определите число α – и β – распадов.
Слайд 73Подведение итогов
Как переводится слово радиоактивность?
Кто из ученых открыл явление радиоактивности?
Имя
Что находиться в центре атома?
Как по другому можно назвать протоны и нейтроны?
Что представляют собой α-лучи?
Что представляют собой β-лучи?
Что представляет собой γ-излучение?
Сформулируйте правила смещения Содди
Слайд 74Домашнее задание
§ 65, 66, 67, 71, читать, отвечать на вопросы.
Упр. 51
Упр. 53 ( 1,2, 4, 5)