- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на тему Строение твердых тел
Содержание
- 1. Презентация по физике на тему Строение твердых тел
- 2. Цели урока Образовательные:познакомить
- 3. Твердые телаСохраняют объём и формуПлохо сжимаютсяПлохо растягиваютсяИмеют дальний порядок в расположении частиц
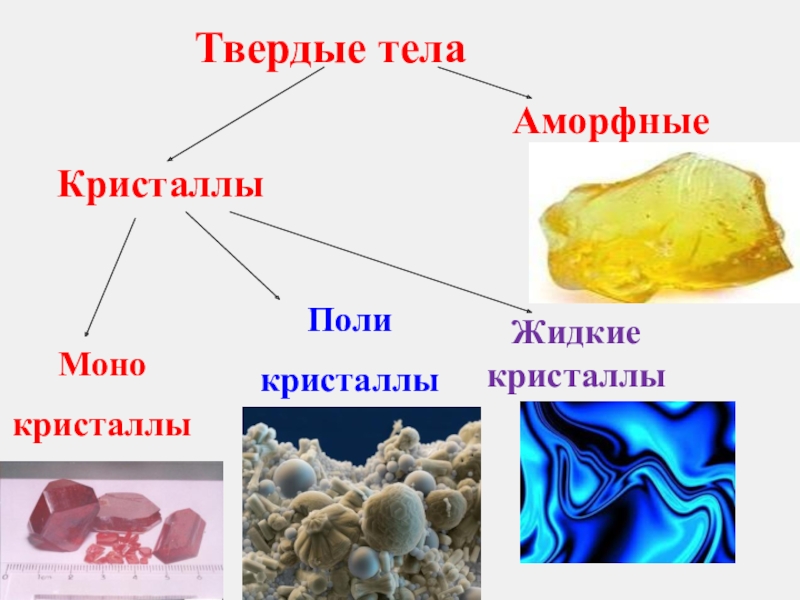
- 4. КристаллыМонокристаллыПоликристаллыЖидкие кристаллыТвердые телаАморфные
- 5. Монокристаллы (кристаллиты)Твердые тела, иногда обладающие правильной геометрической
- 6. Монокристаллы (кристаллиты)В кристаллитах элементарные ячейки одинаковы как
- 7. Монокристаллы (кристаллиты)В кристаллитах соблюдаются ближний и дальний
- 8. Монокристаллы (кристаллиты)Огромное разнообразие кристаллических решеток подразделено на 7 больших систем, называемых СИНГОНИЯМИ (по геометрической форме кристаллов)
- 9. ПоликристаллыТвердые тела, состоящие из отдельных, беспорядочно расположенных,
- 10. Виды кристаллических решетокИонные кристаллические решетки: в узлах
- 11. Виды кристаллических решетокАтомная кристаллическая решетка: в узлах
- 12. Сравнительная характеристикаНеобычайно твердыйПрозрачныйНе проводит электрический ток (диэлектрик)Имеет
- 13. Виды кристаллических решетокМолекулярная кристаллическая решетка: в узлах
- 14. Виды кристаллических решетокМеталлическая кристаллическая решетка: в узлах
- 15. Виды кристаллических решетокМеталлическая кристаллическая решетка:Обладают все металлы--
- 16. Виды кристаллических решетокОсновные типы кристаллических решеток металловкубическая(1
- 17. ПолиморфизмОдно и то же вещество, кристаллизуясь в
- 18. Дефекты кристаллической решеткиИдеальный кристалл может существовать только
- 19. Дефекты кристаллической решетки Точечные дефекты охватывают один-два структурных
- 20. Дефекты кристаллической решетки
- 21. Дефекты кристаллической решетки3) посторонние атомы – примеси
- 22. Дефекты кристаллической решетки
- 23. В идеальной структуре
- 24. Лишний атом, для которого нет соответствующего
- 25. Модель образования вакансии в простых веществах Можно предложить
- 26. Атома нет в соответствующем узле,
- 27. Дефекты кристаллической решеткиЛинейные дефекты имеют длину, значительно превышающую
- 28. Дефекты кристаллической решеткиКраевая дислокация – обрыв плоскости атомовВинтовая дислокация - взаимный сдвиг плоскостей
- 29. Дефекты кристаллической решеткиКраевая дислокация – обрыв плоскости атомовВинтовая дислокация - взаимный сдвиг плоскостей
- 30. Дефекты кристаллической решетки Поверхностные дефекты включают в себя главным
- 31. Дефекты кристаллической решетки Объемные дефекты кристаллической решетки включают трещины
- 32. Жидкие кристаллыЖи́дкие криста́ллы — это фазовое состояние, в
- 33. Жидкие кристаллыПо своим общим свойствам ЖК можно
- 34. Жидкие кристаллыТермотропные ЖК подразделяются на три больших класса:
- 35. Нематические жидкие кристаллыВ этих кристаллах отсутствует дальний
- 36. Смектические жидкие кристаллыКристаллы имеют слоистую структуру Толщина
- 37. Холестерические жидкие кристаллы Образуются, в основном, соединениями
- 38. Аморфными называются вещества,
- 39. Аморфные тела Не имеют кристаллической решетки Не
- 40. Домашнее заданиеФ.10 §72 ответить на вопросы к параграфу
Слайд 1Строение твердых тел
Презентация разработана преподавателем КС и ПТ Каракашевой И.В.
Санкт –
2016
Слайд 2Цели урока
Образовательные:
познакомить учащихся со строением твердых
обеспечить усвоение понятий, связанных с отличиями в строении вещества;
актуализировать знания о строении вещества;
расширить общий кругозор учащихся
Развивающие:
создать условия для развития коммуникативных навыков;
создать условия для развития аналитических способностей учащихся, умения анализировать, сопоставлять, сравнивать , обобщать, делать выводы;
создать условия для развития памяти, внимания, воображения
Воспитательные:
способствовать развитию умения отстаивать свою точку зрения;
способствовать развитию культуры взаимоотношений при работе в коллективе
Слайд 3Твердые тела
Сохраняют объём и форму
Плохо сжимаются
Плохо растягиваются
Имеют дальний порядок в расположении
Слайд 5Монокристаллы (кристаллиты)
Твердые тела, иногда обладающие правильной геометрической формой.
Главный признак: периодически повторяющаяся
Основное свойство: анизотропия, т.е. различие свойств кристалла по разным направлениям
Кристаллической решеткой называется пространственная сетка, узлы которой(точки, соответствующие наиболее устойчивому положению равновесия частиц) совпадают с центрами атомов или молекул
Слайд 6Монокристаллы (кристаллиты)
В кристаллитах элементарные ячейки одинаковы как у окружающих данный атом
Типичная (повторяющаяся вдоль любой прямой) часть кристаллической решетки называется элементарной ячейкой.
Слайд 7Монокристаллы (кристаллиты)
В кристаллитах соблюдаются ближний и дальний порядки.
Вследствие диффузии отдельные атомы могут
Расположение атомов в кристаллическом (а) и аморфном (б) веществе
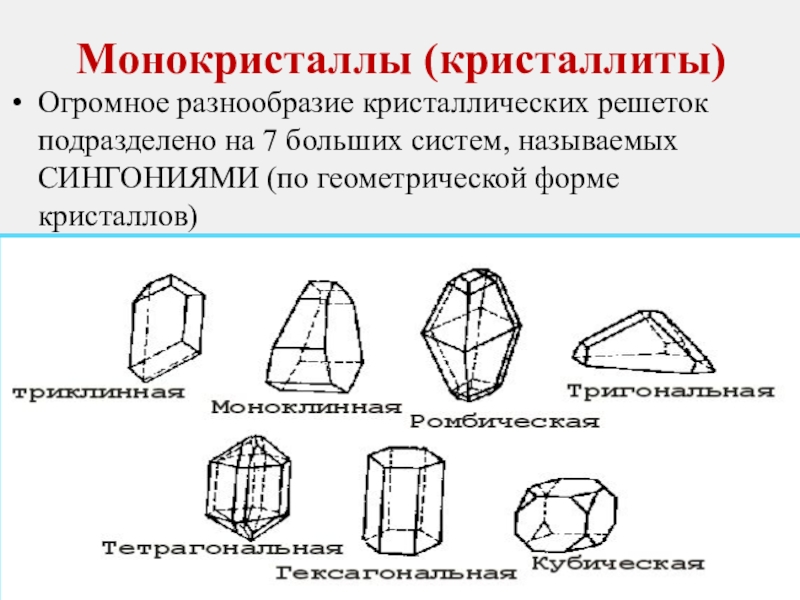
Слайд 8Монокристаллы (кристаллиты)
Огромное разнообразие кристаллических решеток подразделено на 7 больших систем, называемых
Слайд 9Поликристаллы
Твердые тела, состоящие из отдельных, беспорядочно расположенных, сросшихся между собой зерен-кристаллитов.
В
Поликристаллы изотропны, т.е. имеют одинаковые свойства по всем направлениям.
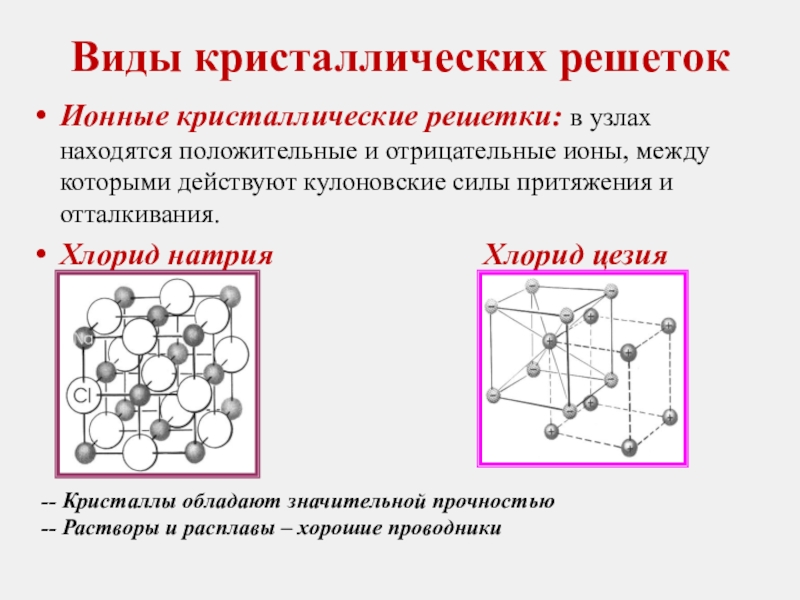
Слайд 10Виды кристаллических решеток
Ионные кристаллические решетки: в узлах находятся положительные и отрицательные
Хлорид натрия Хлорид цезия
-- Кристаллы обладают значительной прочностью
-- Растворы и расплавы – хорошие проводники
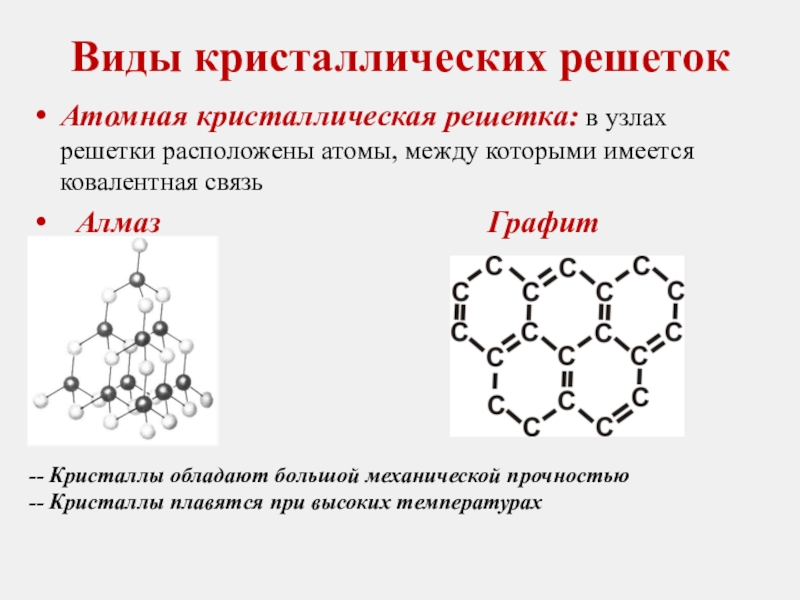
Слайд 11Виды кристаллических решеток
Атомная кристаллическая решетка: в узлах решетки расположены атомы, между
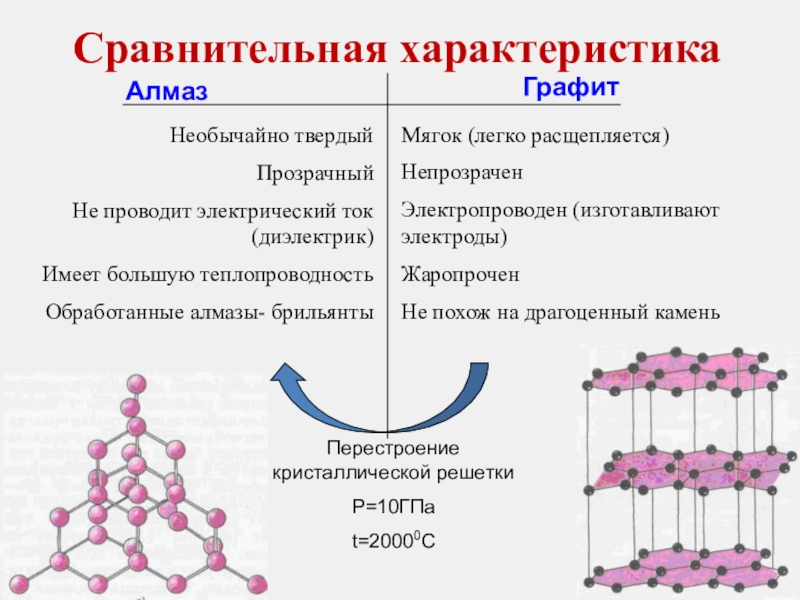
Алмаз Графит
-- Кристаллы обладают большой механической прочностью
-- Кристаллы плавятся при высоких температурах
Слайд 12Сравнительная характеристика
Необычайно твердый
Прозрачный
Не проводит электрический ток (диэлектрик)
Имеет большую теплопроводность
Мягок (легко расщепляется)
Непрозрачен
Электропроводен (изготавливают электроды)
Жаропрочен
Не похож на драгоценный камень
Перестроение кристаллической решетки
P=10ГПа
t=20000С
Алмаз
Графит
Слайд 13Виды кристаллических решеток
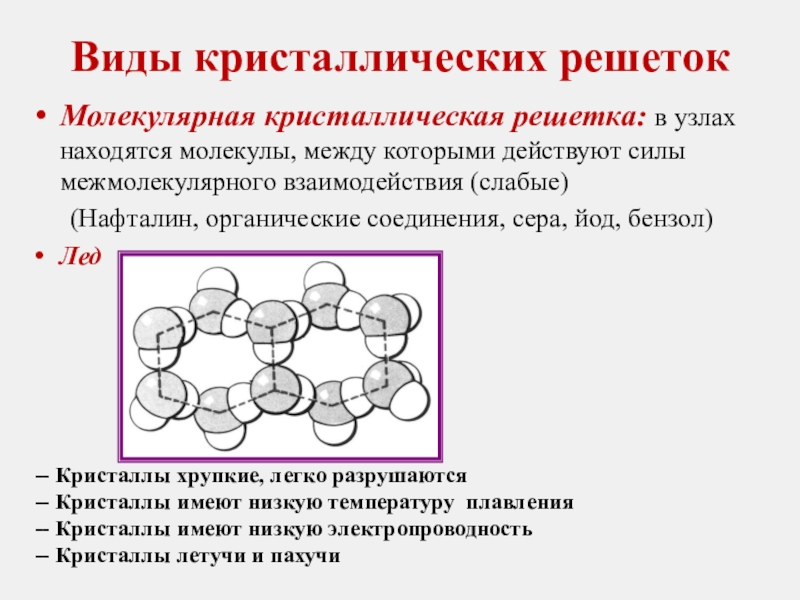
Молекулярная кристаллическая решетка: в узлах находятся молекулы, между которыми
(Нафталин, органические соединения, сера, йод, бензол)
Лед
-- Кристаллы хрупкие, легко разрушаются
-- Кристаллы имеют низкую температуру плавления
-- Кристаллы имеют низкую электропроводность
-- Кристаллы летучи и пахучи
Слайд 14Виды кристаллических решеток
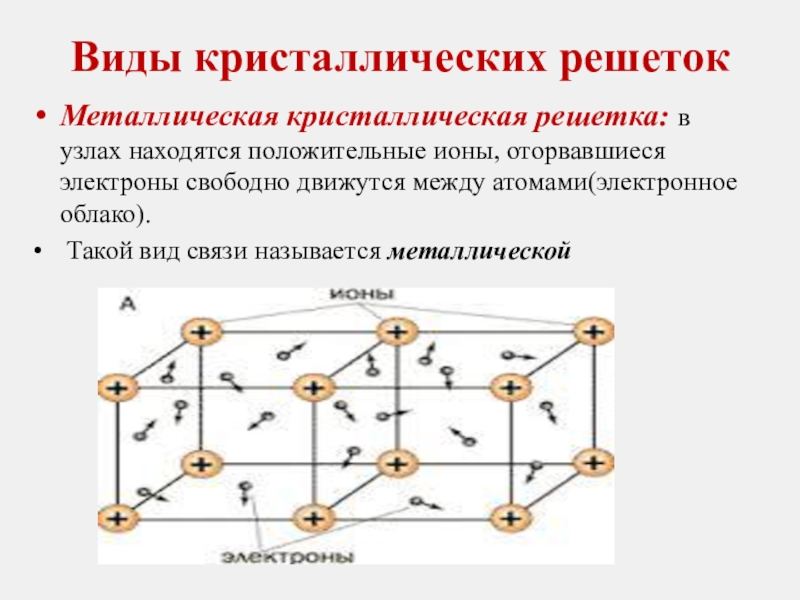
Металлическая кристаллическая решетка: в узлах находятся положительные ионы, оторвавшиеся
Такой вид связи называется металлической
Слайд 15Виды кристаллических решеток
Металлическая кристаллическая решетка:
Обладают все металлы
-- Кристаллы обладают большой прочностью
-- Кристаллы обладают высокой электропроводностью
Слайд 16Виды кристаллических решеток
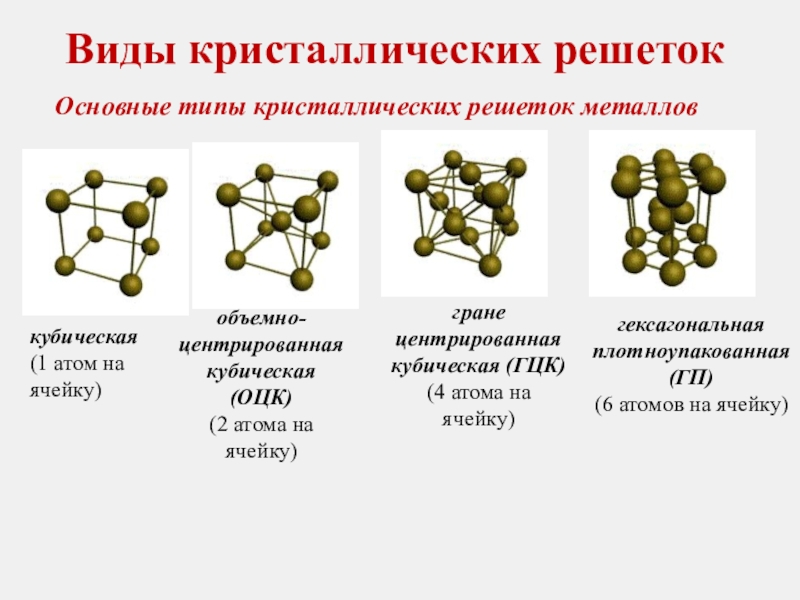
Основные типы кристаллических решеток металлов
кубическая
(1 атом на ячейку)
объемно-центрированная кубическая
(2 атома на ячейку)
гране
центрированная кубическая (ГЦК)
(4 атома на ячейку)
гексагональная плотноупакованная (ГП)
(6 атомов на ячейку)
Слайд 17Полиморфизм
Одно и то же вещество, кристаллизуясь в различных условиях, может образовать
Полиморфизм простых элементов называют аллотропией.
Слайд 18Дефекты кристаллической решетки
Идеальный кристалл может существовать только при температуре абсолютного нуля.
При любых других температурах все реальные кристаллы несовершенны, т.е. в них наблюдаются нарушения идеального расположения атомов, называемые дефектами.
Основные виды дефектов
Точечные
Линейные
Поверхностные
Объемные
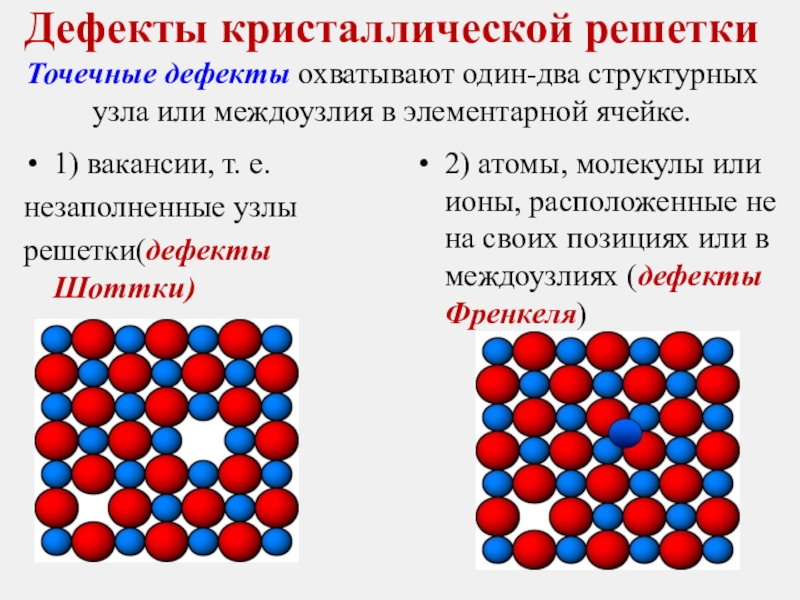
Слайд 19Дефекты кристаллической решетки Точечные дефекты охватывают один-два структурных узла или междоузлия в элементарной
1) вакансии, т. е.
незаполненные узлы
решетки(дефекты Шоттки)
2) атомы, молекулы или ионы, расположенные не на своих позициях или в междоузлиях (дефекты Френкеля)
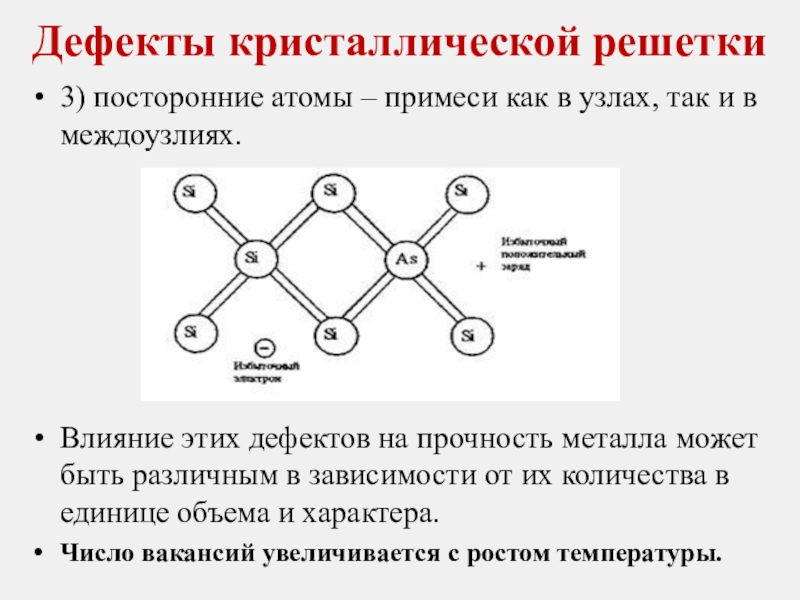
Слайд 21Дефекты кристаллической решетки
3) посторонние атомы – примеси как в узлах, так
Влияние этих дефектов на прочность металла может быть различным в зависимости от их количества в единице объема и характера.
Число вакансий увеличивается с ростом температуры.
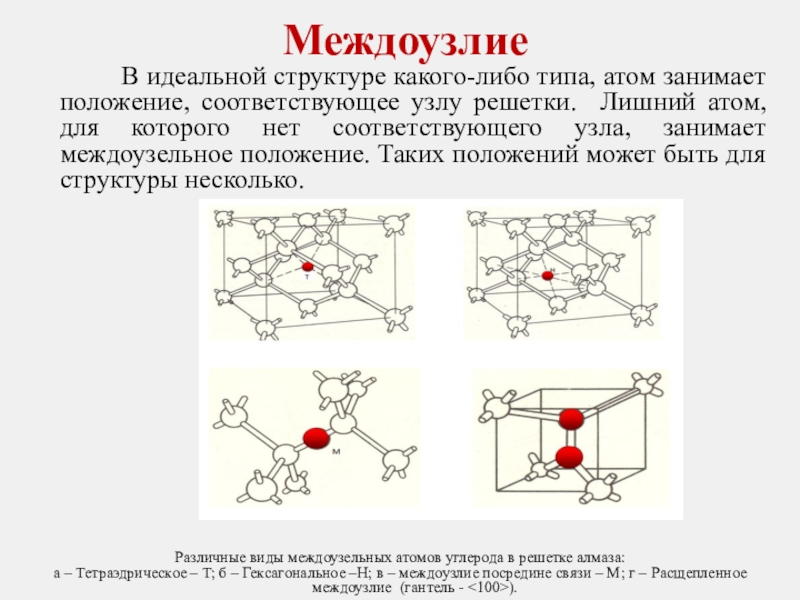
Слайд 23 В идеальной структуре какого-либо типа, атом занимает
Различные виды междоузельных атомов углерода в решетке алмаза:
а – Тетраэдрическое – T; б – Гексагональное –H; в – междоузлие посредине связи – M; г – Расщепленное междоузлие (гантель - <100>).
Междоузлие
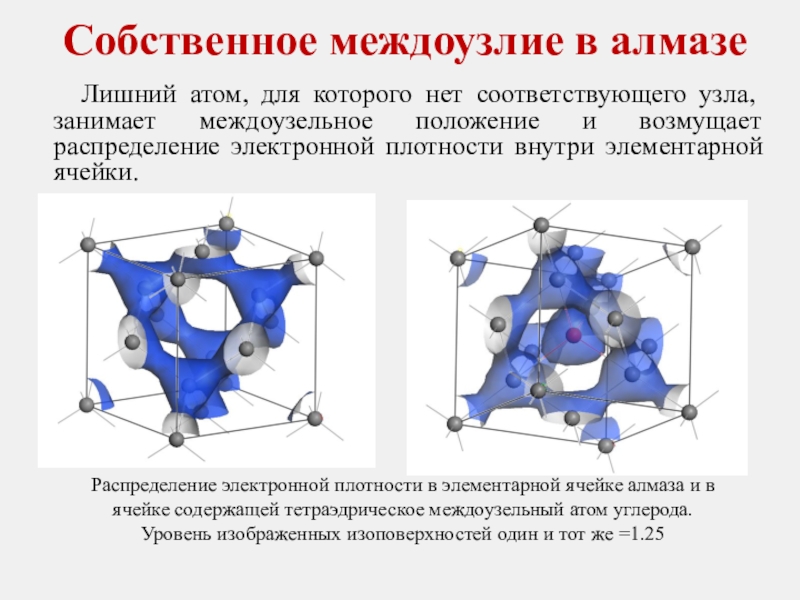
Слайд 24 Лишний атом, для которого нет соответствующего узла, занимает междоузельное положение
Собственное междоузлие в алмазе
Распределение электронной плотности в элементарной ячейке алмаза и в ячейке содержащей тетраэдрическое междоузельный атом углерода.
Уровень изображенных изоповерхностей один и тот же =1.25
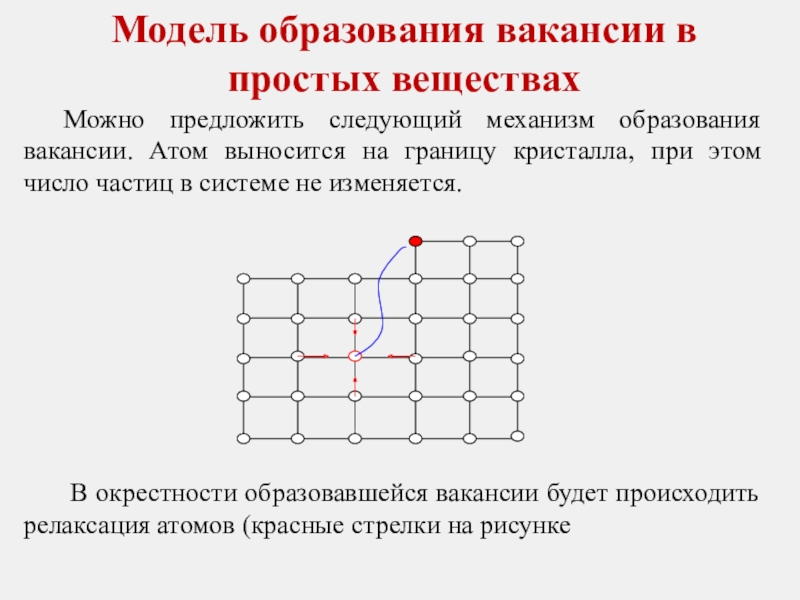
Слайд 25Модель образования вакансии в простых веществах
Можно предложить следующий механизм образования вакансии.
В окрестности образовавшейся вакансии будет происходить релаксация атомов (красные стрелки на рисунке
Слайд 26 Атома нет в соответствующем узле, что приводит к возмущению
Одиночная вакансия в алмазе
Распределение электронной плотности в идеальной элементарной ячейке алмаза и в ячейке содержащей одиночную вакансию.
Уровень изображенных изоповерхностей один и тот же =1.25
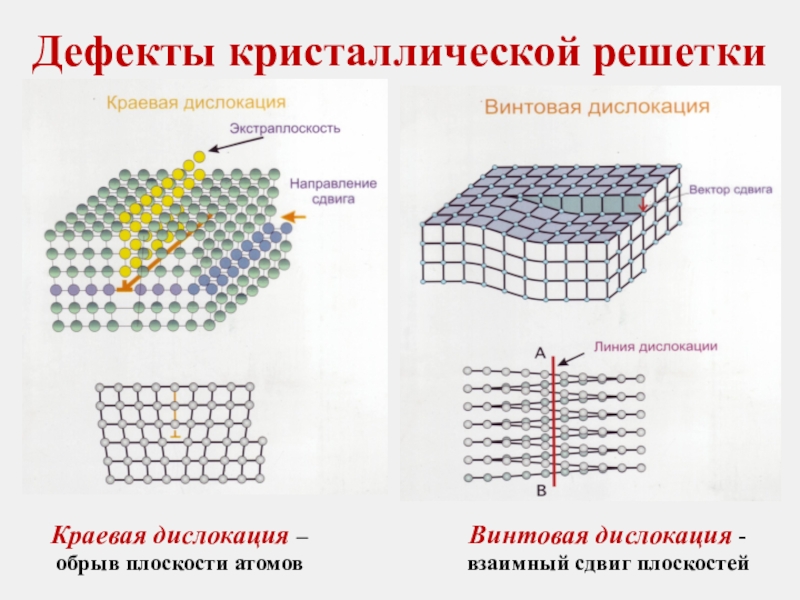
Слайд 27Дефекты кристаллической решетки
Линейные дефекты имеют длину, значительно превышающую их поперечные размеры.
К
Дислокации обладают высокой подвижностью, поэтому существенно уменьшают прочность металла
Максимальная плотность дислокаций, может составить 1013 см-2. При дальнейшем росте плотности дислокаций происходит разрушение металла.
Слайд 28Дефекты кристаллической решетки
Краевая дислокация –
обрыв плоскости атомов
Винтовая дислокация - взаимный
Слайд 29Дефекты кристаллической решетки
Краевая дислокация –
обрыв плоскости атомов
Винтовая дислокация - взаимный
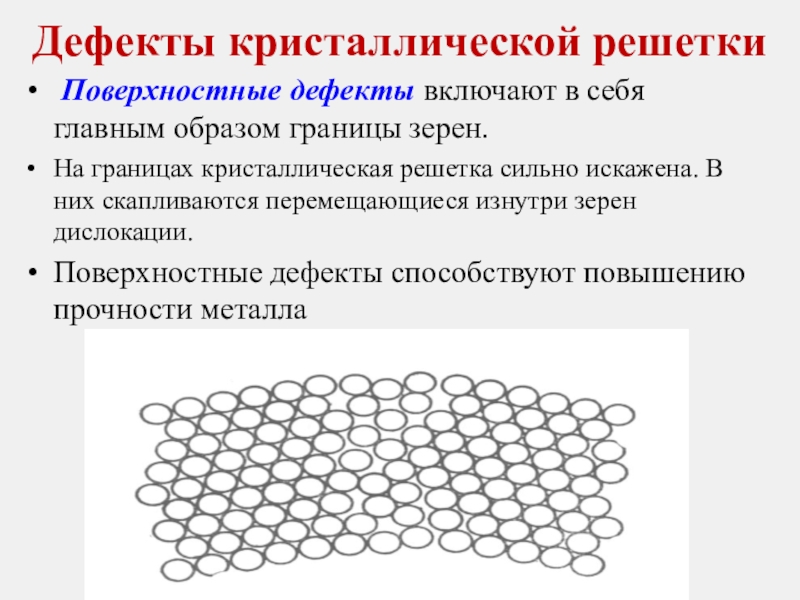
Слайд 30Дефекты кристаллической решетки
Поверхностные дефекты включают в себя главным образом границы зерен.
На
Поверхностные дефекты способствуют повышению прочности металла
Слайд 31Дефекты кристаллической решетки
Объемные дефекты кристаллической решетки включают трещины и поры.
Уменьшают плотность
Трещины являются сильными концентраторами напряжений, в десятки и более раз повышающими напряжения создаваемые в металле рабочими нагрузками. Последнее обстоятельство наиболее существенно влияет на прочность металла.
Слайд 32Жидкие кристаллы
Жи́дкие криста́ллы — это фазовое состояние, в которое переходят некоторые вещества
Жидкие кристаллы обладают одновременно свойствами как жидкостей (текучесть), так и кристаллов (анизотропия).
По структуре ЖК представляют собой вязкие жидкости, состоящие из молекул вытянутой или дискообразной формы, определённым образом упорядоченных во всем объёме этой жидкости.
Характерное свойство ЖК - способность изменять ориентацию молекул под воздействием электрических полей.
Жидкие кристаллы открыл в 1888 году австрийский ботаник Ф. Рейнитцер
Слайд 33Жидкие кристаллы
По своим общим свойствам ЖК можно разделить на две большие
термотропные ЖК, образующиеся в результате нагревания твердого вещества и существующие в определенном интервале температур и давлений.
лиотропные ЖК, которые представляют собой двух- или более компонентные системы, образующиеся в смесях стержневидных молекул данного вещества и воды (или других полярных растворителей). Эти стержневидные молекулы имеют на одном конце полярную группу, а большая часть стержня представляет собой гибкую гидрофобную углеводородную цепь. Такие вещества называются амфифилами (например, фосфолипиды)
Амфифильные молекулы, как правило, плохо растворяются в воде ( одним из вариантов амфифилов со сложной структурой может служить система мыло-вода)
Слайд 35Нематические жидкие кристаллы
В этих кристаллах отсутствует дальний порядок в расположении центров
У них нет слоистой структуры,
Их молекулы скользят непрерывно в направлении своих длинных осей, вращаясь вокруг них, но при этом сохраняют ориентационный порядок: длинные оси направлены вдоль одного преимущественного направления.
Они ведут себя подобно обычным жидкостям.
Нематические фазы встречаются только в таких веществах, у молекул которых нет различия между правой и левой формами.
Слайд 36Смектические жидкие кристаллы
Кристаллы имеют слоистую структуру
Толщина смектического слоя определяется длиной
Вязкость смектиков значительно выше, чем у нематиков, и плотность по нормали к поверхности слоя может сильно меняться
Слайд 37Холестерические жидкие кристаллы
Образуются, в основном, соединениями холестерина и других стероидов.
Это нематические ЖК, но их длинные оси повернуты друг относительно друга так, что они образуют спирали, очень чувствительные к изменению
Холестерики ярко окрашены
Малейшее изменение температуры (до тысячных долей градуса) приводит к изменению шага спирали и, соответственно, к изменению окраски ЖК.
Слайд 38 Аморфными называются вещества, атомы которых расположены в
К ним относят клей, смолу, канифоль, стекло, янтарь и др.
Аморфные тела
Слайд 39Аморфные тела
Не имеют кристаллической решетки
Не имеют температуры плавления
Изотропны
Имеют только ближний порядок
Способны переходить в кристаллическое и жидкое состояние