- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на тему Основы МКТ 10 класс
Содержание
- 1. Презентация по физике на тему Основы МКТ 10 класс
- 2. Молекулярно-кинетическая теория (МКТ) занимается изучением свойств веществ,
- 3. Первое положение МКТВсе вещества состоят из частиц - молекул, атомов и ионов. Строение вещества дискретно
- 4. Второе положение МКТЧастицы вещества беспрерывно и беспорядочно движутся.
- 5. Третье положение МКТЧастицы вещества взаимодействуют друг с другом.
- 6. Размеры и масса молекул.Свойства и поведение тел,
- 7. Размеры и масса молекул.Частицы в жидкости располагаются достаточно плотно (см. рисунок)
- 8. Оценка размеров молекул. Для полной уверенности в
- 9. Объем V слоя масла равен произведению его площади поверхности S на
- 10. На рисунке 8.2 показана микрофотография поверхности кремниевой
- 11. Число молекулПри очень малых размерах молекул число
- 12. В силу того, что массы частиц
- 13. Количество вещества и постоянная АвогадроОдин моль -
- 14. Основные формулыКоличество вещества:Молярная масса вещества:Масса любого вещества:
- 15. Беспорядочное (хаотичное) движение атомов и молекул в
- 16. Броуновское движениеБроуновское движение - это тепловое движение
- 17. Перед вами проблема: предложить опытное обоснование положения о том, что частицы движутся хаотически
- 18. Броуновское движение Броуновские частицы движутся под влиянием
- 19. броуновское движение
- 20. диффузия Явление самопроизвольного проникновения частиц одного вещества
- 21. Силы взаимодействия молекул Молекулы взаимодействуют друг с другом.
- 22. Силы взаимодействия молекул На расстояниях, превышающих 2-3
- 23. Строение газообразных, жидких и твердых тел Газы. В
- 24. Строение вещества а жидком состоянии:Ближний порядок в
- 25. Ближний порядок в расположении частицЭто означает, что
- 26. Строение вещества в твердом состоянии:Определенный порядок в расположении частиц (дальний порядок)Сохраняют форму и объем.
- 27. Жидкие кристаллыЖидкости с дальним порядком расположения частиц
- 28. Аморфные телаТвердые тела, у которых соблюдается только
Молекулярно-кинетическая теория (МКТ) занимается изучением свойств веществ, основываясь при этом на представлениях о частицах вещества.МКТ базируется на трех основных положениях
Слайд 2Молекулярно-кинетическая теория (МКТ) занимается изучением свойств веществ, основываясь при этом на
представлениях о частицах вещества.
МКТ базируется на трех основных положениях
МКТ базируется на трех основных положениях
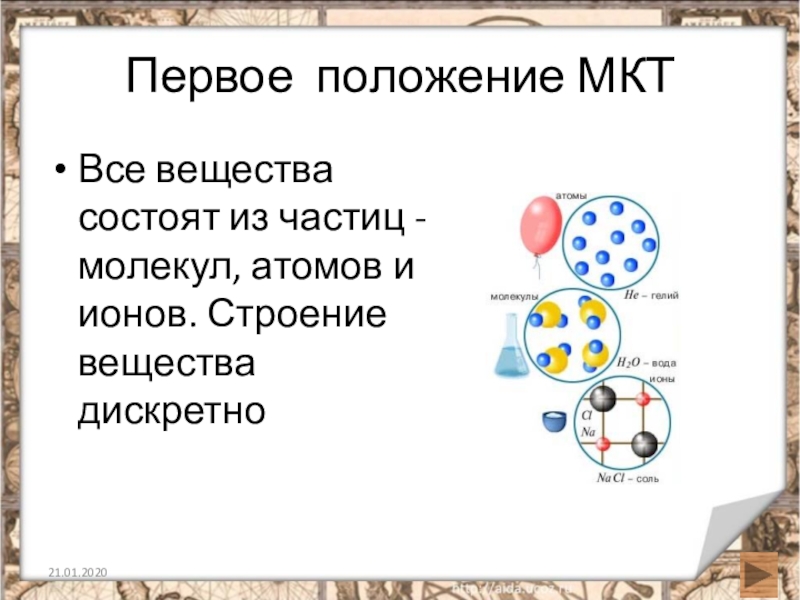
Слайд 3Первое положение МКТ
Все вещества состоят из частиц - молекул, атомов и
ионов. Строение вещества дискретно
Слайд 6Размеры и масса молекул.
Свойства и поведение тел, в процессах передачи и
превращения энергии, определяются движением взаимодействующих друг с другом частиц, из которых состоит тело: атомов, молекул и ионов. Каков размер этих частиц? Как его измерить?
Слайд 8Оценка размеров молекул.
Для полной уверенности в существовании молекул надо определить
их размеры.
Проще всего это сделать, наблюдая расплывание капельки масла, например оливкового, по поверхности воды. Масло никогда не займет всю поверхность, если сосуд велик (рис.8.1). Нельзя заставить капельку объемом 1 мм3 расплыться так, чтобы она заняла площадь поверхности более 0,6 м2.
Слайд 9 Объем V слоя масла равен произведению его площади поверхности S на толщину d слоя, т. е. V=Sd. Следовательно,
размер молекулы оливкового масла равен:
Слайд 10На рисунке 8.2 показана микрофотография поверхности кремниевой пластины, где бугорки -
это отдельные атомы кремния. Подобные изображения впервые научились получать в 1981 г. с помощью не обычных оптических, а сложных туннельных микроскопов.
Слайд 11 Число молекул
При очень малых размерах молекул число их в любом макроскопическом
теле огромно. Подсчитаем примерное число молекул в капле воды массой 1 г и, следовательно, объемом 1 см3.
Диаметр молекулы воды равен примерно 3•10-8 см. Считая, что каждая молекула воды при плотной упаковке молекул занимает объем (3•10-8 см)3, можно найти число молекул в капле, разделив объем капли (1 см3) на объем, приходящийся на одну молекулу:
Слайд 12 В силу того, что массы частиц вещества крайне малы, удобно
пользоваться не абсолютными, а относительными единицами массы. Для этого используется так называемая атомная единица массы (а.е.м.), равная 1/12 массы атома углерода. Массу частицы, измеренную в а.е.м. принято называть относительной атомной (или молекулярной) массой.
Слайд 13Количество вещества и постоянная Авогадро
Один моль - это количество вещества, в
котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.
В 1 моль любого вещества содержится одно и то же число атомов или молекул. Это число атомов обозначают NA и называют постоянной Авогадро в честь итальянского ученого (XIX в.).
В 1 моль любого вещества содержится одно и то же число атомов или молекул. Это число атомов обозначают NA и называют постоянной Авогадро в честь итальянского ученого (XIX в.).
Слайд 15Беспорядочное (хаотичное) движение атомов и молекул в веществе называют тепловым
движением,
потому что скорость движения частиц увеличивается с ростом температуры. Экспериментальным подтверждением непрерывного движения атомов и молекул в веществе является броуновское движение и диффузия
потому что скорость движения частиц увеличивается с ростом температуры. Экспериментальным подтверждением непрерывного движения атомов и молекул в веществе является броуновское движение и диффузия
Слайд 16Броуновское движение
Броуновское движение - это тепловое движение мельчайших частиц, взвешенных в
жидкости или газе. Оно было открыто английским ботаником Броуном (1827 г.)
Слайд 17Перед вами проблема: предложить опытное обоснование положения о том, что частицы
движутся хаотически
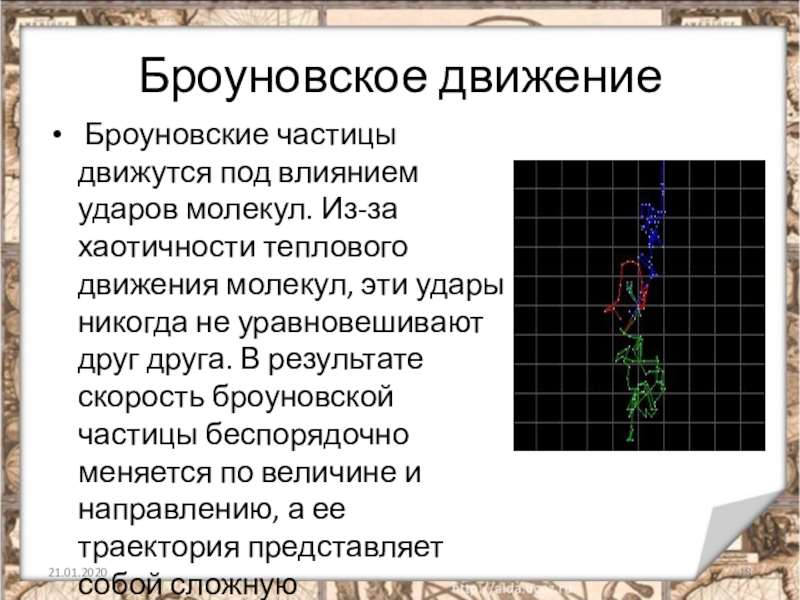
Слайд 18Броуновское движение
Броуновские частицы движутся под влиянием ударов молекул. Из-за хаотичности
теплового движения молекул, эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по величине и направлению, а ее траектория представляет собой сложную зигзагообразную линию.
Слайд 20диффузия
Явление самопроизвольного проникновения частиц одного вещества в другое вещество принято
называть диффузией. При этом вещества перемешиваются.
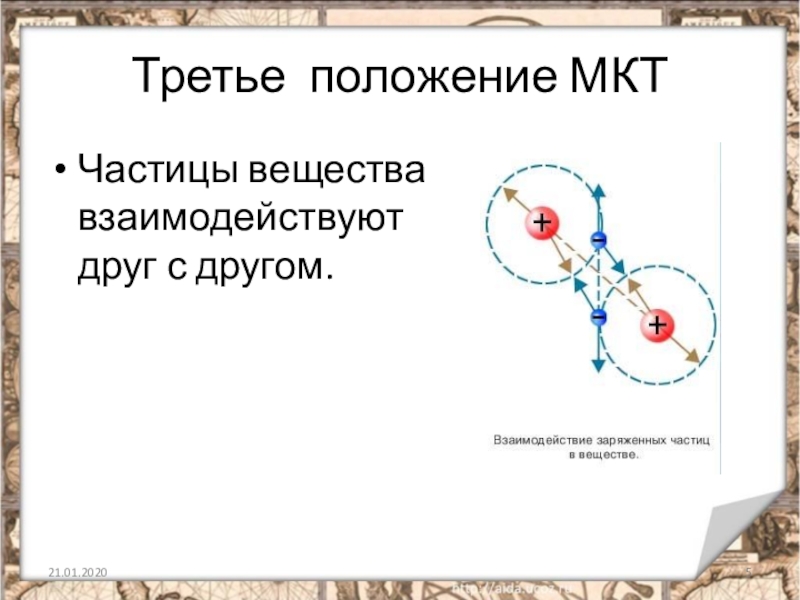
Слайд 21Силы взаимодействия молекул
Молекулы взаимодействуют друг с другом. Без этого взаимодействия не было
бы ни твердых, ни жидких тел.
Если бы между молекулами не существовало бы сил притяжения, то все тела бы находились бы только в газообразном состоянии.
Но одни силы притяжения не могут обеспечить существования устойчивых образований из атомов и молекул. На очень малых расстояниях между молекулами обязательно действуют силы отталкивания. Благодаря этому молекулы не проникают друг в друга и куски вещества никогда не сжимаются до размеров порядка размеров одной молекулы.
Если бы между молекулами не существовало бы сил притяжения, то все тела бы находились бы только в газообразном состоянии.
Но одни силы притяжения не могут обеспечить существования устойчивых образований из атомов и молекул. На очень малых расстояниях между молекулами обязательно действуют силы отталкивания. Благодаря этому молекулы не проникают друг в друга и куски вещества никогда не сжимаются до размеров порядка размеров одной молекулы.
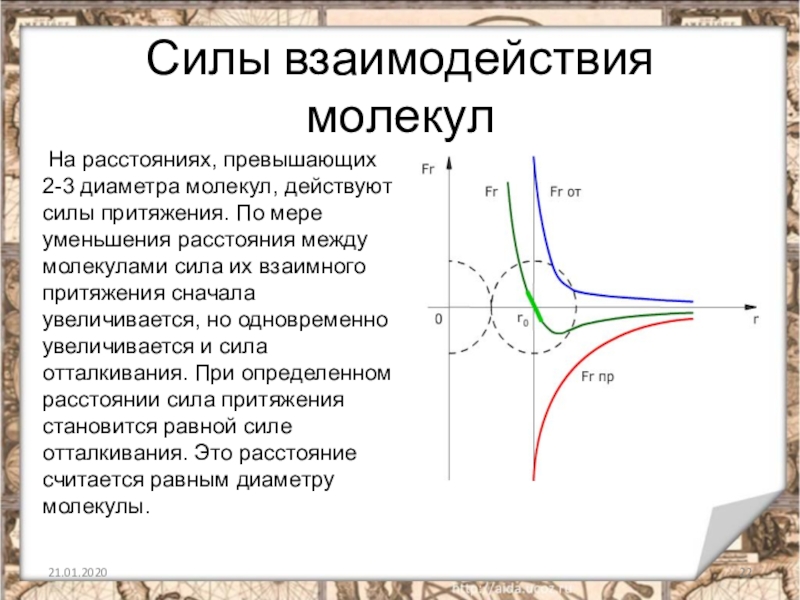
Слайд 22Силы взаимодействия молекул
На расстояниях, превышающих 2-3 диаметра молекул, действуют силы притяжения.
По мере уменьшения расстояния между молекулами сила их взаимного притяжения сначала увеличивается, но одновременно увеличивается и сила отталкивания. При определенном расстоянии сила притяжения становится равной силе отталкивания. Это расстояние считается равным диаметру молекулы.
Слайд 23Строение газообразных, жидких и твердых тел
Газы. В газах расстояние между атомами или
молекулами в среднем во много раз больше размеров самих молекул.
Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
Слайд 24Строение вещества а жидком состоянии:
Ближний порядок в расположении частиц.
Молекулы время от
времени перескакивают из одного оседлого положения в другое. Время оседлой жизни молекулы воды, т. е. время ее колебаний около одного определенного положения равновесия при комнатной температуре, равно в среднем 10-11 с. С повышением температуры время оседлой жизни молекул уменьшается.
Жидкости текучи, т. е. не сохраняют своей формы.
Жидкости текучи, т. е. не сохраняют своей формы.
Слайд 25Ближний порядок в расположении частиц
Это означает, что по отношению к любой
частицы расположение ближайших к ней соседей является упорядоченным, но по мере удаления от данной частицы расположение по отношению к ней других частиц становится все менее упорядоченным.
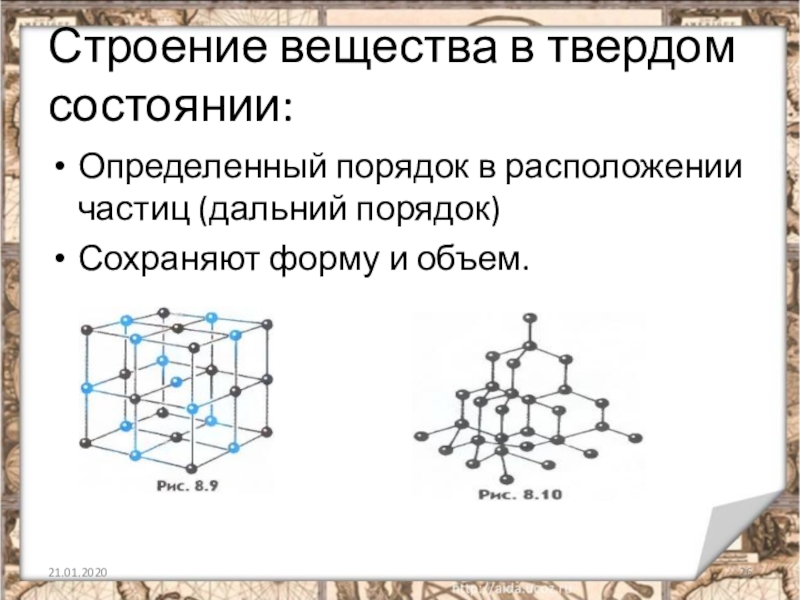
Слайд 26Строение вещества в твердом состоянии:
Определенный порядок в расположении частиц (дальний порядок)
Сохраняют
форму и объем.
Слайд 27Жидкие кристаллы
Жидкости с дальним порядком расположения частиц – жидкие кристаллы.
В жидких
кристаллах дальний порядок соблюдается только в одном направлении; это отличает их от твердых кристаллов.
При изменении внешних условий- температуры, давления, появление примесей- дальний порядок нарушается и они превращаются в жидкость.
При изменении внешних условий- температуры, давления, появление примесей- дальний порядок нарушается и они превращаются в жидкость.
Слайд 28Аморфные тела
Твердые тела, у которых соблюдается только ближний порядок, называются аморфными.
Аморфное
состояние – промежуточное состояние между кристаллическим и жидким.