- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на тему методика преподавания молекулярной физики
Содержание
- 1. Презентация по физике на тему методика преподавания молекулярной физики
- 2. Изучение раздела «Молекулярная физика» создает базу для
- 3. Цель работы. Разработка методики преподавания раздела «Молекулярная
- 4. Задачи курсовой работы:1) Развитие интереса учащихся к
- 5. 1.1 ЗНАЧЕНИЕ, МЕСТО И ОСОБЕННОСТИ РАЗДЕЛА «МОЛЕКУЛЯРНАЯ
- 6. В разделе «Молекулярная физика» изучают молекулярно-кинетическую теорию
- 7. В разделе получают дальнейшее развитие энергетические представления,
- 8. Предлагаемая методика проведения урока по теме: «Основные положения МКТ»
- 9. Урок-тренинг по теме «Основные положения МКТ» Эпиграфы:Ум заключается
- 10. Ход урокаI. Вступительное слово учителя.Преподаватель оглашает эпиграфы
- 11. II. Вопросы, вопросы, вопросы...(Фронтальный теоретический опрос.)За каждый
- 12. 3. Какие опытные данные подтверждают эти положения?
- 13. Слайд 13
- 14. Слайд 14
- 15. V. «Вихрь задач».- На доске решаем задачи
- 16. Научные достижения Д. И. Менделеева (о них
- 17. Основные понятия раздела МОЛЕКУЛЯРНАЯ ФИЗИКА§1. ОСНОВНЫЕ ПОНЯТИЯ МКТ
- 18. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ (I)Любое тело состоит из
- 19. 2. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ (II)
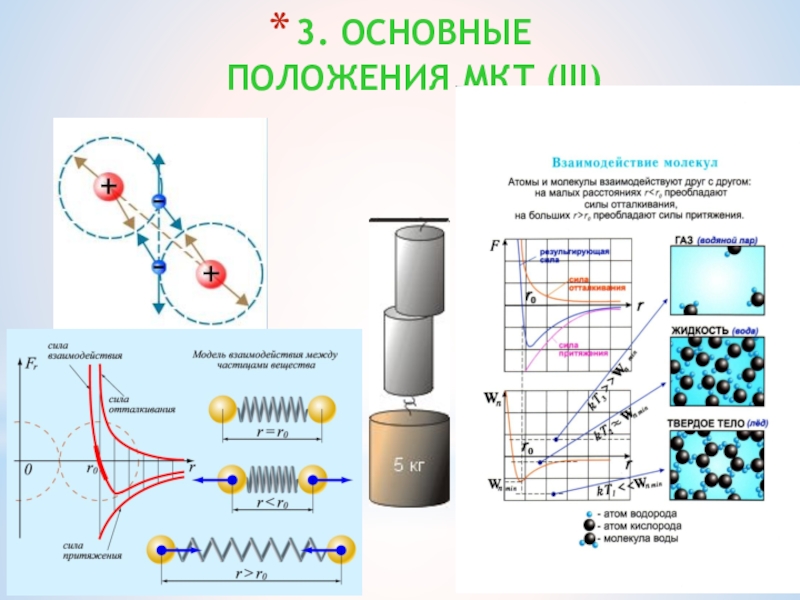
- 20. 3. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ (III)
- 21. 4. РАЗМЕР МОЛЕКУЛЕстественно предположить,что в жидкостях и
- 22. 5. СТАТИСТИЧЕСКИЙ И ТЕРМОДИНАМИЧЕСКИЙ МЕТОДЫСуществуют два способа
- 23. 6. ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА. ПАРАМЕТРЫ СОСТОЯНИЯТермодинамической системойназывается совокупность
- 24. 7. РАВНОВЕСНЫЕ ПРОЦЕССЫТермодинамическим процессом называетсяпереход системы из
- 25. 8. КРУГОВЫЕ ПРОЦЕССЫ (ЦИКЛЫ)Процесс, при котором
- 26. 9. ТЕМПЕРАТУРАЕсли два тела находятся в состояниитермодинамического
- 27. 14. УРВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАПараметры состояния термодинамическойсистемы
- 28. 15. ЗАКОН ШАРЛЯЖан Александр Шарль1746-1823французский физик иизобретатель
- 29. 16. ЗАКОН БОЙЛЯ-МАРИОТТАРоберт Бойль1627-1691английский химик, физик и теолог Эдм Мариотт1620-1684французский физик
- 30. 17. ЗАКОН ГЕЙ-ЛЮССАКАЖозеф Луи Гей-Люссак1778-1850французский химик ифизик
- 31. 18. ЗАКОН ДАЛЬТОНАДжон Дальтон1766-1844английский физик
- 32. 19. РЕАЛЬНЫЕ ГАЗЫ
- 33. Заключение В процессе выполнения данной курсовой
Изучение раздела «Молекулярная физика» создает базу для формирования мировоззрения учащихся. При его изучении происходит углубление понятия материи, что дает прекрасную возможность для демонстрации дедуктивного метода изучения явления природы. Применение дедукции в преподавании вносит свой вклад
Слайд 2
Изучение раздела «Молекулярная физика» создает базу для формирования мировоззрения учащихся. При
его изучении происходит углубление понятия материи, что дает прекрасную возможность для демонстрации дедуктивного метода изучения явления
природы. Применение дедукции в
преподавании вносит свой вклад
в развитие абстрактного мышления
учащихся.
природы. Применение дедукции в
преподавании вносит свой вклад
в развитие абстрактного мышления
учащихся.
Слайд 3 Цель работы. Разработка методики преподавания раздела «Молекулярная физика» с использованием современных
технологий и составление рекомендаций по использованию данной методики.
Объектом курсовой работы является процесс обучения физики в профессиональных колледжах.
Предметом курсовой работы является методика преподавания раздела «Молекулярная физика» в профессиональных колледжах.
Объектом курсовой работы является процесс обучения физики в профессиональных колледжах.
Предметом курсовой работы является методика преподавания раздела «Молекулярная физика» в профессиональных колледжах.
Слайд 4 Задачи курсовой работы:
1) Развитие интереса учащихся к изучению предмета через использование
дистанционных технологий в учебном процессе;
2) Определить наиболее целесообразные методы применения и разработать учебно-методические материалы по обучению раздела «Молекулярная физика» курса физики в профессиональном колледже;
3) Разработать методику проведения уроков на тему «Основные положения Молекулярно-кинетической теории » и «Идеальный газ», а также проведение лабораторных работ и решения задач на газовые законы.
2) Определить наиболее целесообразные методы применения и разработать учебно-методические материалы по обучению раздела «Молекулярная физика» курса физики в профессиональном колледже;
3) Разработать методику проведения уроков на тему «Основные положения Молекулярно-кинетической теории » и «Идеальный газ», а также проведение лабораторных работ и решения задач на газовые законы.
Слайд 51.1 ЗНАЧЕНИЕ, МЕСТО И ОСОБЕННОСТИ РАЗДЕЛА «МОЛЕКУЛЯРНАЯ ФИЗИКА»
В разделе «Молекулярная
физика» учащиеся изучают поведение качественно нового материального объекта: системы, состоящей из большого числа частиц (молекул и атомов), новую, присущую именно этому объекту форму движения (тепловую) и соответствующий ей вид энергии, (внутреннюю). Здесь учащихся впервые знакомят со статистическими закономерностями, которые используют для описания поведения большого числа частиц. Формирование статистических представлений позволяет понять смысл необратимости тепловых процессов. Именно необратимость является отличительным свойством тепловых процессов и позволяет говорить о тепловом равновесии, температуре, понять принцип работы тепловых машин.
Задача учителя — рассмотреть в единстве два метода описания тепловых явлений и процессов: термодинамический (феноменологический), основанный на понятии энергии, и статистический, основанный на молекулярно-кинетических представлениях о строении вещества. Важно показать, что эти два подхода, по сути, описывают с разных точек зрения состояние одного и того же объекта и потому дополняют друг друга. В связи с этим, формируя такие понятия, как температура, внутренняя энергия, идеальный газ и т. д., учитель должен раскрыть их содержание как с термодинамической, так и с молекулярно-кинетической точки зрения.
Задача учителя — рассмотреть в единстве два метода описания тепловых явлений и процессов: термодинамический (феноменологический), основанный на понятии энергии, и статистический, основанный на молекулярно-кинетических представлениях о строении вещества. Важно показать, что эти два подхода, по сути, описывают с разных точек зрения состояние одного и того же объекта и потому дополняют друг друга. В связи с этим, формируя такие понятия, как температура, внутренняя энергия, идеальный газ и т. д., учитель должен раскрыть их содержание как с термодинамической, так и с молекулярно-кинетической точки зрения.
Слайд 6В разделе «Молекулярная физика» изучают молекулярно-кинетическую теорию строения вещества, основные положения
которой рассматривали еще в VII классе. Изучая физику в VII и VIII классах, учащиеся научились объяснять целый ряд физических явлений, свойств веществ (свойства жидкостей и газов, давление, тепловые явления и пр.) с точки зрения внутренней структуры вещества. Однако понятия, составляющие содержание соответствующих тем, изучали на уровне представлений, а все явления описывали качественно. Поэтому при преподавании молекулярной физики в профессиональном колледже знания, имеющиеся у учащихся, нужно актуализировать, углубить и расширить, довести их до уровня понятий и количественного описания явлений. В частности, в курсе физики профессионального колледжа разделу «Молекулярная физика» отводится 6 часов, рассматривается формирование таких понятий, как основное уравнение молекулярно-кинетической теории газов; значительно глубже, чем в VII классе, рассматривают свойства газов, жидкостей и твердых тел.
Слайд 7В разделе получают дальнейшее развитие энергетические представления, происходит обобщение закона сохранения
энергии на тепловые процессы, вводят формулу первого закона термодинамики и рассматривают применение этого закона к анализу конкретных процессов.
Раздел «Молекулярная физика» дает возможность продолжить знакомство учащихся с экспериментальным методом исследования, который находит отражение в фундаментальных опытах (броуновское движение, опыт Штерна) и опытах, иллюстрирующих газовые законы (опыт Бойля, Шарля и пр.).
Раздел «Молекулярная физика» изучается в профессиональных колледжах после раздела «Механика». Такое расположение материала, с одной стороны, соответствует методическому принципу рассмотрения физических явлений в порядке усложнения форм движения Материи, а с другой — позволяет изучать микроявления на количественном уровне и использовать известные из курса механики величины: масса, скорость, сила, импульс, энергия и т. д.
Раздел «Молекулярная физика» дает возможность продолжить знакомство учащихся с экспериментальным методом исследования, который находит отражение в фундаментальных опытах (броуновское движение, опыт Штерна) и опытах, иллюстрирующих газовые законы (опыт Бойля, Шарля и пр.).
Раздел «Молекулярная физика» изучается в профессиональных колледжах после раздела «Механика». Такое расположение материала, с одной стороны, соответствует методическому принципу рассмотрения физических явлений в порядке усложнения форм движения Материи, а с другой — позволяет изучать микроявления на количественном уровне и использовать известные из курса механики величины: масса, скорость, сила, импульс, энергия и т. д.
Слайд 9 Урок-тренинг по теме «Основные положения МКТ»
Эпиграфы:
Ум заключается не только в знании,
но и в умении прилагать знание на деле. Аристотель, древнегреческий философ (384 - 322 гг. до н. э.)
Упражнение, друзья, дает больше, чем хорошее природное дарование.
Протагор
Цели: повторение, систематизация знаний по теме «Основные положения молекулярно-кинетической теории», формирование навыка решения типовых задач по данной теме, расширение кругозора студентов.
Упражнение, друзья, дает больше, чем хорошее природное дарование.
Протагор
Цели: повторение, систематизация знаний по теме «Основные положения молекулярно-кинетической теории», формирование навыка решения типовых задач по данной теме, расширение кругозора студентов.
Слайд 10 Ход урока
I. Вступительное слово учителя.
Преподаватель оглашает эпиграфы урока, комментирует их, озвучивает
цели урока.
У студентов на столе тексты задач к уроку, у каждого - рейтинговая карта.
Преподаватель. Наше занятие сегодня пройдет несколько необычно, каждый из вас сегодня будет работать на свой рейтинг, фиксируя свой успех в специальной рейтинговой карте. Она должна быть именной (предлагает студентам подписать ее). Каждый правильный ответ - 1 балл в вашей карте, правильно решенная задача - 3 балла, если решаете задачу самостоятельно - это надо делать в самой рейтинговой карте и самостоятельно себя оценить. В конце урока карты сдаются преподавателю. И еще одно правило нашего занятия: сегодня мы неоднократно будем пользоваться таблицей Менделеева и давайте договоримся, что при каждом обращении к этой таблице мы будем называть какое-нибудь достижение Д. И. Менделеева перед наукой, и не только химией! Ведь наш великий ученый прославился своими открытиями и в физике! Не знали? Об этом мы тоже будем говорить сегодня.
У студентов на столе тексты задач к уроку, у каждого - рейтинговая карта.
Преподаватель. Наше занятие сегодня пройдет несколько необычно, каждый из вас сегодня будет работать на свой рейтинг, фиксируя свой успех в специальной рейтинговой карте. Она должна быть именной (предлагает студентам подписать ее). Каждый правильный ответ - 1 балл в вашей карте, правильно решенная задача - 3 балла, если решаете задачу самостоятельно - это надо делать в самой рейтинговой карте и самостоятельно себя оценить. В конце урока карты сдаются преподавателю. И еще одно правило нашего занятия: сегодня мы неоднократно будем пользоваться таблицей Менделеева и давайте договоримся, что при каждом обращении к этой таблице мы будем называть какое-нибудь достижение Д. И. Менделеева перед наукой, и не только химией! Ведь наш великий ученый прославился своими открытиями и в физике! Не знали? Об этом мы тоже будем говорить сегодня.
Слайд 11II. Вопросы, вопросы, вопросы...
(Фронтальный теоретический опрос.)
За каждый правильный ответ - 1
балл в карту.
1. Кому принадлежат слова: «Атомы бесконечны в числе и бесконечно различны по форме...».
«Различия всех предметов зависят от различия их атомов в числе, величине, форме и порядке».
«Ничто не существует, кроме атомов и пустого пространства. Все прочее есть мнение».
(Автор этих слов - древнегреческий ученый Демокрит, живший в V веке до нашей эры. Нам остается лишь еще раз поразиться могуществу человеческого разума...)
2. Назовите основные положения молекулярно - кинетической теории.
На интерактивной доске с помощью мультимедиа схематично фиксируется:
Молекулы
Существуют Движутся Взаимодействуют
1. Кому принадлежат слова: «Атомы бесконечны в числе и бесконечно различны по форме...».
«Различия всех предметов зависят от различия их атомов в числе, величине, форме и порядке».
«Ничто не существует, кроме атомов и пустого пространства. Все прочее есть мнение».
(Автор этих слов - древнегреческий ученый Демокрит, живший в V веке до нашей эры. Нам остается лишь еще раз поразиться могуществу человеческого разума...)
2. Назовите основные положения молекулярно - кинетической теории.
На интерактивной доске с помощью мультимедиа схематично фиксируется:
Молекулы
Существуют Движутся Взаимодействуют
Слайд 15V. «Вихрь задач».
- На доске решаем задачи с нечетными номерами, в
рейтинговых карточках - самостоятельно задачи с четными номерами, оцениваем себя по 3-балльной шкале. Решающий у доски тоже самостоятельно оценивает свою работу и заносит баллы в свою рейтинговую карту с пометкой «работа у доски».
Задачи к уроку-тренингу «Основные положения молекулярно-кинетической теории»:
Задачи к уроку-тренингу «Основные положения молекулярно-кинетической теории»:
Слайд 16 Научные достижения Д. И. Менделеева (о них говорили при каждом обращении
к периодической системы элементов):
☺ всемирная слава пришла к Менделееву после создания им периодической системы элементов;
☺ предсказал детально физические и химические свойства нескольких еще неизвестных элементов, которым присвоил название экаалюминий, экабор, экакремний;
☺ предсказал существование критической температуры, получил общее уравнение состояния идеального газа;
☺ ему принадлежит конструкция барометра;
☺ в 1887г. осуществил полет на воздушном шаре для наблюдения солнечного затмения и изучения верхних слоев атмосферы;
☺ большую роль сыграл в организации метрологической службы;
☺ разработал физическую теорию весов, точные приемы взвешивания;
☺ много времени уделял переплетному делу и изготовлению чемоданов.
Сам Д. И. Менделеев писал так о своих заслугах перед наукой: «Всего более четыре предмета составили мне имя: периодический закон, исследования упругости газов, понимание растворов как ассоциаций, «Основы химии». Тут все мое богатство. Оно не отнято у кого-нибудь, а произведено мною, это мои дети, и ими, увы, дорожу сильно, столько же, как и детьми».
☺ всемирная слава пришла к Менделееву после создания им периодической системы элементов;
☺ предсказал детально физические и химические свойства нескольких еще неизвестных элементов, которым присвоил название экаалюминий, экабор, экакремний;
☺ предсказал существование критической температуры, получил общее уравнение состояния идеального газа;
☺ ему принадлежит конструкция барометра;
☺ в 1887г. осуществил полет на воздушном шаре для наблюдения солнечного затмения и изучения верхних слоев атмосферы;
☺ большую роль сыграл в организации метрологической службы;
☺ разработал физическую теорию весов, точные приемы взвешивания;
☺ много времени уделял переплетному делу и изготовлению чемоданов.
Сам Д. И. Менделеев писал так о своих заслугах перед наукой: «Всего более четыре предмета составили мне имя: периодический закон, исследования упругости газов, понимание растворов как ассоциаций, «Основы химии». Тут все мое богатство. Оно не отнято у кого-нибудь, а произведено мною, это мои дети, и ими, увы, дорожу сильно, столько же, как и детьми».
Слайд 18ОСНОВНЫЕ
ПОЛОЖЕНИЯ МКТ (I)
Любое тело состоит из большого числа
весьма малых обособленных
частиц –
молекул. Молекула является мельчайшей
частицей вещества, сохраняющей все его
химические свойства. Простейшие молекулы (содержат только одно ядро),
называются атомами.
молекул. Молекула является мельчайшей
частицей вещества, сохраняющей все его
химические свойства. Простейшие молекулы (содержат только одно ядро),
называются атомами.
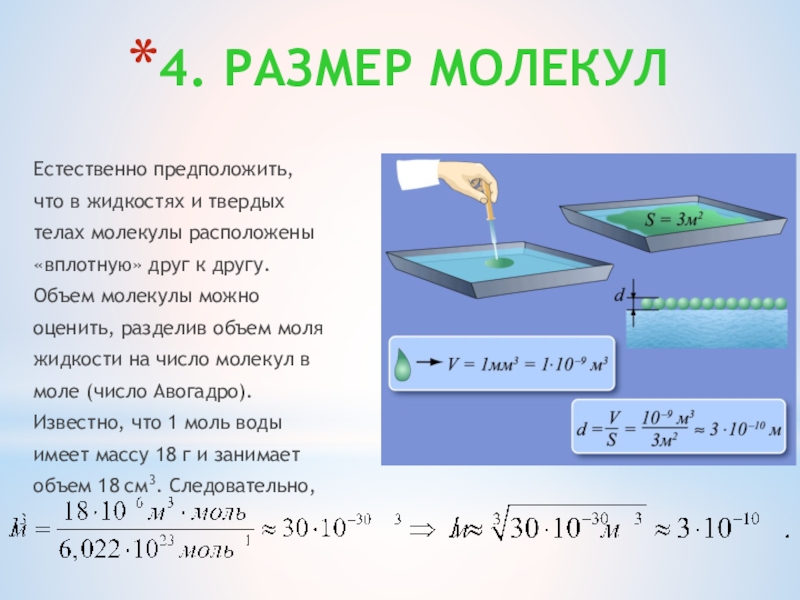
Слайд 214. РАЗМЕР МОЛЕКУЛ
Естественно предположить,
что в жидкостях и твердых
телах молекулы расположены
«вплотную» друг
к другу.
Объем молекулы можно
оценить, разделив объем моля
жидкости на число молекул в
моле (число Авогадро).
Известно, что 1 моль воды
имеет массу 18 г и занимает
объем 18 см3. Следовательно,
Объем молекулы можно
оценить, разделив объем моля
жидкости на число молекул в
моле (число Авогадро).
Известно, что 1 моль воды
имеет массу 18 г и занимает
объем 18 см3. Следовательно,
Слайд 225. СТАТИСТИЧЕСКИЙ И
ТЕРМОДИНАМИЧЕСКИЙ МЕТОДЫ
Существуют два способа описания процессов, происходящих в макро-
скопических
телах (телах, состоящих из большого числа частиц) –
статистический и термодинамический. Статистический метод изучает
свойства макроскопических тел исходя из свойств образующих тело
частиц и взаимодействий между ними. Свойства тел, наблюдаемые на
опыте, объясняются как усред-
ненный результат действия
отдельных молекул. Термодина-
мический метод изучает свойства
тел, не вдаваясь в их микроско-
пическую структуру, а опираясь
на фундаментальные законы
(начала термодинамики), уста-
новленные обобщением экспе-
риментальных фактов.
статистический и термодинамический. Статистический метод изучает
свойства макроскопических тел исходя из свойств образующих тело
частиц и взаимодействий между ними. Свойства тел, наблюдаемые на
опыте, объясняются как усред-
ненный результат действия
отдельных молекул. Термодина-
мический метод изучает свойства
тел, не вдаваясь в их микроско-
пическую структуру, а опираясь
на фундаментальные законы
(начала термодинамики), уста-
новленные обобщением экспе-
риментальных фактов.
Слайд 236. ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА. ПАРАМЕТРЫ СОСТОЯНИЯ
Термодинамической системой
называется совокупность
макроскопических тел, которые
могут обмениваться
энергией
между собой и окружающей средой.
Термодинамическая система может
находиться в различных состояниях,
различающихся температурой,
давлением, объемом, плотностью…
Подобные величины, характерезу-
ющие состояние системы, называ-
ются параметрами состояниями.
Термодинамические системы, которые
не обмениваются с внешней средой
ни энергией, ни веществом называ-
ются замкнутыми (изолированными).
между собой и окружающей средой.
Термодинамическая система может
находиться в различных состояниях,
различающихся температурой,
давлением, объемом, плотностью…
Подобные величины, характерезу-
ющие состояние системы, называ-
ются параметрами состояниями.
Термодинамические системы, которые
не обмениваются с внешней средой
ни энергией, ни веществом называ-
ются замкнутыми (изолированными).
Слайд 247. РАВНОВЕСНЫЕ ПРОЦЕССЫ
Термодинамическим процессом называется
переход системы из одного состояния в другое.
Такой
переход всегда связан с нарушением
равновесия системы. Например, при сжатии
газа давление в первую очередь возрастет
вблизи поршня – равновесие нарушится.
Нарушение равновесия будет тем значительнее,
чем быстрее перемещать поршень. Если двигать
поршень очень медленно, то равновесие нару-
шается незначительно и давление в разных
точках мало отличается от равновесного для
данного объема газа. В пределе, при бесконечно
медленном сжатии процесс окажется состоящим
из последовательности равновесных состояний.
Такой процесс называется равновесным или
квазистатическим.
равновесия системы. Например, при сжатии
газа давление в первую очередь возрастет
вблизи поршня – равновесие нарушится.
Нарушение равновесия будет тем значительнее,
чем быстрее перемещать поршень. Если двигать
поршень очень медленно, то равновесие нару-
шается незначительно и давление в разных
точках мало отличается от равновесного для
данного объема газа. В пределе, при бесконечно
медленном сжатии процесс окажется состоящим
из последовательности равновесных состояний.
Такой процесс называется равновесным или
квазистатическим.
Слайд 258. КРУГОВЫЕ
ПРОЦЕССЫ (ЦИКЛЫ)
Процесс, при котором система после ряда изменений возвра-
щается
в исходное состояние, называется круговым процессом
или циклом. Графически цикл изображается замкнутой кривой
на фазовой диаграмме.
или циклом. Графически цикл изображается замкнутой кривой
на фазовой диаграмме.
Слайд 269. ТЕМПЕРАТУРА
Если два тела находятся в состоянии
термодинамического равновесия, то
есть не обмениваются
энергией путем
теплопередачи, то этим телам припи-
сывается одинаковая температура.
Если между телами происходит направ-
ленный теплообмен, то телу отдающему
энергию приписывают большую темпе-
ратуру по сравнению с телом, получа-
ющим тепловую энергию.
Ряд свойств тел – объем, давление,
электрическое сопротивление – зависит
от температуры. Любое из этих свойств
Можно использовать для количествен-
ного определения температуры.
теплопередачи, то этим телам припи-
сывается одинаковая температура.
Если между телами происходит направ-
ленный теплообмен, то телу отдающему
энергию приписывают большую темпе-
ратуру по сравнению с телом, получа-
ющим тепловую энергию.
Ряд свойств тел – объем, давление,
электрическое сопротивление – зависит
от температуры. Любое из этих свойств
Можно использовать для количествен-
ного определения температуры.
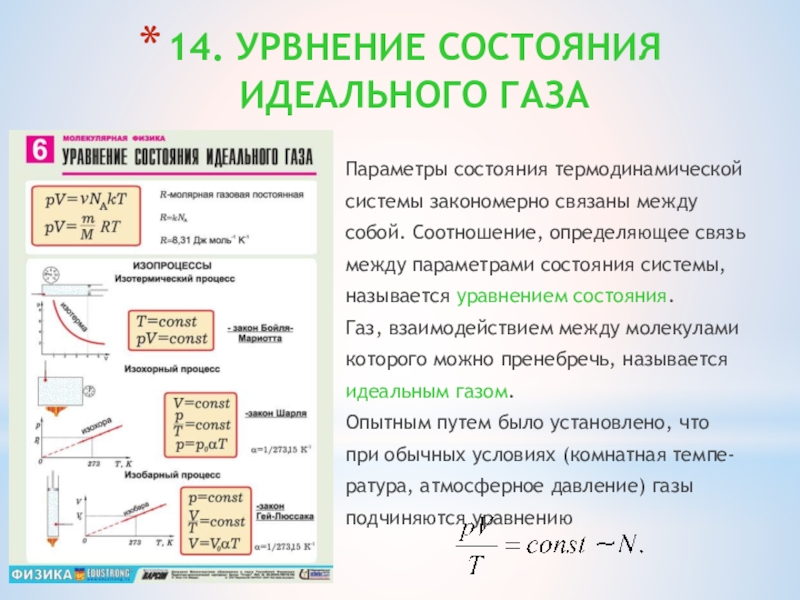
Слайд 2714. УРВНЕНИЕ СОСТОЯНИЯ
ИДЕАЛЬНОГО ГАЗА
Параметры состояния термодинамической
системы закономерно связаны между
собой. Соотношение, определяющее
связь
между параметрами состояния системы,
называется уравнением состояния.
Газ, взаимодействием между молекулами
которого можно пренебречь, называется
идеальным газом.
Опытным путем было установлено, что
при обычных условиях (комнатная темпе-
ратура, атмосферное давление) газы
подчиняются уравнению
между параметрами состояния системы,
называется уравнением состояния.
Газ, взаимодействием между молекулами
которого можно пренебречь, называется
идеальным газом.
Опытным путем было установлено, что
при обычных условиях (комнатная темпе-
ратура, атмосферное давление) газы
подчиняются уравнению
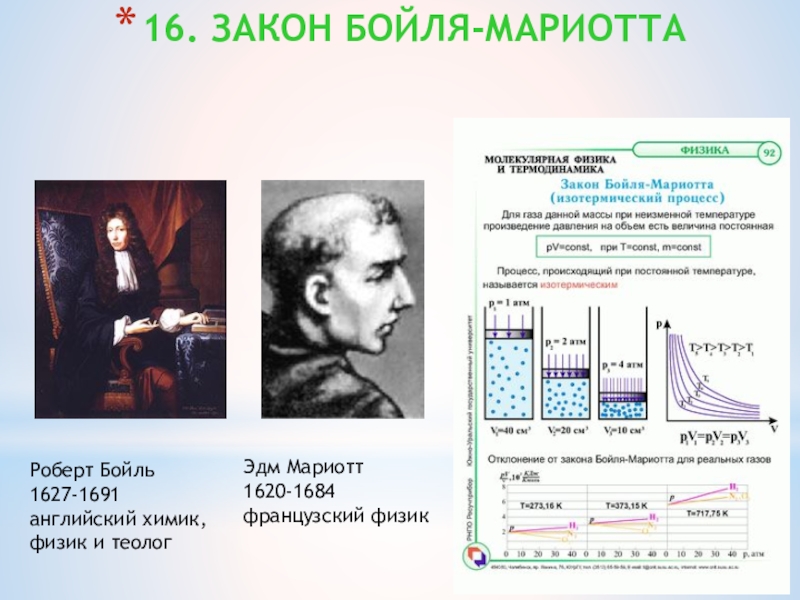
Слайд 2916. ЗАКОН БОЙЛЯ-МАРИОТТА
Роберт Бойль
1627-1691
английский химик,
физик и теолог
Эдм Мариотт
1620-1684
французский физик
Слайд 33Заключение
В процессе выполнения данной курсовой работы выяснилось, что раздел «Молекулярная
физика» имеет большое значение в формировании основных понятий микромира. Вследствие того, что основные понятия раздела отражают физическую сущность микрообъектов, наглядная демонстрация этих процессов затруднена. Использование рекомендуемой методики позволяет качественное формирование основных положений молекулярной физики. Предлагаемая методика содержит последовательное изложение материала в обучении физики на примере тем «Основные положения МКТ», «Идеальный газ». Следует отметить, что методически правильное построение учебного процесса не только повышает интерес учащихся к предмету, но и приводит к росту качества знаний.