- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на тему Атомная физика (9 класс)
Содержание
- 1. Презентация по физике на тему Атомная физика (9 класс)
- 2. Краткая история Идея о существовании мельчайших неделимых
- 3. В современном мире мы все уже знаем,
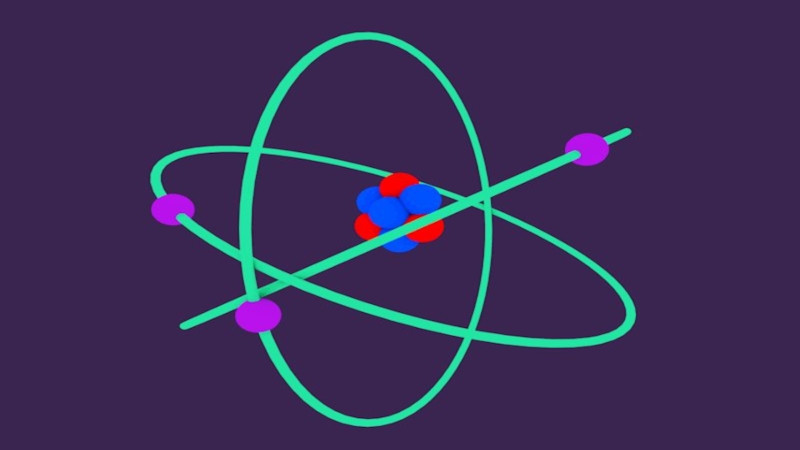
- 4. Строение атома (Резерфорда)Резерфорд Эрнест (1871-1937)-великий английский физик,
- 5. Схема строения атомаРезерфорд предложил свою схему строения
- 6. Модель атома водорода по БоруНильс Бор родился
- 7. Теория строения атома по БоруИспользуемая В 1913
- 8. Квантовые постулаты БораН. Бор выдвинул два постулата
- 9. Первый и второй постулаты Бора1 постулат Бора
- 10. Испускание и поглощение света атомамиАтомы могут самопроизвольно
- 11. Слайд 11
- 12. Конец.
Слайд 2Краткая история
Идея о существовании мельчайших неделимых частиц — атомов, впервые
Слайд 3В современном мире мы все уже знаем, что все состоит из
Мы даже знаем, что такое атом, его строения и свойства.
Слайд 4Строение атома (Резерфорда)
Резерфорд Эрнест (1871-1937)-великий английский физик, уроженец Новой Зеландии. Своими
Слайд 5Схема строения атома
Резерфорд предложил свою схему строения атома: в центре атома
Слайд 6Модель атома водорода по Бору
Нильс Бор родился 7 октября 1885 г.
Слайд 7Теория строения атома по Бору
Используемая В 1913 г. Бор предложил сою
Слайд 8Квантовые постулаты Бора
Н. Бор выдвинул два постулата – атомная система может
Слайд 9Первый и второй постулаты Бора
1 постулат Бора гласит: атомная система может
2 постулат Бора гласит: излучение света происходит при переходе атома из стационарного состояния с большей энергией Er в стационарное состояние с меньшей энергией En. Энергия излученного фотона равна разности энергий стационарных состояний.
3 постулат Бора гласит: из всех возможных орбит, стационарное состояние соответствует только тем для которых момент количества движения электрона кратен постоянной Планка.