- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике, 11 класс. Модель атома.Опыт Резерфорда. Постулаты Бора.
Содержание
- 1. Презентация по физике, 11 класс. Модель атома.Опыт Резерфорда. Постулаты Бора.
- 2. Модель атома Опыт РезерфордаКвантовая физикаСлово атом
- 3. Модель атома Томсона Первую модель атома предложил
- 4. Модель атома Томсона Количество атомов совпадало с
- 5. Опыт Резерфорда Ученик Дж.Томсона
- 6. Свойства радиоактивных излучений
- 7. Схема опыта Резерфорда Свинцовая коробкаЗолотая фольгаЭкран(покрытый
- 8. Свинцовая коробкаФольгаЭкранРадиоактивное веществоВ опыте Резерфорда, некоторые частицы
- 9. Слайд 9
- 10. Предполагаемый результат исходя из модели атома по
- 11. Предположение Резерфорда Резерфорд объяснил наблюдаемое явление.
- 12. +-При столкновении с плотным ядром, альфа-частицы изменяют траекторию своего движения.Предположение Резерфорда--Х
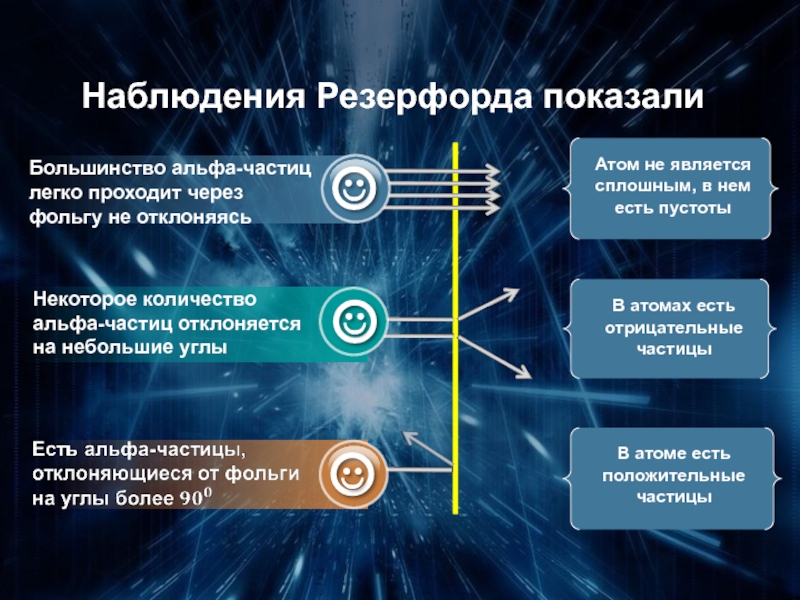
- 13. Наблюдения Резерфорда показали
- 14. Выводы по результатам опыта:В центре атома находитсямассивное
- 15. Атом по РезерфордуИз-за некоторого сходства с Солнечной
- 16. Слайд 16
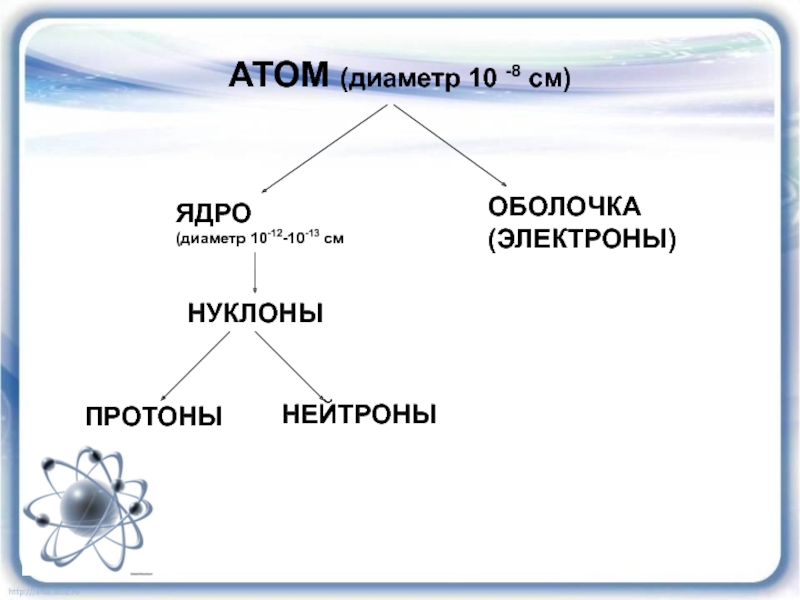
- 17. АТОМ (диаметр 10 -8 см)ЯДРО(диаметр 10-12-10-13 смОБОЛОЧКА(ЭЛЕКТРОНЫ)НУКЛОНЫПРОТОНЫНЕЙТРОНЫ
- 18. Слайд 18
- 19. Итог В начале ХХ века были рассмотрены
- 20. Итог В начале ХХ века были рассмотрены
- 21. Итог Исходя из планетарной модели атома:Большая часть
- 22. Итог Из двух представленных моделей для дальнейшего
- 23. Недостатки атома РезерфордаЭта модель не согласуется с
- 24. Нильс Бор1913 годКвантовая теория атома
- 25. I ПОСТУЛАТ БОРА Атомная система может находится только
- 26. II ПОСТУЛАТ БОРА При переходе атома из стационарного
- 27. Энергетический уровень – каждое значение энергии, которой
- 28. Когда атом переходит с более высокого на
- 29. Если атом водорода переходит из более высоких
- 30. Если атом водорода переходит из более высоких
- 31. СЕРИЯ ЛАЙМАНА УЛЬТРАФИОЛЕТОВОЕ ИЗЛУЧЕНИЕЕсли атом водорода переходит
- 32. Если атом переходит в одно из возбужденных
- 33. Вид энергетических уровней (поглощение кванта)
- 34. спектры излучения (рис.5 –цветная вклейка)Спектр нагретого вещества
- 35. СПЕКТРЫ ИСПУСКАНИЯСПЕКТРЫ ПОГЛОЩЕНИЯ1-сплошной2-натрия3-водорода4-гелия5-солнечный6-натрия7-водорода8-гелия
- 36. Свои постулаты Бор применил для объяснения излучения и поглощения света атомом водорода.
- 37. Недостатки теории Бора
Слайд 2
Модель атома
Опыт Резерфорда
Квантовая физика
Слово атом означает неделимый.
Но так ли в
То, что атом сложный стало понятно в конце XIX века.
Первой весточкой сложного строения атома стали обнаруженные катодные лучи газоразрядных трубок. Катодные лучи представляли из себя поток отрицательно заряженных частиц.
В 1895 году В. Рентген открыл X-лучи (рентгеновское излучение).
В 1896 году А. Беккерель открыл явление радиоактивности.
Все эти открытия говорили о сложных и пока еще непонятных процессах происходящих внутри атома.
Х
Слайд 3Модель атома Томсона
Первую модель атома предложил Дж.Дж.Томсон. Он предположил, что
+
-
-
Х
Слайд 4Модель атома Томсона
Количество атомов совпадало с положительным зарядом шара. Так,
Данной моделью можно было объяснить многие наблюдаемые явления, но не все…
+
-
-
Х
Слайд 5
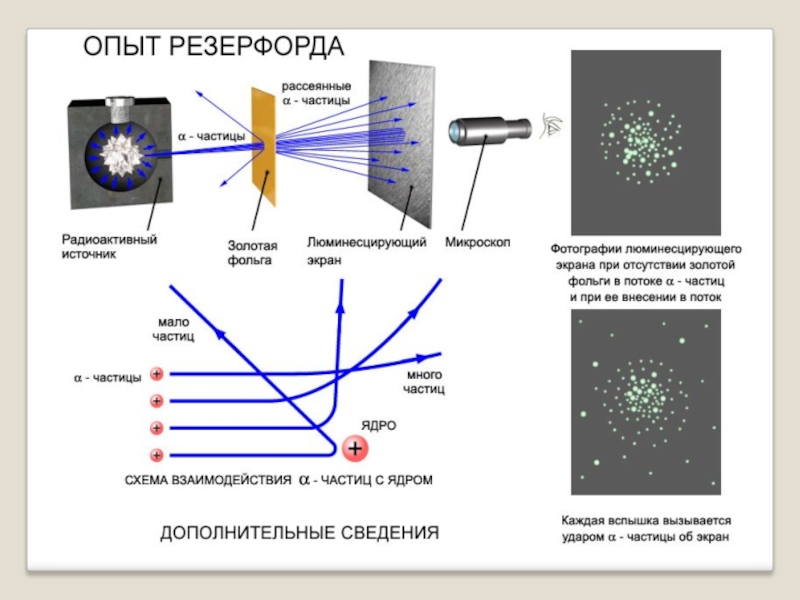
Опыт Резерфорда
Ученик Дж.Томсона Эрнест
Опыты проведенные Резерфордом полностью перевернули представление об устройстве атома.
Альфа-частица представляет собой полностью ионизированный (то есть лишенный всех электронов) атом гелия
Х
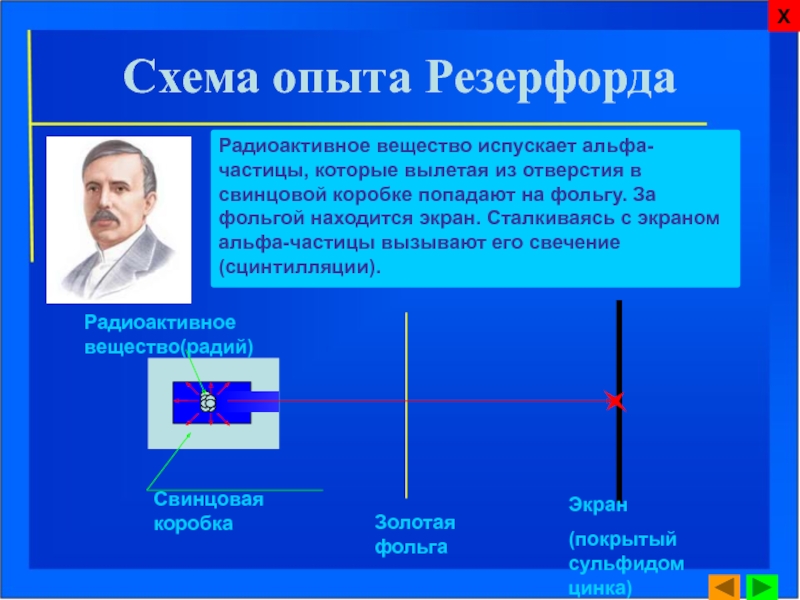
Слайд 7Схема опыта Резерфорда
Свинцовая коробка
Золотая фольга
Экран
(покрытый сульфидом цинка)
Радиоактивное вещество(радий)
Радиоактивное вещество
Х
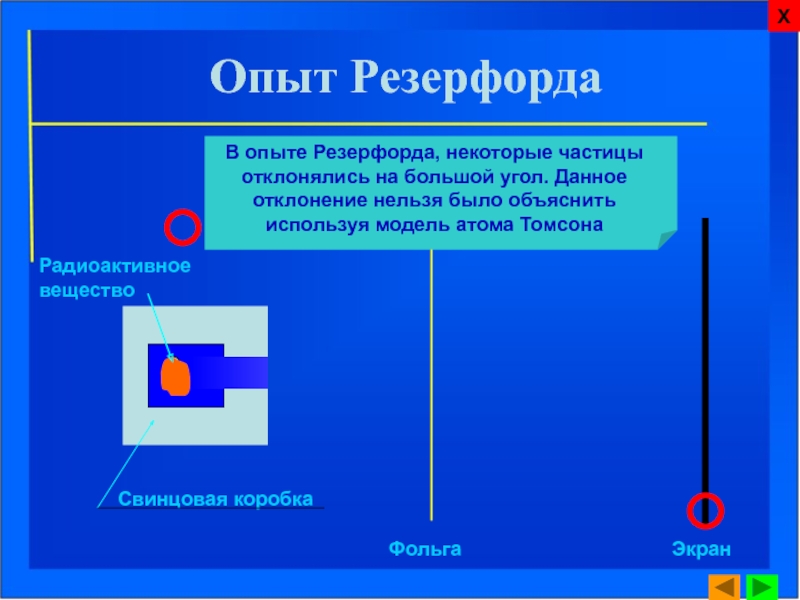
Слайд 8
Свинцовая коробка
Фольга
Экран
Радиоактивное вещество
В опыте Резерфорда, некоторые частицы отклонялись на большой угол.
Опыт Резерфорда
Х
Слайд 10
Предполагаемый результат исходя из модели атома по Томсону
Если рассматривать
Альфа-частица просто бы пробила «жидкий» атом насквозь.
+
-
-
Х
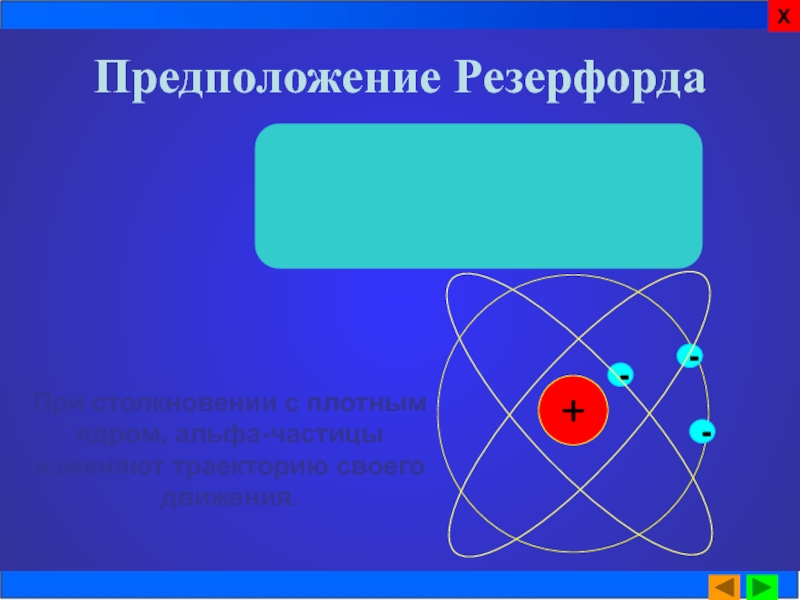
Слайд 11Предположение Резерфорда
Резерфорд объяснил наблюдаемое явление. По его предположению основная
-
-
+
-
Х
ЯДРО
Слайд 12
+
-
При столкновении с плотным ядром, альфа-частицы изменяют траекторию своего движения.
Предположение Резерфорда
-
-
Х
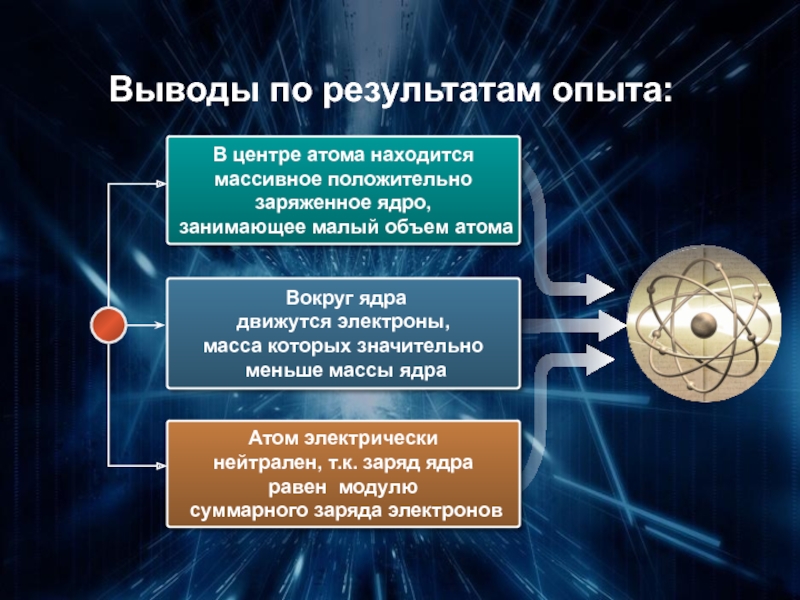
Слайд 14Выводы по результатам опыта:
В центре атома находится
массивное положительно
заряженное ядро,
занимающее малый
Вокруг ядра
движутся электроны,
масса которых значительно
меньше массы ядра
Атом электрически
нейтрален, т.к. заряд ядра
равен модулю
суммарного заряда электронов
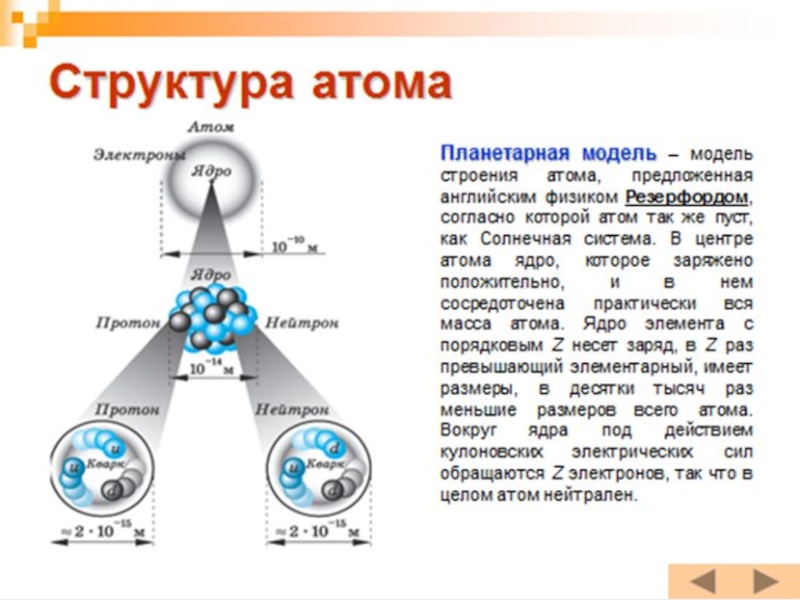
Слайд 15Атом по Резерфорду
Из-за некоторого сходства с Солнечной системой, модель атома по
Х
Слайд 19Итог
В начале ХХ века были рассмотрены две модели атомов. Первая
Х
Слайд 20Итог
В начале ХХ века были рассмотрены две модели атомов. Первая
После опытов по рассеянию альфа-частиц на различных веществах Э.Резерфорд пришел к ядерной (планетарной) модели атома, где электроны вращались по орбитам вокруг ядра.
Х
Слайд 21Итог
Исходя из планетарной модели атома:
Большая часть массы атома сосредоточена в
Линейный размер ядра в 10-100 тысяч раз меньше линейных размеров атома.
Эта модель проста, обоснована экспериментально, но не позволяет объяснить устойчивость атомов.
Х
Слайд 22Итог
Из двух представленных моделей для дальнейшего разбора и изучения выберем
Х
Слайд 23Недостатки атома Резерфорда
Эта модель не согласуется с наблюдаемой стабильностью атомов. По
Эта модель не объясняет наблюдаемые на опыте оптические спектры атомов. Оптические спектры атомов не непрерывны, как это следует из теории Резерфорда, а состоят из узких спектральных линий, т.е. атомы излучают и поглощают электромагнитные волны лишь определенных частот, характерных для данного химического элемента.
К явлениям атомных масштабов законы классической физики неприменимы.
Слайд 25I ПОСТУЛАТ БОРА
Атомная система может находится только в особых стационарных квантовых
В стационарных состояниях атом не излучает.
+
-
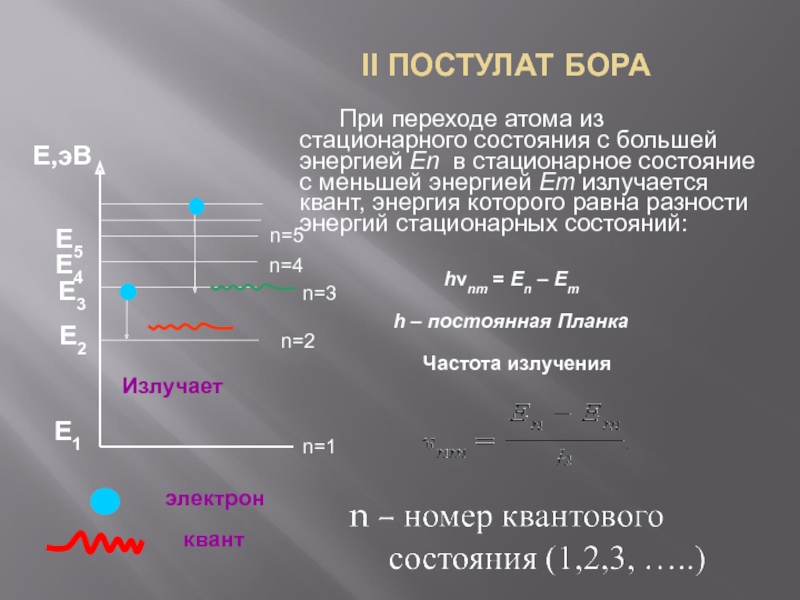
Слайд 26II ПОСТУЛАТ БОРА
При переходе атома из стационарного состояния с большей энергией
Е1
Е2
Е3
Е,эВ
Излучает
Е4
hνnm = En – Em
h – постоянная Планка
Частота излучения
электрон
квант
n=1
n=2
n=3
n=4
n=5
Е5
Слайд 27
Энергетический уровень – каждое значение энергии, которой обладает атом в том
Чем больше n, тем дальше от ядра находиться электрон и тем выше его энергетический уровень
Слайд 28
Когда атом переходит с более высокого на более низкий уровень, то
(ИСПУСКАНИЕ) кванта света
(Е3 Е2, Е4 Е2…)
При ПОГЛОЩЕНИИ, наоборот, падающий на этом квант переводит атом из состояния с меньшей в состояние с большей энергией
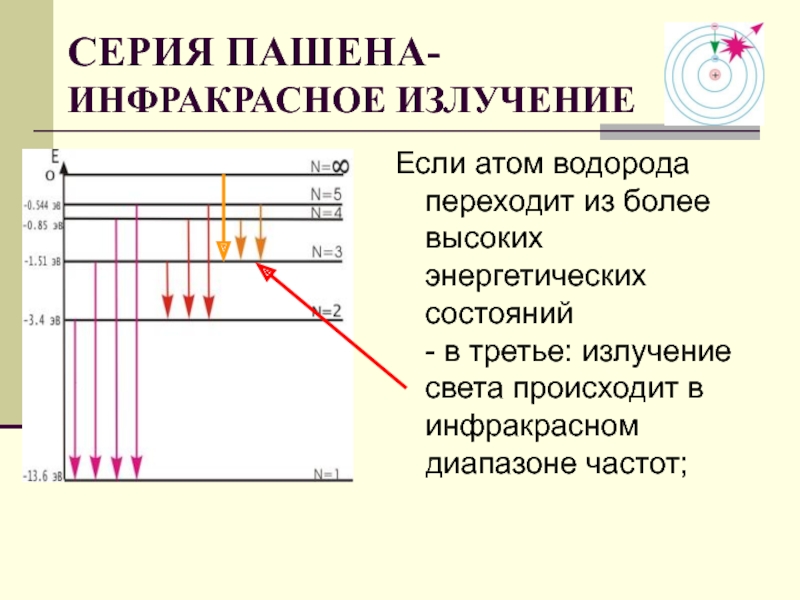
Слайд 29Если атом водорода переходит из более высоких энергетических состояний - в
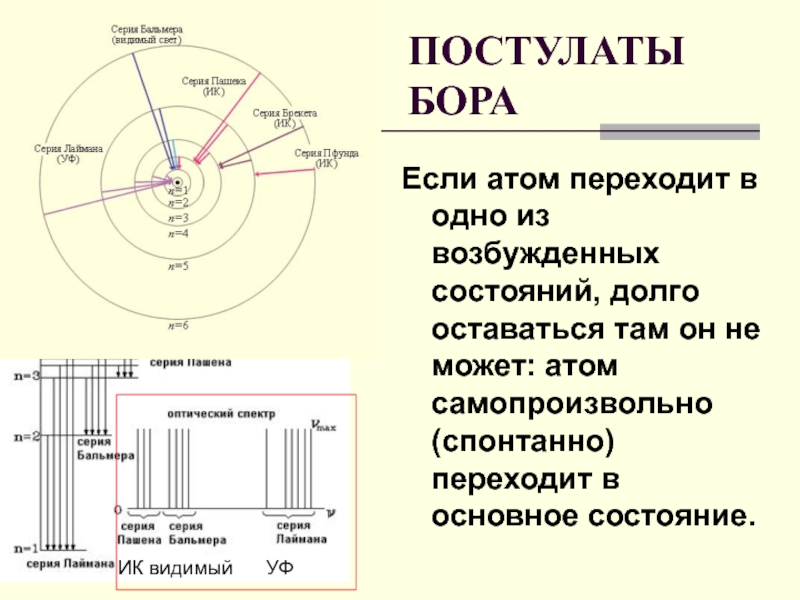
СЕРИЯ ПАШЕНА-
ИНФРАКРАСНОЕ ИЗЛУЧЕНИЕ
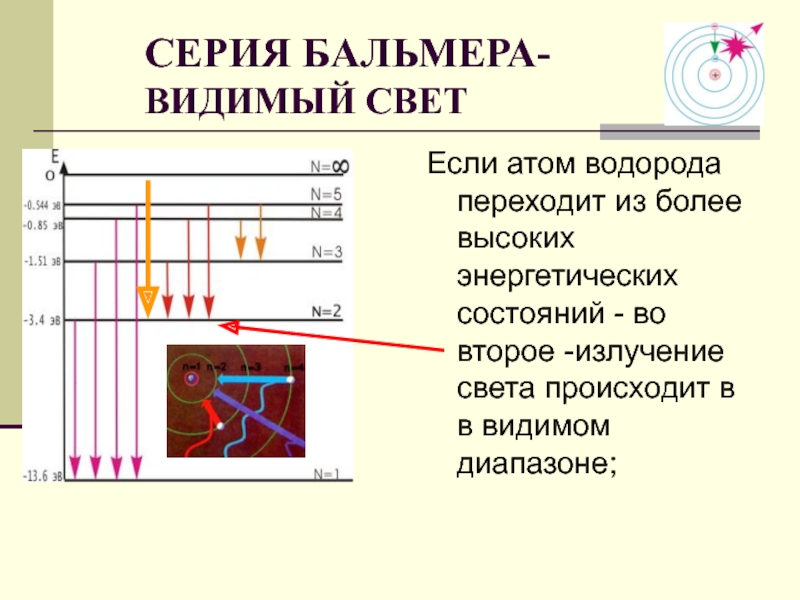
Слайд 30Если атом водорода переходит из более высоких энергетических состояний - во
СЕРИЯ БАЛЬМЕРА-
ВИДИМЫЙ СВЕТ
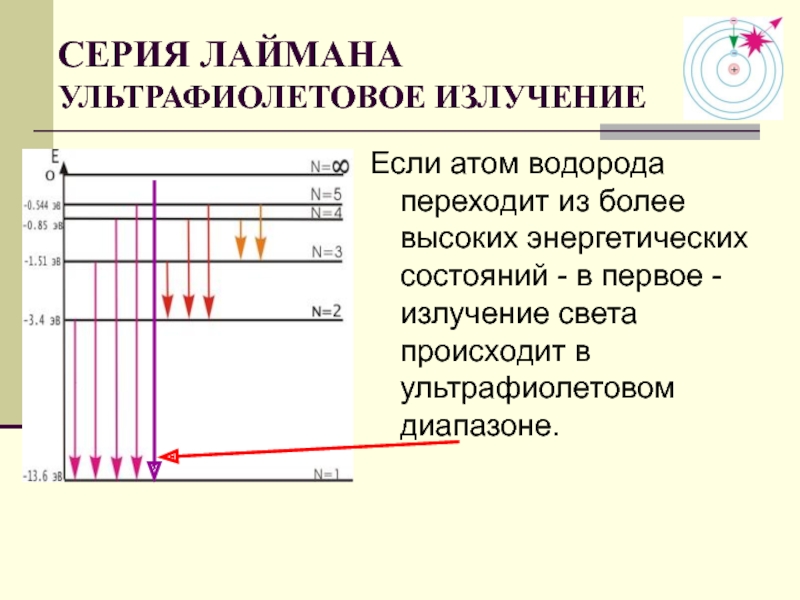
Слайд 31СЕРИЯ ЛАЙМАНА УЛЬТРАФИОЛЕТОВОЕ ИЗЛУЧЕНИЕ
Если атом водорода переходит из более высоких энергетических
Слайд 32Если атом переходит в одно из возбужденных состояний, долго оставаться там
ПОСТУЛАТЫ БОРА
ИК видимый УФ
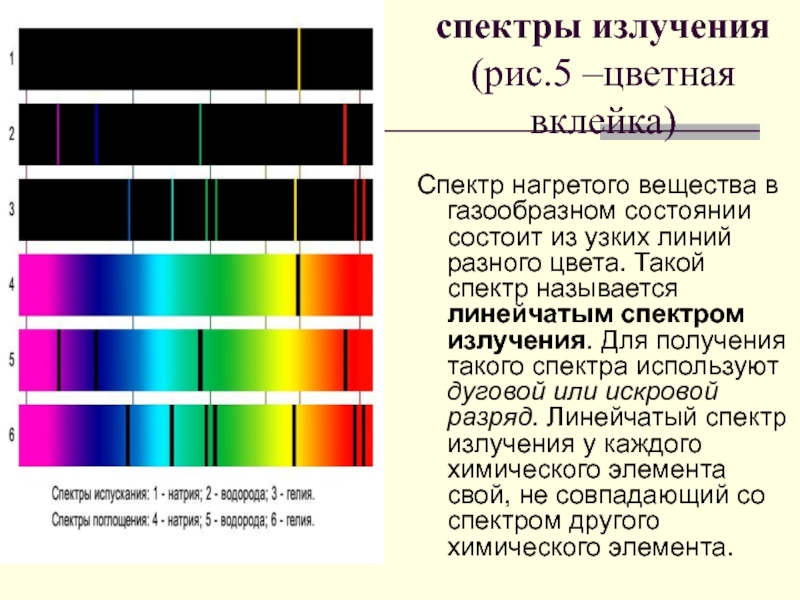
Слайд 34спектры излучения
(рис.5 –цветная вклейка)
Спектр нагретого вещества в газообразном состоянии состоит из
Слайд 35СПЕКТРЫ ИСПУСКАНИЯ
СПЕКТРЫ ПОГЛОЩЕНИЯ
1-сплошной
2-натрия
3-водорода
4-гелия
5-солнечный
6-натрия
7-водорода
8-гелия
Слайд 37Недостатки теории Бора
1. Не смогла объяснить интенсивность спектральных
2. Справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева.
3. Теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно — уравнение движения электрона — классическое, другое — уравнение квантования орбит — квантовое.