- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по Физике 10 класс. Газовые законы
Содержание
- 1. Презентация по Физике 10 класс. Газовые законы
- 2. ГАЗОВЫЕ ЗАКОНЫ(10 класс) Профильная программа
- 3. Цели урока.1.Формировать у учащихся знания молекулярно-кинетической теории
- 4. Задачи урока.Образовательные: Изучить, используя групповой способ работы,
- 5. ВоспитательныеПродолжить формирование познавательного интереса учащихся;В целях интернационального
- 6. РазвивающиеРазвивать осознание личностного смысла учения; желания самостоятельно
- 7. Тип урока – Формирование новых знаний. Структура урокаАктуализация знаний.Мотивация знаний.Изучение нового материала.Закрепление.Домашнее задание.
- 8. Актуализация знаний. Мы изучаем основы МКТ идеального
- 9. УравнениеМенделеева-КлапейронаУравнение состояния идеального газа
- 10. Краткая биография.
- 11. Краткая биография
- 12. Получим уравнение, которое связывает все три термодинамических
- 13. Уравнение Клапейрона.Задача урока: Применить это уравнение для
- 14. Тема урока: Газовые законы.Цель урока: Используя уравнение
- 15. В группах: получить законы изопроцессов.(m=const)
- 16. Единый план изучения газовых законовОпределение и условия
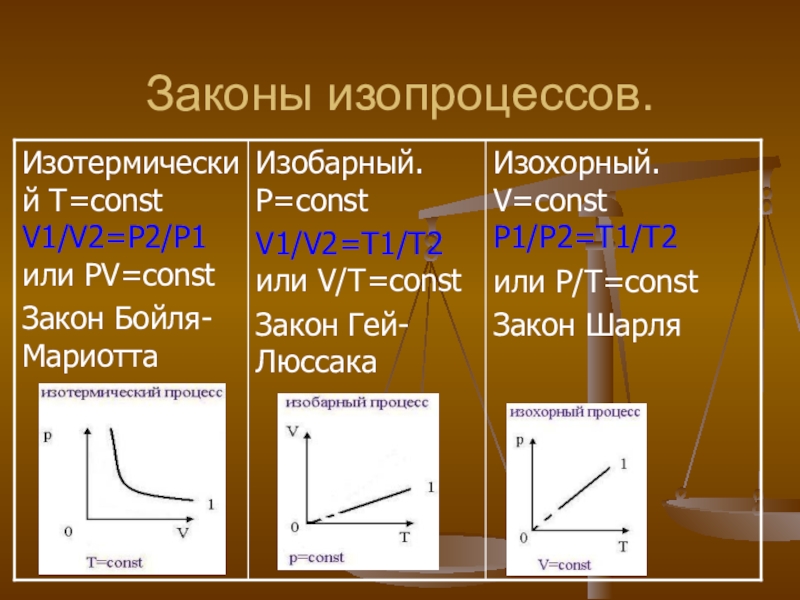
- 17. Законы изопроцессов.
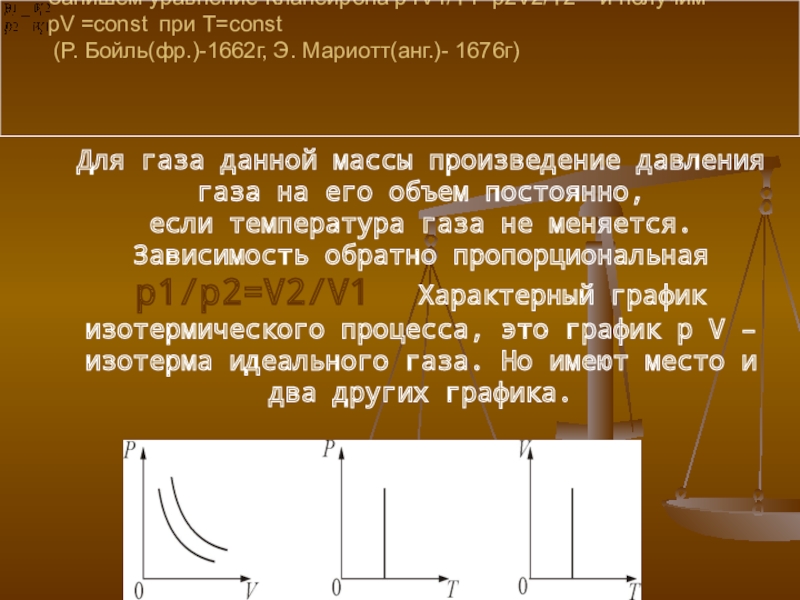
- 18. Закон Бойля-Мариотта(изотермический процесс)
- 19. Бойль (Boyle) Роберт (25.I.1627–30.XII.1691)Английский физики химик,
- 20. Независимо от Бойля, этот закон был открыт
- 21. Границы применимости.Закон Бойля – Мариотта является приближенным,
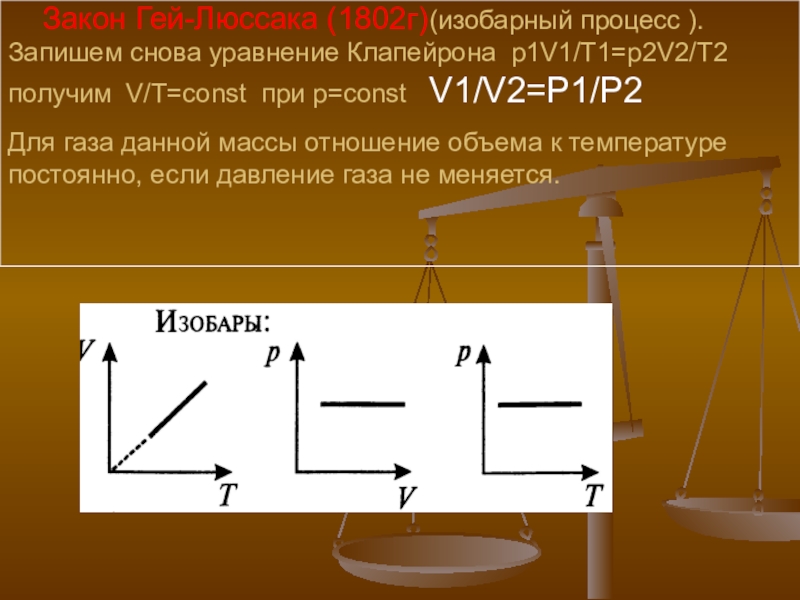
- 22. Закон Гей-Люссака (1802г)(изобарный процесс ).
- 23. Гей-Люссак (Gay-Lussac) Жозеф Луи (6.XII.1778–9.V.1850)Французский химик
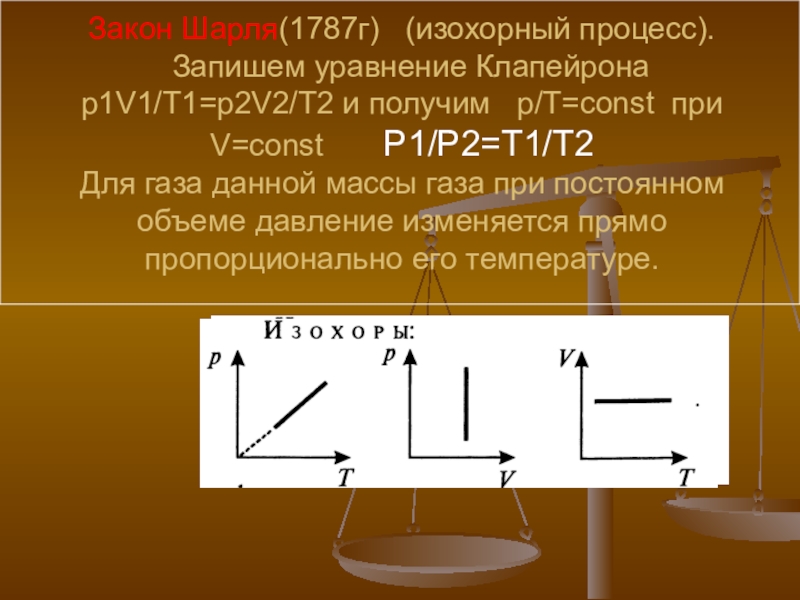
- 24. Закон Шарля(1787г) (изохорный
- 25. Жак Александр Сезар ШАРЛЬ1746–1823
- 26. Графики изопроцессов
- 27. Определись в своих знаниях и проверь свои
- 28. Определись в своих знаниях и проверь свои
- 29. Определись в своих знаниях и проверь свои
- 30. Выбери правильный ответ1) p=const V T2) T=const
- 31. Выбери правильный ответ1) p=const V T2) T=const
- 32. Выбери правильный ответ1) p=const V T2) T=const
- 33. Реши задачу Воздух под поршнем насоса имеет
- 34. Реши задачу Газ находится
- 35. Реши задачу Газ занимает объём 2м3 при
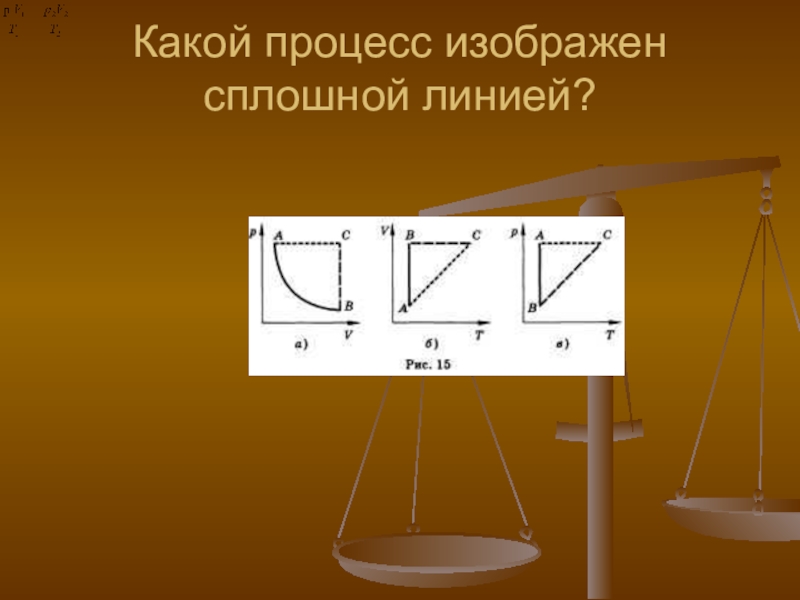
- 36. Какой процесс изображен сплошной линией?
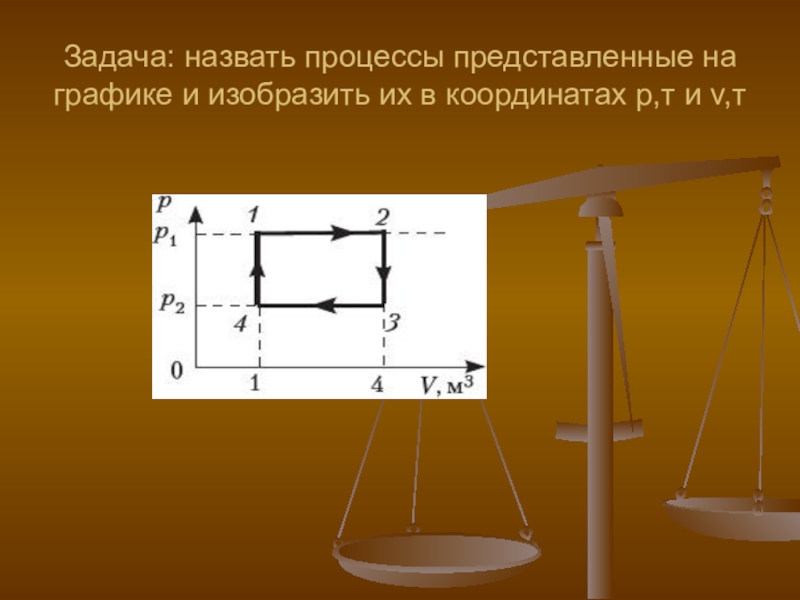
- 37. Задача: назвать процессы представленные на графике и изобразить их в координатах р,т и v,т
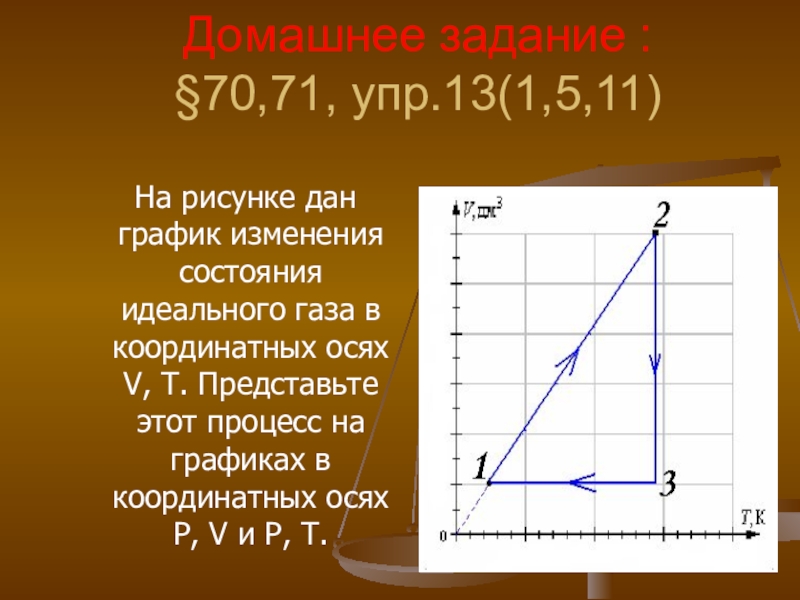
- 38. Домашнее задание : §70,71, упр.13(1,5,11) На
- 39. СПАСИБО ЗА УРОК
Слайд 3Цели урока.
1.Формировать у учащихся знания молекулярно-кинетической теории идеального газа; выявлять причинно-следственные
2. Формировать умения: извлекать информацию из прослушанного материала; работать с таблицами; действовать по образцу; переходить от общего к частному.
Слайд 4Задачи урока.
Образовательные: Изучить, используя групповой способ работы, изопроцессы. (история открытия, модель
Заполнить систематизирующую таблицу по изопроцессам;
Обобщить газовые законы. Начать обучение учащихся решать графические и аналитические задачи, используя уравнение состояния и газовые законы.
Слайд 5Воспитательные
Продолжить формирование познавательного интереса учащихся;
В целях интернационального воспитания обратить внимание учащихся,
Продолжить формировать стремления к глубокому усвоения теоретических знаний через решение задач;
Слайд 6Развивающие
Развивать осознание личностного смысла учения;
желания самостоятельно углубить свои знания по
Продолжить работу по развитию мышления и мировоззрения школьников.
Содействовать осознанию учащимися ценностей совместной деятельности на уроке.
Осуществляя проблемно-поисковый метод самостоятельно получить уравнения законов изопроцесса.
Развивать умения применять полученные знания в нестандартных ситуациях для решения графических и аналитических задач;
Продолжить формирование умения рационально решать сложные задачи
Слайд 7Тип урока – Формирование новых знаний.
Структура урока
Актуализация знаний.
Мотивация знаний.
Изучение нового материала.
Закрепление.
Домашнее
Слайд 8Актуализация знаний.
Мы изучаем основы МКТ идеального газа.
1.Какой газ называют идеальным?
2.Как
3.Почему это уравнение называют основным?
4.Как создается давление газа на дно и стенки сосуда?
5.Какое уравнение доказывает, что температура - есть мера средней кинетической энергии хаотического движения молекул.
6.Как давление связан с температурой?
7. Что такое концентрация молекул?
8.Получить уравнение состояния идеального газа?
Слайд 12Получим уравнение, которое связывает все три термодинамических параметра, при постоянной массе. Применим
Слайд 13Уравнение Клапейрона.
Задача урока: Применить это уравнение для различных изопроцессов и получить
Изопроцесс – это процесс происходящий в термодинамической системе, когда один из параметров остается неизменным, а два других меняются.
Эту зависимость определяют газовые законы.
Слайд 14Тема урока: Газовые законы.
Цель урока:
Используя уравнение Клапейрона получить количественную зависимость
Слайд 16
Единый план изучения газовых законов
Определение и условия осуществления процесса.
Уравнение и формулировка
Историческая справка.
Экспериментальное исследование справедливости закона.
Графическое изображение процесса.
Границы применимости закона.
Слайд 18 Закон Бойля-Мариотта(изотермический процесс)
Для газа данной массы произведение давления газа на его объем постоянно,
если температура газа не меняется.
Зависимость обратно пропорциональная
p1/p2=V2/V1 Характерный график изотермического процесса, это график p V –изотерма идеального газа. Но имеют место и два других графика.
Слайд 19Бойль (Boyle) Роберт
(25.I.1627–30.XII.1691)
Английский физик
и химик, член
Лондонского
королевского общества.
Работы Бойля
газов помогли ему
сформулировать закон
взаимосвязи между
объемом
газа и его давлением.
Слайд 20Независимо от Бойля, этот закон был открыт французским ученым Эдмом Мариоттом
Слайд 21Границы применимости.
Закон Бойля – Мариотта является приближенным, строго выполняется только для
С увеличением давления объем меняется медленнее, чем это следует из закона Бойля – Мариотта.
Объясняется это тем, что при больших давлениях молекулы сближаются и взаимодействием их друг с другом пренебречь нельзя.
Слайд 22 Закон Гей-Люссака (1802г)(изобарный процесс ). Запишем снова уравнение
Слайд 23Гей-Люссак (Gay-Lussac) Жозеф Луи
(6.XII.1778–9.V.1850)
Французский химик и
физик, член АН в Париже
(1806).
В 1802, независимо от
Дж. Дальтона, Гей-
Люссак открыл закон
теплового расширения
газов.
Слайд 24 Закон Шарля(1787г) (изохорный процесс). Запишем уравнение Клапейрона p1V1/T1=p2V2/T2 и получим
Слайд 25Жак Александр Сезар ШАРЛЬ1746–1823
Заинтересовавшись воздухоплаванием, подъемная сила которых обусловлена расширением нагретого горелкой воздуха внутри шара. Он же одним из первых стал наполнять воздушные шары водородом (который во много раз легче воздуха и обеспечивает значительно большую подъемную силу, нежели горячий воздух). Именно занятия воздухоплаванием заставили Шарля заинтересоваться исследованиями свойств газов.
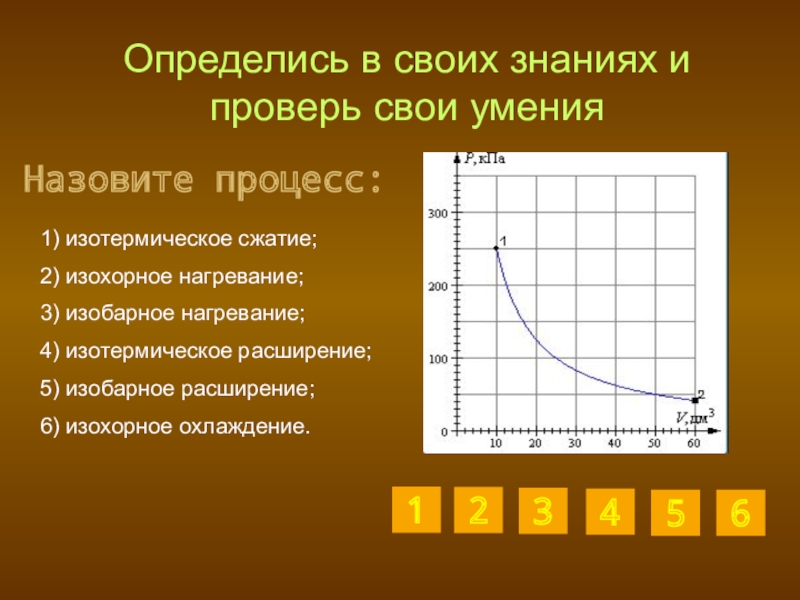
Слайд 27Определись в своих знаниях и проверь свои умения
1) изотермическое сжатие;
2)
3) изобарное нагревание;
4) изотермическое расширение;
5) изобарное расширение;
6) изохорное охлаждение.
4
2
6
5
1
3
Назовите процесс:
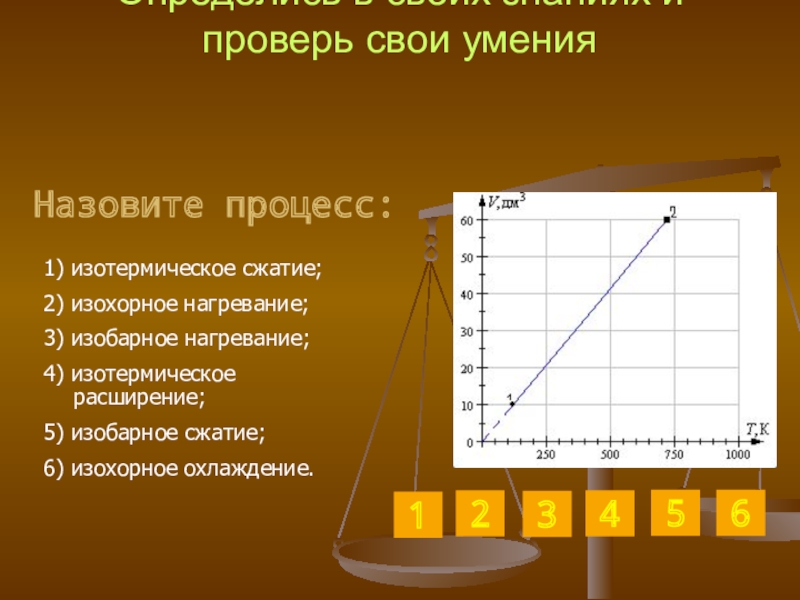
Слайд 28Определись в своих знаниях и проверь свои умения
1) изотермическое сжатие;
2)
3) изобарное нагревание;
4) изотермическое расширение;
5) изобарное сжатие;
6) изохорное охлаждение.
3
2
6
5
1
4
Назовите процесс:
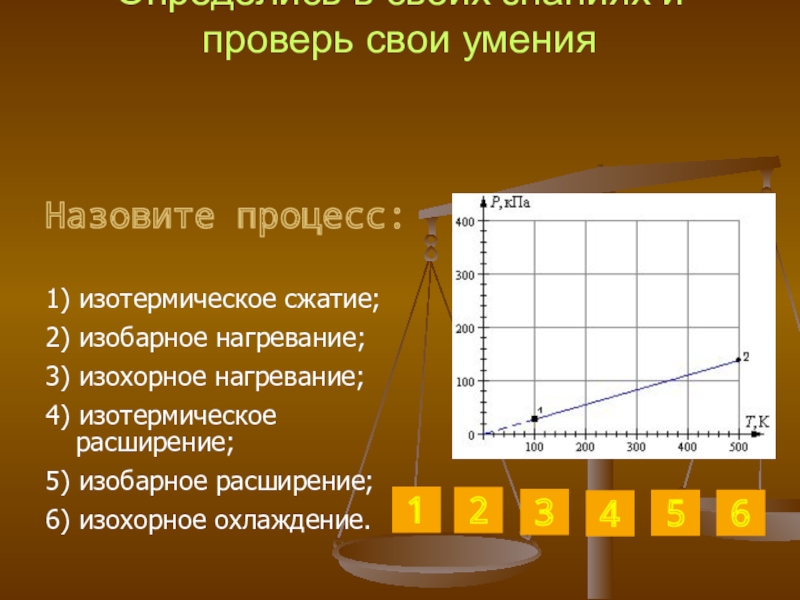
Слайд 29Определись в своих знаниях и проверь свои умения
1) изотермическое сжатие;
2)
3) изохорное нагревание;
4) изотермическое расширение;
5) изобарное расширение;
6) изохорное охлаждение.
3
2
6
5
1
4
Назовите процесс:
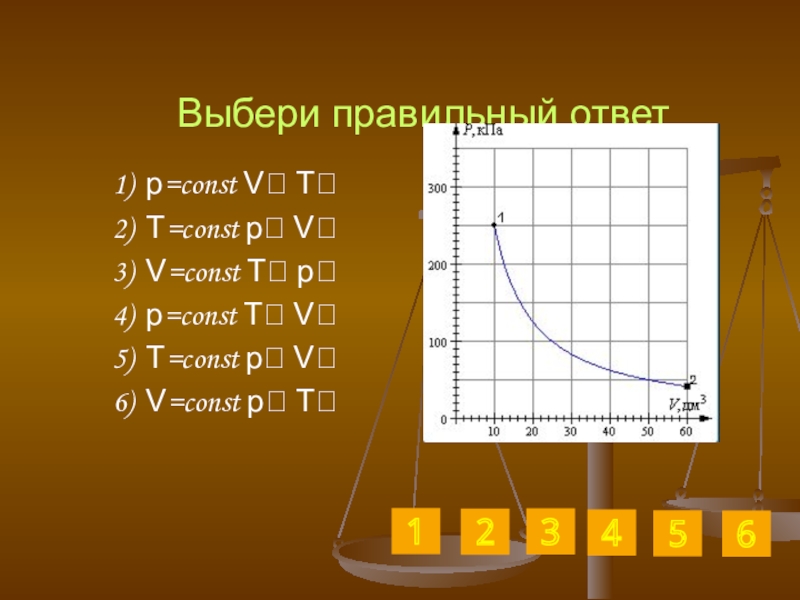
Слайд 30Выбери правильный ответ
1) p=const V T
2) T=const p V
3) V=const T
4) p=const T V
5) T=const p V
6) V=const p T
1
2
3
4
5
6
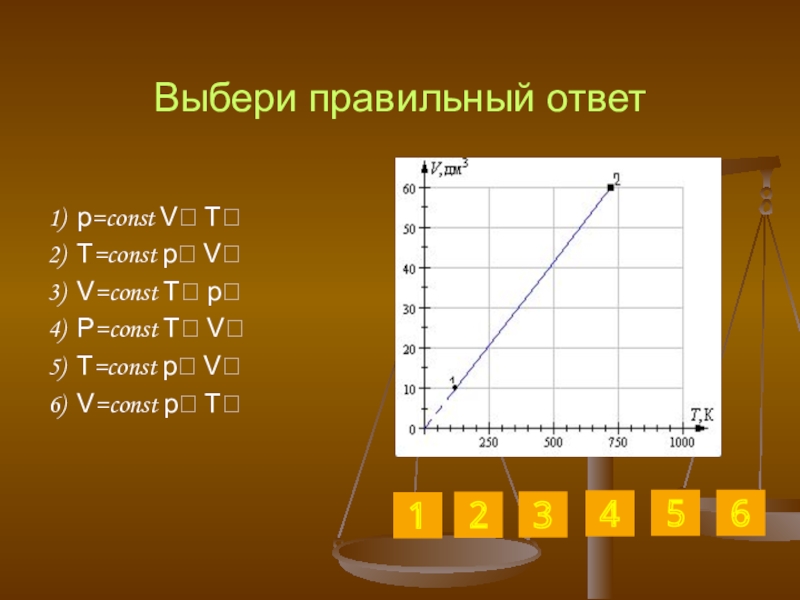
Слайд 31Выбери правильный ответ
1) p=const V T
2) T=const p V
3) V=const T
4) P=const T V
5) T=const p V
6) V=const p T
1
2
6
5
3
4
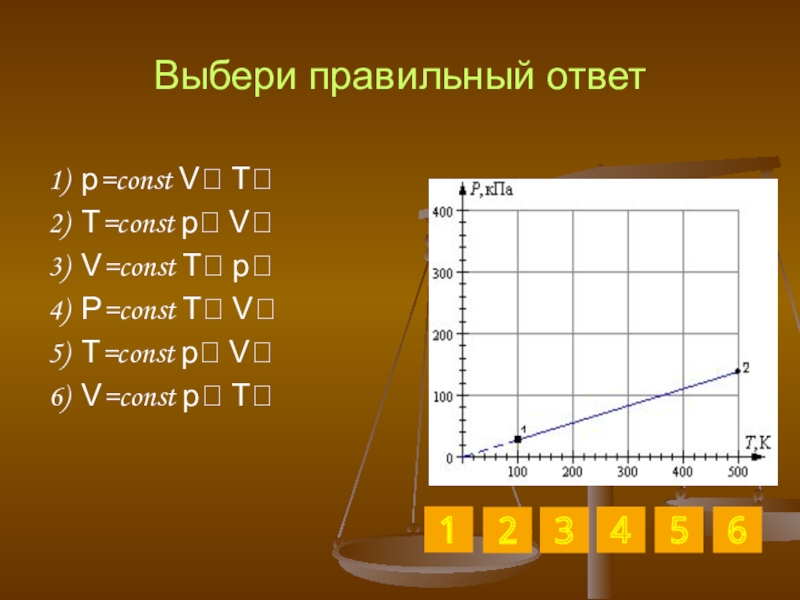
Слайд 32Выбери правильный ответ
1) p=const V T
2) T=const p V
3) V=const T
4) P=const T V
5) T=const p V
6) V=const p T
3
2
6
5
1
4
Слайд 33Реши задачу
Воздух под поршнем насоса имеет давление 105 Па и
1) 0,5*105 Па; 3) 2*104 Па; 5) 3*105 Па;
2) 5*104 Па; 4) 2*105 Па; 6) 3,9*105 Па
5
2
6
1
4
3
Слайд 34Реши задачу
Газ находится в баллоне при температуре
1) 100К; 3) 248К; 5) 456К;
2) 284К; 4) 123К; 6) 789К
5
2
6
1
3
4
Слайд 35Реши задачу
Газ занимает объём 2м3 при температуре 273K. Каков будет
1) 3,5м3; 3) 2,5м3; 5) 3м3;
2) 1м3; 4) 4м3; 6) 1,5м3
5
2
6
1
3
4