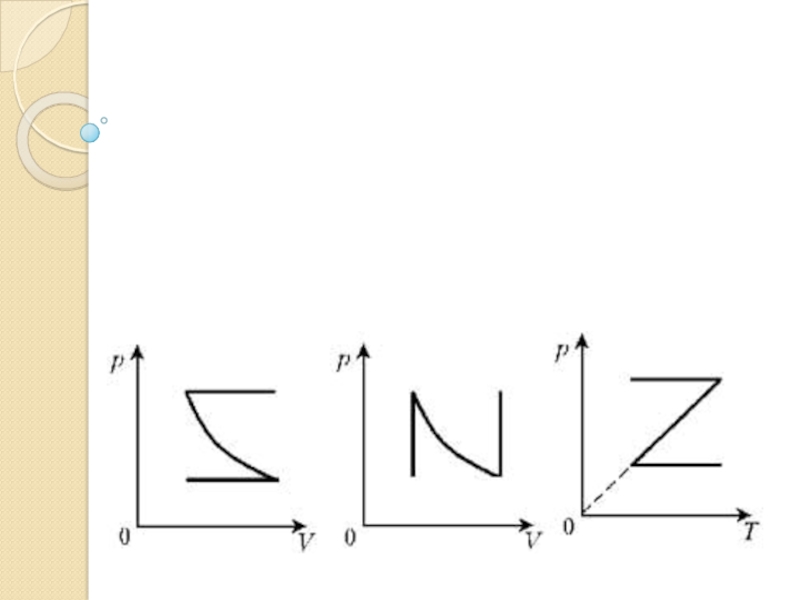МОУ СОШ №9 г Ртищево Саратовской области Митрофановой С.Д.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку по теме Изопропроцессы
Содержание
- 1. Презентация к уроку по теме Изопропроцессы
- 2. Цели урока: -установить связь
- 3. Оборудование.ПК, презентация.
- 4. Ход урока.1.Орг.момент.2.Проверка знаний учащихся.3.Изучение новой темы.4.Закрепление.5. Д\з.6.Итоги урока.
- 5. Проверка знаний учащихся. 1.Теоретические вопросы.2.Тестирование по теме
- 6. Теоретические вопросы.1.Что такое идеальный газ? 2. Назовите
- 7. Правильные ответы.1.Идеальным газом называется модель реального газа.
- 8. Тестирование по теме «Основы молекулярно – кинетической теории строения вещества.»Правильные ответы.
- 9. Задачи на уравнение состояния идеального газа.
- 10. Верное решение.1) Дано: V1=V; V2=V/4; T1=T;
- 11. Верное решение.2) Дано: нормальное атмосферное давление p0=1,013·105
- 12. Новая тема. Проблемный вопрос. Как установить
- 13. Закон Бойля-Мариотта Первый газовый закон был
- 14. Слайд 14
- 15. Изотерма График этого уравнения в системе
- 16. Слайд 16
- 17. Слайд 17
- 18. Закон Гей-Люссака Второй газовый закон был открыт
- 19. Слайд 19
- 20. Изобара Из уравнения видно, что график
- 21. Слайд 21
- 22. Слайд 22
- 23. Закон Шарля. Третий газовый закон был
- 24. Слайд 24
- 25. Изохора. Зависимость Р от Т имеет вид
- 26. Слайд 26
- 27. Слайд 27
- 28. Закрепление.
- 29. Домашнее задание. Пар.78. Построить графики изопроцессов ( см. рис.) в других координатных осях.
- 30. Слайд 30
Цели урока: -установить связь между двумя термодинамическими параметрами при неизменном третьем параметре экспериментальным и теоретическим способами; -показать графическую интерпретацию изопроцессов; - Начать обучение учащихся решать аналитические и графические задачи, используя уравнение состояния и
Слайд 2
Цели урока:
-установить связь между двумя термодинамическими параметрами при неизменном третьем параметре
экспериментальным и теоретическим способами;
-показать графическую интерпретацию изопроцессов;
- Начать обучение учащихся решать аналитические и графические задачи, используя уравнение состояния и газовые законы.
-показать графическую интерпретацию изопроцессов;
- Начать обучение учащихся решать аналитические и графические задачи, используя уравнение состояния и газовые законы.
Слайд 4Ход урока.
1.Орг.момент.
2.Проверка знаний учащихся.
3.Изучение новой темы.
4.Закрепление.
5. Д\з.
6.Итоги урока.
Слайд 5Проверка знаний учащихся.
1.Теоретические вопросы.
2.Тестирование по теме «Основы молекулярно – кинетической теории
строения вещества.»
3.Задачи на уравнение состояния идеального газа.
3.Задачи на уравнение состояния идеального газа.
Слайд 6Теоретические вопросы.
1.Что такое идеальный газ?
2. Назовите условия, при которых газ
можно считать идеальным?
3. Что называется концентрацией?
4. Запишите и объясните физический смысл основного уравнения молекулярно-кинетической теории.
5. Какие параметры, характеризующие газ и процессы, проходящие в нем, называются микроскопическими параметрами (микропараметрами).
6. Какие параметры, характеризующие газ, и процессы, проходящие в нем, называются макроскопическими параметрами (макропараметрами)?
7. Если состояние газа не меняется, то не меняются и эти параметры. Назовите макропараметры, характеризующие газ?
3. Что называется концентрацией?
4. Запишите и объясните физический смысл основного уравнения молекулярно-кинетической теории.
5. Какие параметры, характеризующие газ и процессы, проходящие в нем, называются микроскопическими параметрами (микропараметрами).
6. Какие параметры, характеризующие газ, и процессы, проходящие в нем, называются макроскопическими параметрами (макропараметрами)?
7. Если состояние газа не меняется, то не меняются и эти параметры. Назовите макропараметры, характеризующие газ?
Слайд 7Правильные ответы.
1.Идеальным газом называется модель реального газа. Молекулярно-кинетическая теория рассматривает идеальный
газ как множество частиц (молекул), расстояние между которыми намного превышает размеры самих частиц, находящихся в состоянии непрерывного хаотичного движения.
2. Газ, удовлетворяющий следующим условиям:
Межмолекулярные взаимодействия отсутствуют.
Взаимодействия молекул газа происходит только при соударениях, и являются упругими.
Молекулы газа не имеют объема – материальные точки.
3.Концентрация – это число молекул в единице объема.
4.Давление идеального газа обусловлено ударами молекул о стенку сосуда, поэтому с помощью молекулярно-кинетической теории его можно выразить через концентрацию молекул, средние скорости молекул и массу одной молекулы. p=⅓nmoυ2 - основное уравнение МКТ (уравнение Клаузиуса), устанавливает связь между микро- и макромиром.
5.Состояние идеального газа и процессы, проходящие в нем, будут определяться количеством частиц (молекул), из которых состоит газ, и их параметрами, такими как масса, диаметр, скорость, энергия и пр. (слайд 4) Такие параметры называются микроскопическими или микропараметрами.
6. Параметры, характеризующие свойства газа как целого называются макроскопическими или макропараметрами.
7. Р – давление, V – объем, T – температура.
2. Газ, удовлетворяющий следующим условиям:
Межмолекулярные взаимодействия отсутствуют.
Взаимодействия молекул газа происходит только при соударениях, и являются упругими.
Молекулы газа не имеют объема – материальные точки.
3.Концентрация – это число молекул в единице объема.
4.Давление идеального газа обусловлено ударами молекул о стенку сосуда, поэтому с помощью молекулярно-кинетической теории его можно выразить через концентрацию молекул, средние скорости молекул и массу одной молекулы. p=⅓nmoυ2 - основное уравнение МКТ (уравнение Клаузиуса), устанавливает связь между микро- и макромиром.
5.Состояние идеального газа и процессы, проходящие в нем, будут определяться количеством частиц (молекул), из которых состоит газ, и их параметрами, такими как масса, диаметр, скорость, энергия и пр. (слайд 4) Такие параметры называются микроскопическими или микропараметрами.
6. Параметры, характеризующие свойства газа как целого называются макроскопическими или макропараметрами.
7. Р – давление, V – объем, T – температура.
Слайд 8Тестирование по теме «Основы молекулярно – кинетической теории строения вещества.»
Правильные ответы.
Слайд 9Задачи на уравнение состояния идеального газа.
№1.
Как измениться давление газа
при уменьшении в 4 раза его объема и увеличении температуры в 1,5 раза.?
№2.
Оцените число молекул воздуха, находящегося в классе, при нормальном атмосферном давлении и температуре 20 оС. (V = 216 кубич.метров)
№2.
Оцените число молекул воздуха, находящегося в классе, при нормальном атмосферном давлении и температуре 20 оС. (V = 216 кубич.метров)
Слайд 10 Верное решение.
1) Дано: V1=V; V2=V/4; T1=T; T2=1,5T;
Найти: p2/p1-?
Решение: pV=m/M R
T уравнение Менделеева – Клапейрона.
p1=m R T1/MV1 - первоначальное давление при T1.
p2=m R T2/MV2 давление газа при T2.
Найдем отношение p2/p1 .После подстановки , получим p2/p1=6.
Ответ: увеличится в 6 раз
p1=m R T1/MV1 - первоначальное давление при T1.
p2=m R T2/MV2 давление газа при T2.
Найдем отношение p2/p1 .После подстановки , получим p2/p1=6.
Ответ: увеличится в 6 раз
Слайд 11Верное решение.
2) Дано: нормальное атмосферное давление p0=1,013·105 Па; температура t=200С, или
Т0=293,15К, V= 12*6*3= 216м3;
Из формул p=nkT и n = N/V получаем N= nV= pV/kT/
Подставим N= (216·101300)/(293·1,38·10-23)= 72·1026 штук.
Ответ: N= 72·1026 штук/
Из формул p=nkT и n = N/V получаем N= nV= pV/kT/
Подставим N= (216·101300)/(293·1,38·10-23)= 72·1026 штук.
Ответ: N= 72·1026 штук/
Слайд 12Новая тема.
Проблемный вопрос. Как установить закономерности между макроскопическими параметрами
газа одной и той же массы?
Если одновременно меняются все характеристики состояния газа. То трудно установить какие-либо закономерности.
Вопрос. Как можно упростить решение данной проблемы?
Проще изучить процессы, в которых масса и один из трех макроскопических параметров остаются неизменными.
Определение: Процессы, протекающие при неизменном значении одного из параметров называются изопроцессами.
Они происходят в природе и осуществляются в технике при постоянной массе, m – const.
Если одновременно меняются все характеристики состояния газа. То трудно установить какие-либо закономерности.
Вопрос. Как можно упростить решение данной проблемы?
Проще изучить процессы, в которых масса и один из трех макроскопических параметров остаются неизменными.
Определение: Процессы, протекающие при неизменном значении одного из параметров называются изопроцессами.
Они происходят в природе и осуществляются в технике при постоянной массе, m – const.
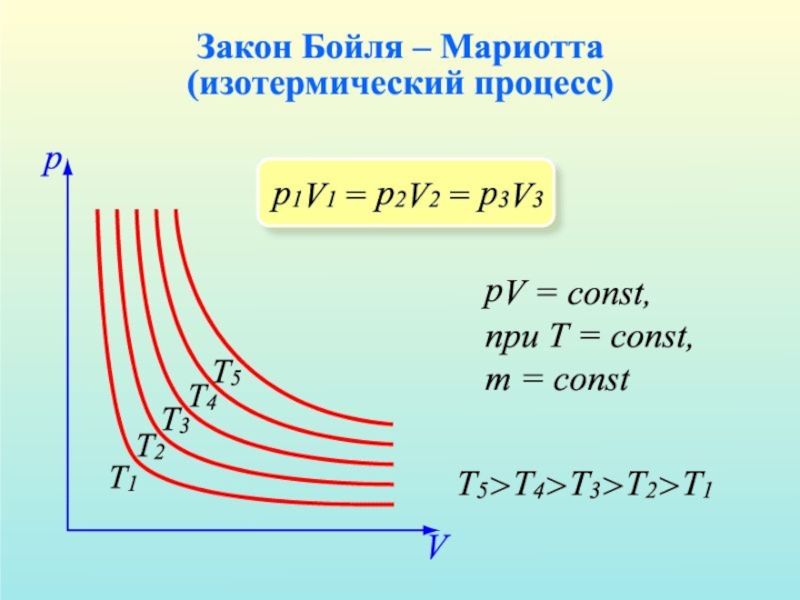
Слайд 13Закон Бойля-Мариотта
Первый газовый закон был открыт английским ученым Р.
Бойлем. (1627 – 1691 г.г.) в 1662 г. Работа называлась «Новые эксперименты, касающиеся воздушной пружины». Бойль изучал изменение давления газа в зависимости от объема при постоянной температуре. Данный процесс называется изотермическим.
Независимо от Бойля несколько позднее французский ученый Э. Мариотт пришел к тем же выводам. Поэтому закон получил название Бойля-Мариотта.
Изотермическим называется процесс, протекающий при постоянной температуре, Т- const.
Из уравнения состояния идеального газа следует, что при постоянной температуре произведение давления газа на его объем должно оставаться постоянным, т. е. PV – const.
Независимо от Бойля несколько позднее французский ученый Э. Мариотт пришел к тем же выводам. Поэтому закон получил название Бойля-Мариотта.
Изотермическим называется процесс, протекающий при постоянной температуре, Т- const.
Из уравнения состояния идеального газа следует, что при постоянной температуре произведение давления газа на его объем должно оставаться постоянным, т. е. PV – const.
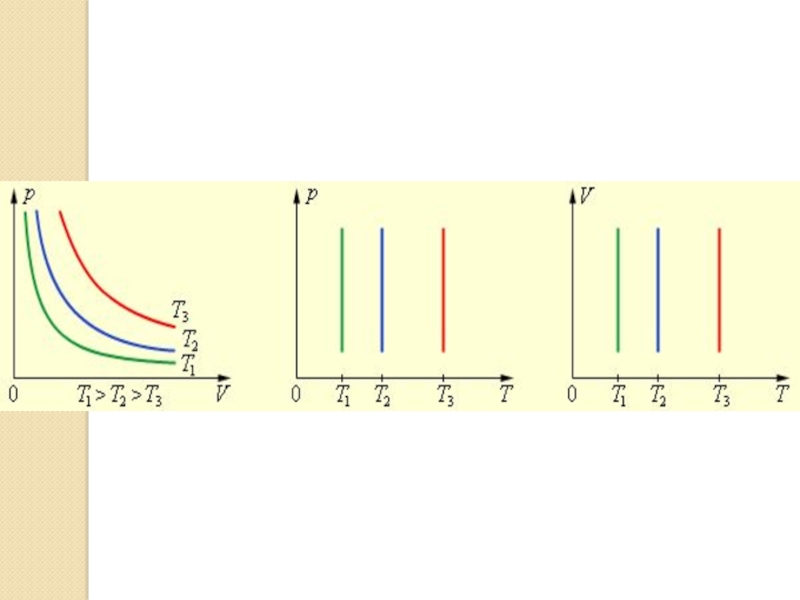
Слайд 15Изотерма
График этого уравнения в системе координат, где по оси
абсцисс отложен объем V, а по оси ординат – давление Р представляет собой гиперболу и называется изотермой.
Если мы будем брать изотермы для разных температур, то мы получим систему или семейство изотерм, где изотермы располагаются все выше и выше по мере возрастания температур
При одном и том же объеме V, чем выше температура, тем больше величина давления Р.
Изотермическим процессом приближенно можно считать процесс медленного сжатия воздуха или расширение газа под поршнем насоса при откачке его из сосуда.
Если мы будем брать изотермы для разных температур, то мы получим систему или семейство изотерм, где изотермы располагаются все выше и выше по мере возрастания температур
При одном и том же объеме V, чем выше температура, тем больше величина давления Р.
Изотермическим процессом приближенно можно считать процесс медленного сжатия воздуха или расширение газа под поршнем насоса при откачке его из сосуда.
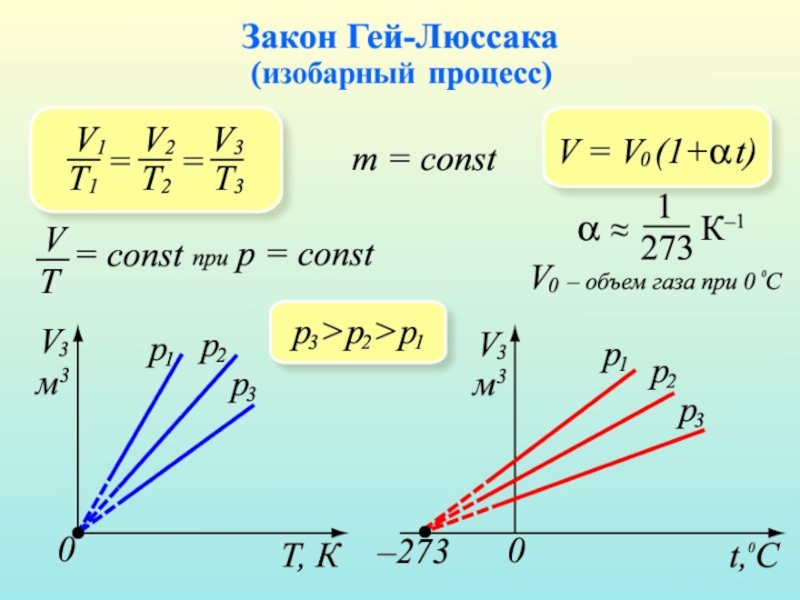
Слайд 18Закон Гей-Люссака
Второй газовый закон был открыт французским химиком и физиком,
иностранным почетным членом Петербургской академии наук (1829) Гей-Люссаком Жозефом Луи. Он в 1802 году установил зависимость объема идеального газа от температуры. Данный процесс называется изобарным.
Закон получил название закона Гей-Люссака.
Изобарным называется процесс, протекающий при неизменном давлении, Р - const.
Из уравнения состояния идеального газа следует, что уравнение изобарного процесса имеет вид: V/Т = const или V = constТ.
Закон получил название закона Гей-Люссака.
Изобарным называется процесс, протекающий при неизменном давлении, Р - const.
Из уравнения состояния идеального газа следует, что уравнение изобарного процесса имеет вид: V/Т = const или V = constТ.
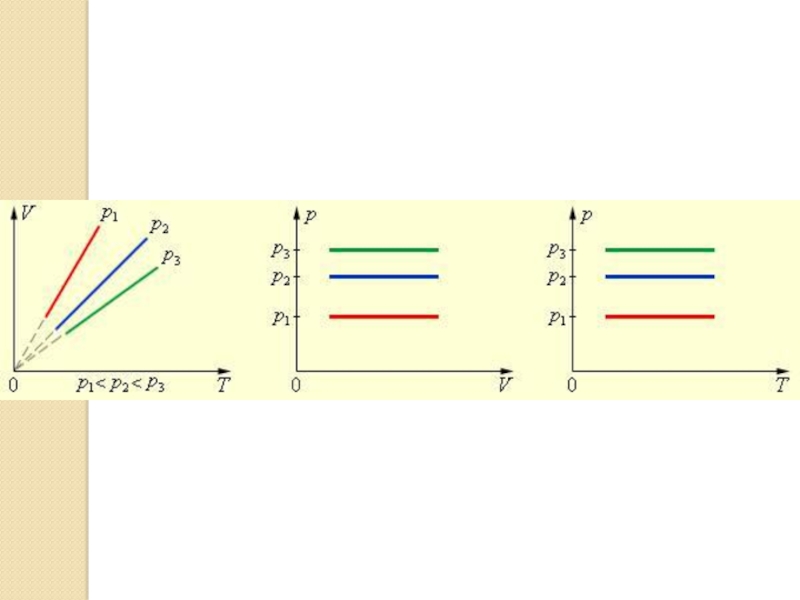
Слайд 20Изобара
Из уравнения видно, что график зависимости V от Т
имеет вид прямой, которая называется изобара.
При низких температурах эта зависимость не линейная, так как при определенной температуре газ превращается в жидкость.
Рассмотрим семейство графиков для разных давлений. При зафиксированной температуре большему значению Р соответствует меньшее значение V.
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем.
При низких температурах эта зависимость не линейная, так как при определенной температуре газ превращается в жидкость.
Рассмотрим семейство графиков для разных давлений. При зафиксированной температуре большему значению Р соответствует меньшее значение V.
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем.
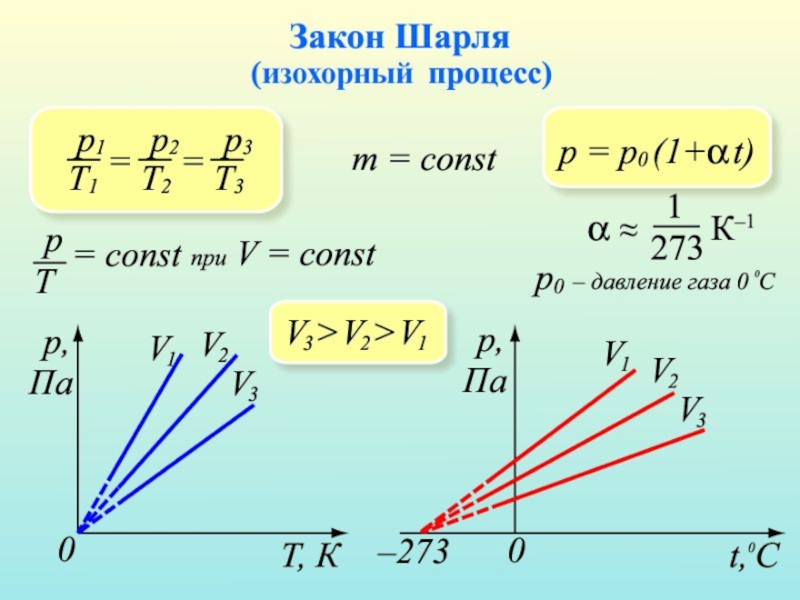
Слайд 23Закон Шарля.
Третий газовый закон был открыт французским физиком Шарлем
Жаком Александром Сезаром. Он в 1787 году установил зависимость давления идеального газа от температуры. Данный процесс называется изохорным.
Закон получил название закона Шарля.
Изохорным называется процесс, протекающий при неизменном объеме, V - const.
Из уравнения состояния идеального газа следует, что при постоянном объеме отношение давления газа к его температуре должно оставаться постоянным, т. е. уравнение изохорного процесса есть P деленная на Т = const или же Р равно константа умноженная на Т.
Закон получил название закона Шарля.
Изохорным называется процесс, протекающий при неизменном объеме, V - const.
Из уравнения состояния идеального газа следует, что при постоянном объеме отношение давления газа к его температуре должно оставаться постоянным, т. е. уравнение изохорного процесса есть P деленная на Т = const или же Р равно константа умноженная на Т.
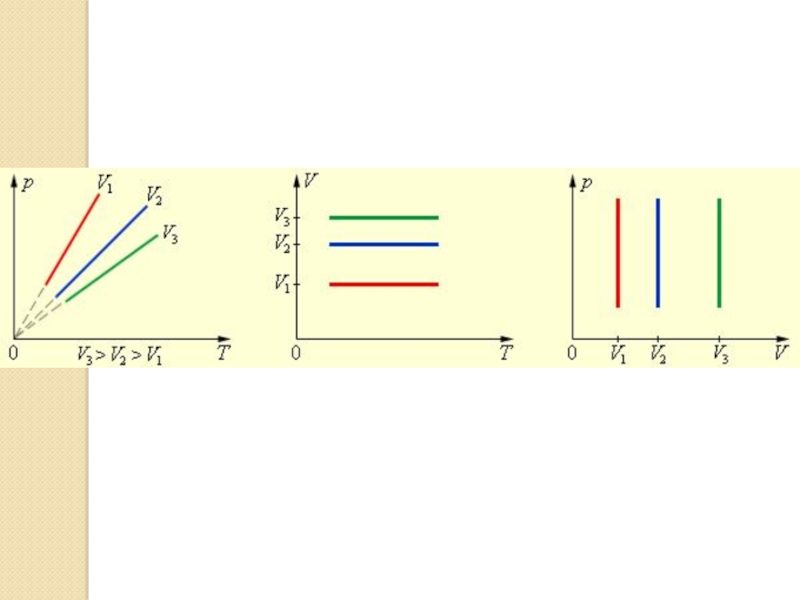
Слайд 25Изохора.
Зависимость Р от Т имеет вид прямой, которая называется изохора.
При низких температурах эта зависимость не линейная, так как при определенной температуре газ превращается в жидкость.
Если мы рассмотрим два графика изохоры, то заметим, что большему значению Р соответствует меньшее значение V, при фиксированной температуре.
Увеличение давления газа в любой емкости или в электрической лампочке при нагревании является изохорным процессом.
Если мы рассмотрим два графика изохоры, то заметим, что большему значению Р соответствует меньшее значение V, при фиксированной температуре.
Увеличение давления газа в любой емкости или в электрической лампочке при нагревании является изохорным процессом.
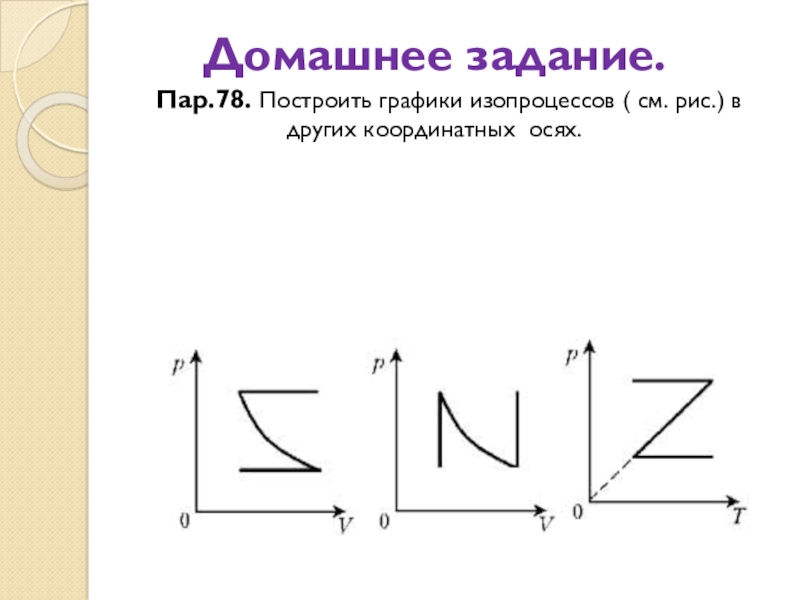
Слайд 29Домашнее задание. Пар.78. Построить графики изопроцессов ( см. рис.) в
других координатных осях.