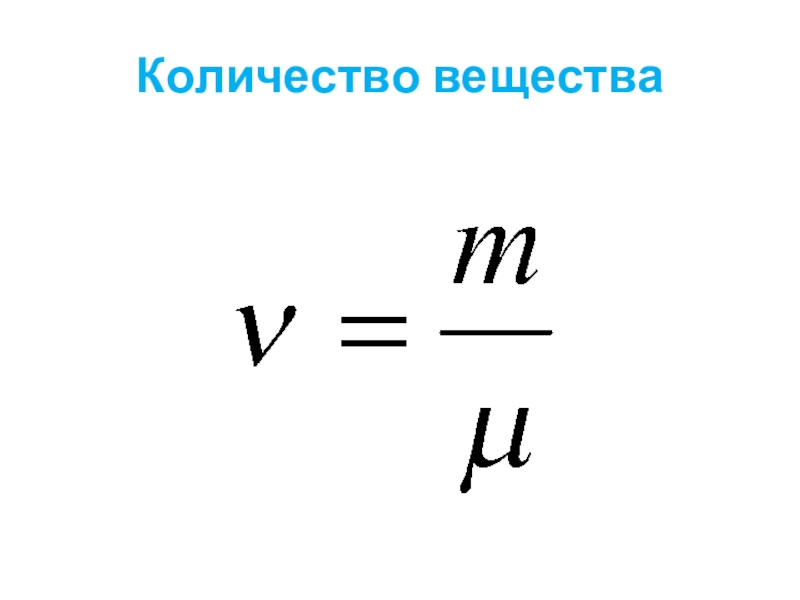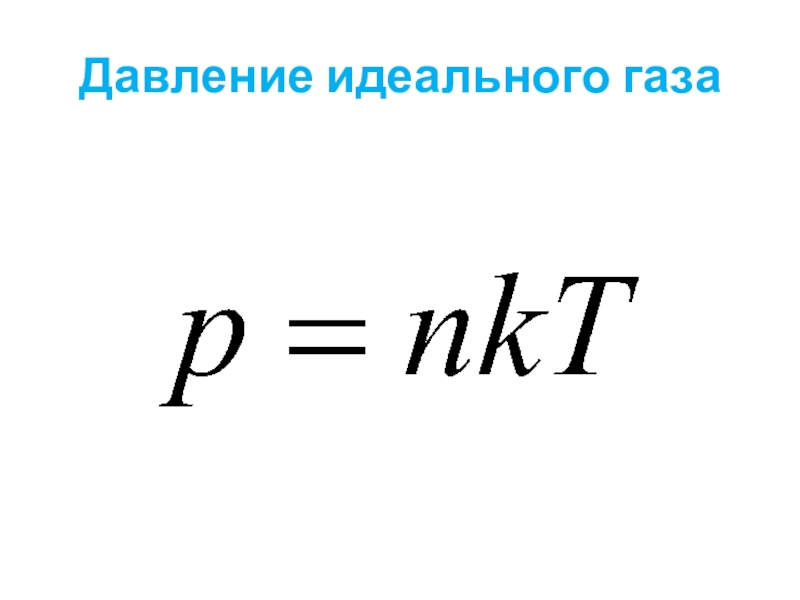- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку: Молекулярная физика Термодинамика
Содержание
- 1. Презентация к уроку: Молекулярная физика Термодинамика
- 2. Молекулярная физика и термодинамика - разделы физики,
- 3. Молекулярная физикаявляется статистической теорией, т. е. рассматривает поведение систем,
- 4. Термодинамикаявляется наукой феноменологической. делает выводы о свойствах вещества
- 5. Оба подхода – термодинамический и статистический –
- 6. Основные положения МКТВсе вещества образованы из мельчайших
- 7. Основные положения МКТ
- 8. Основные положения МКТАтомы и молекулы находятся в
- 9. Подтверждение МКТЭкспериментальное - механическое дробление вещества; растворение
- 10. Подтверждение МКТ2. Прямое– фотографирование, определение размеров частиц.
- 11. Броуновское движениеБроуновское движение - тепловое движение мельчайших
- 12. Причина броуновского движенияБроуновские частицы движутся под влиянием
- 13. Диффузия Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга.
- 14. Скорость диффузииАгрегатное состояние веществаТемпература вещества
- 15. Относительная молекулярная масса Относительная молекулярная масса простого или
- 16. Один моль вещества 1 Моль — это количество вещества, содержащее
- 17. Постоянная Авогадро Количество структурных единиц, содержащихся в одном моле вещества определяет число Авогадро NA= 6,023 ·1023моль−1
- 18. Количество вещества Количество вещества, содержащегося в теле, определяется числом молекул (или атомов) в этом теле.
- 19. Молярная масса Молярная масса – масса одного моля вещества
- 20. Количество вещества
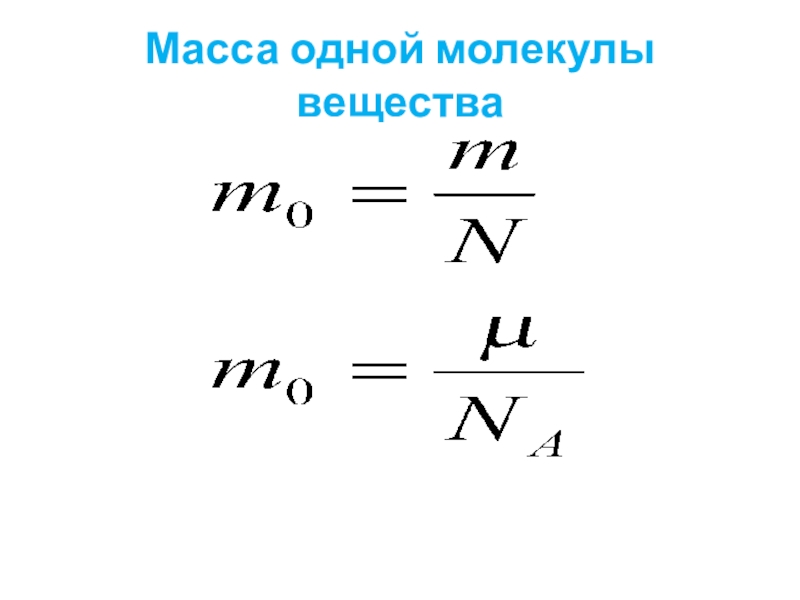
- 21. Масса одной молекулы вещества
- 22. Таблица Менделеева
- 23. Идеальный газ
- 24. Идеальный газа) Собственный объем молекул газа пренебрежимо
- 25. Основное уравнение молекулярно-кинетической теории идеального газа
- 26. Давление идеального газа
- 27. Давление идеального газа
- 28. Средняя кинетическая энергия
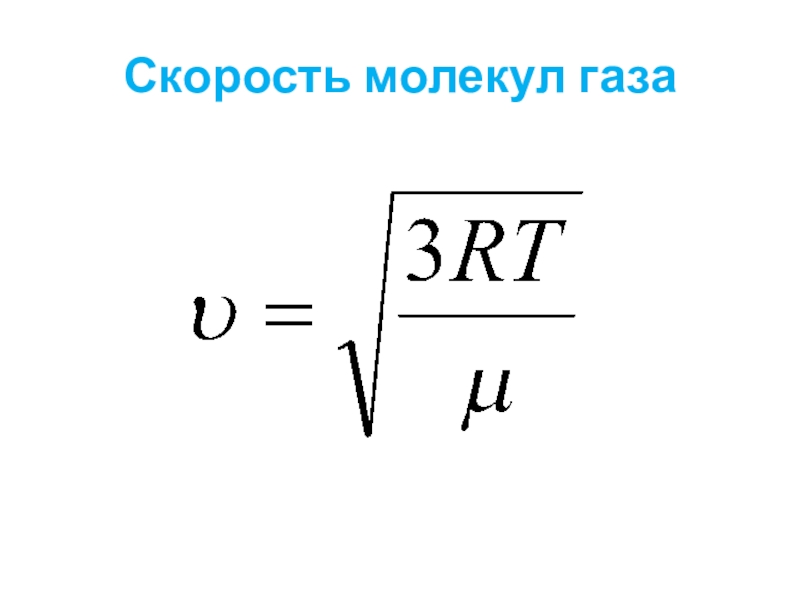
- 29. Скорость молекул газа
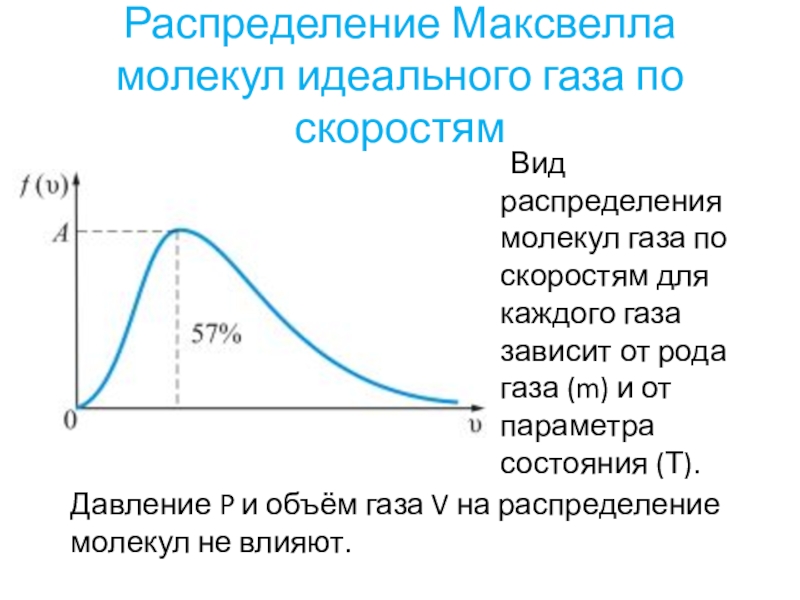
- 30. Распределение Максвелла молекул идеального газа по скоростям Вид
- 31. Термодинамические параметры параметры состояниятемпература, плотность, давление, объем,
- 32. Уравнение Менделеева - Клапейрона Физическое состояние массы газа
- 33. Уравнение Менделеева – КлапейронаУравнение состояния позволяет определить
- 34. Газовые законы Газовыми законами называются количественные зависимости между двумя макроскопическими параметрами при фиксированном значении третьего параметра
- 35. Изопроцессы Изопроце́ссы — термодинамические процессы, во время которых количество вещества
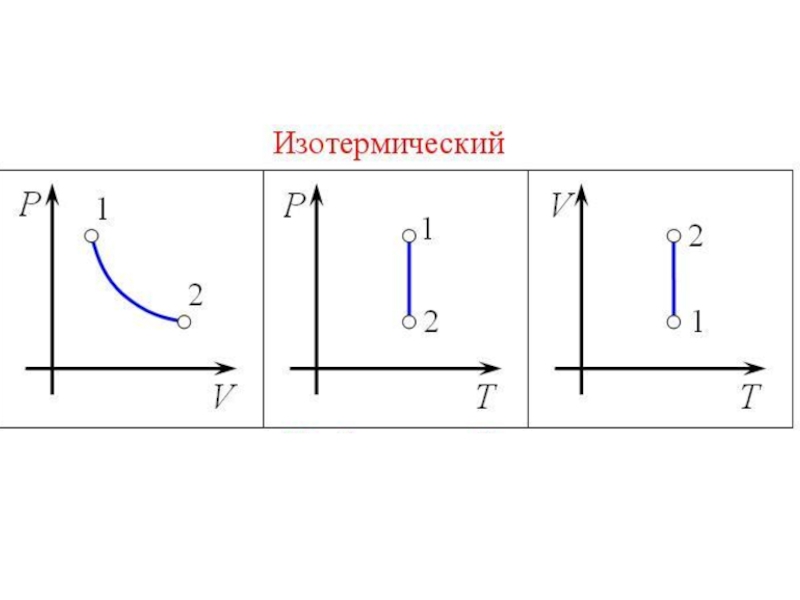
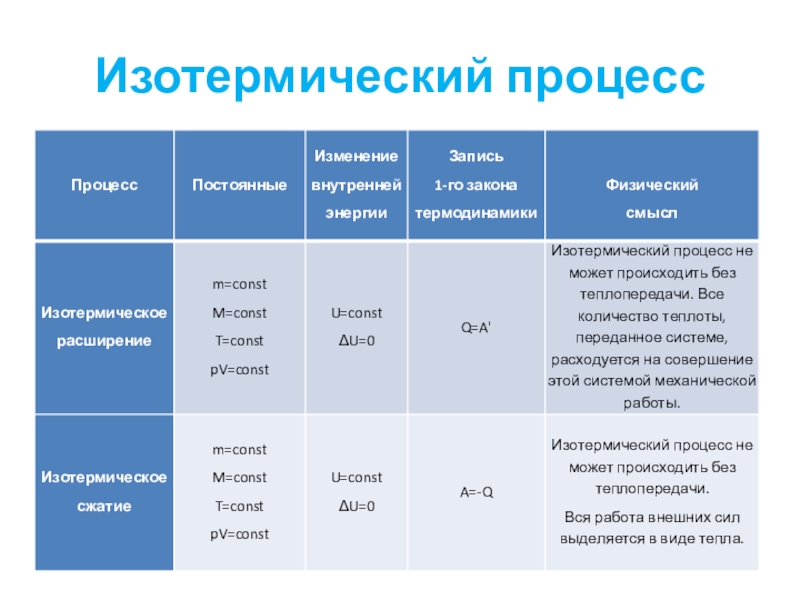
- 36. Изотермический процесс
- 37. Слайд 37
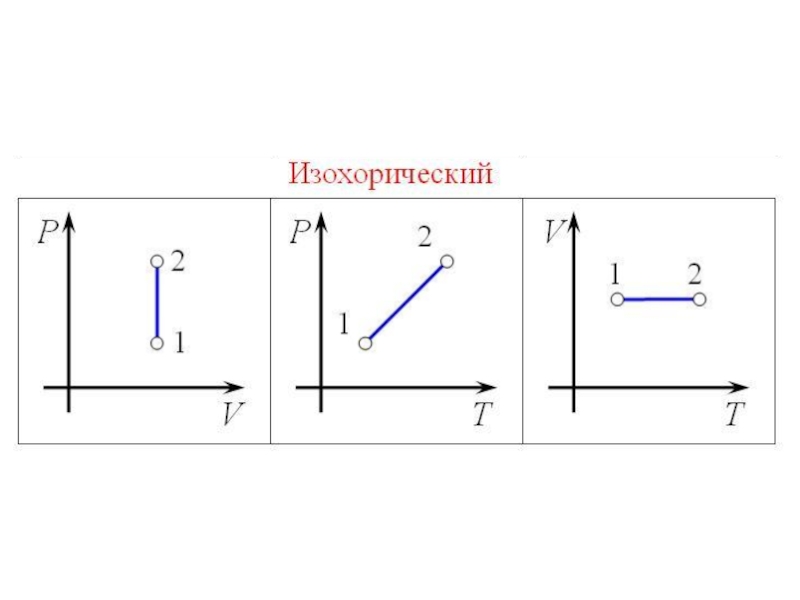
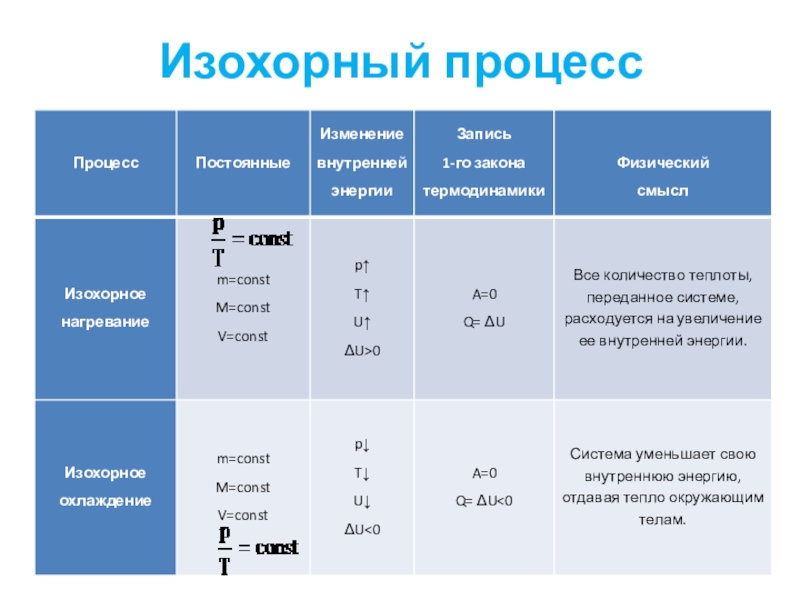
- 38. Изохорный процесс
- 39. Слайд 39
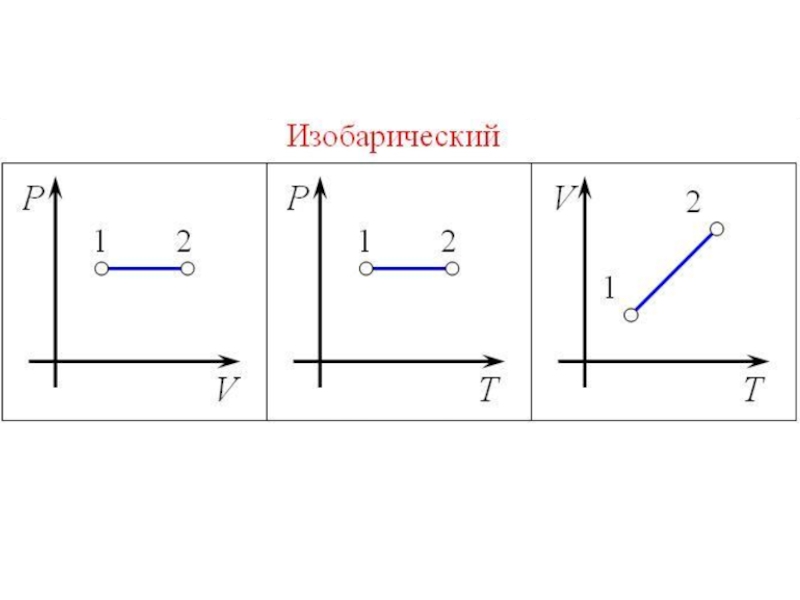
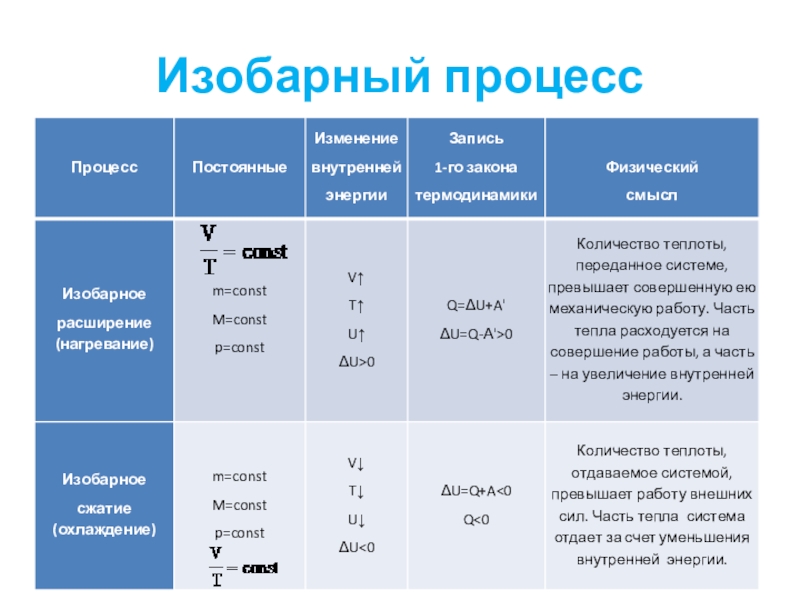
- 40. Изобарный процесс
- 41. Слайд 41
- 42. Термодинамика
- 43. Внутренняя энергия
- 44. Способы изменения внутренней энергииВнутреннюю энергию можно
- 45. Виды теплообменаТеплопроводностьКонвекцияЛучистые теплообмен
- 46. ТеплопроводностьТеплопроводность - это способ теплопередачи, при котором
- 47. ОсобенностиМожет происходить в твердых, жидких газообразных веществах;Лучше
- 48. КонвекцияКонвекция - это способ теплопередачи, при котором тепло передается от нагревателя восходящими струями газа
- 49. Особенности Конвекция может наблюдаться только в жидкостях и
- 50. Лучистый теплообменЛучистый теплообмен - это способ передачи тепла от нагревателя посредством испускания лучей.
- 51. ОсобенностиЧем выше температура источника тепла, тем излучение
- 52. Количество теплоты
- 53. Термодинамика В основе термодинамики лежат 3 фундаментальных закона,
- 54. Нулевое (или общее) начало термодинамики Замкнутая система независимо
- 55. Первое начало термодинамики Закон сохранения энергии в применении
- 56. Работа газа
- 57. Работа газаРабота численно равна площади под графиком
- 58. Количество теплотыКоличество теплоты- количественная мера изменения внутренней энергии при теплообмене
- 59. Второе начало термодинамики Накладывает ограничения на направление термодинамических
- 60. Необратимость процессов в природе
- 61. Применение первого закона термодинамики к изопроцессам
- 62. Изотермический процесс
- 63. Изохорный процесс
- 64. Изобарный процесс
- 65. Спасибо за внимание.
Молекулярная физика и термодинамика - разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул
Слайд 2 Молекулярная физика и термодинамика - разделы физики, в которых изучаются макроскопические
процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул
Слайд 3Молекулярная физика
является статистической теорией, т. е. рассматривает поведение систем, состоящих из огромного числа
частиц (атомов, молекул), на основе вероятностных моделей.
стремится на основе статистического подхода установить связь между экспериментально измеренными макроскопическими величинами (давление, объем, температура и т.д.) и микроскопическими характеристиками частиц, входящих в состав системы (масса, импульс, энергия и т.д.)
стремится на основе статистического подхода установить связь между экспериментально измеренными макроскопическими величинами (давление, объем, температура и т.д.) и микроскопическими характеристиками частиц, входящих в состав системы (масса, импульс, энергия и т.д.)
Слайд 4Термодинамика
является наукой феноменологической.
делает выводы о свойствах вещества на основе законов, установленных
на опыте, таких, как закон сохранения энергии.
оперирует только с макроскопическими величинами (давление, температура, объем и т.п.), которые вводятся на основе физического эксперимента.
оперирует только с макроскопическими величинами (давление, температура, объем и т.п.), которые вводятся на основе физического эксперимента.
Слайд 5 Оба подхода – термодинамический и статистический – не противоречат, а дополняют
друг друга.
Только совместное использование термодинамики и молекулярно-кинетической теории может дать наиболее полное представление о свойствах систем, состоящих из большого числа частиц.
Только совместное использование термодинамики и молекулярно-кинетической теории может дать наиболее полное представление о свойствах систем, состоящих из большого числа частиц.
Слайд 6Основные положения МКТ
Все вещества образованы из мельчайших частиц – молекул, которые
сами состоят из атомов («элементарных молекул»).
Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов.
Молекулы и атомы представляют собой электрически нейтральные частицы.
При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов.
Молекулы и атомы представляют собой электрически нейтральные частицы.
При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Слайд 8Основные положения МКТ
Атомы и молекулы находятся в непрерывном хаотическом движении.
Частицы взаимодействуют
друг с другом силами, имеющими электрическую природу.
Гравитационное взаимодействие между частицами пренебрежимо мало.
Гравитационное взаимодействие между частицами пренебрежимо мало.
Слайд 9Подтверждение МКТ
Экспериментальное
- механическое дробление вещества; растворение вещества в воде; сжатие
и расширение газов; испарение; деформация тел; диффузия;
- диффузия; броуновское движение частиц в жидкости под ударами молекул;
- плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
Слайд 11Броуновское движение
Броуновское движение - тепловое движение мельчайших микроскопических частиц, взвешенных в
жидкости или газе.
Открыто английским ботаником Р. Броуном в 1827 г.
Теория броуновского движения была создана А. Эйнштейном в 1905 г.
Экспериментально теория Эйнштейна была подтверждена в опытах французского физика Ж. Перрена, проведенных в 1908–1911 гг.
Открыто английским ботаником Р. Броуном в 1827 г.
Теория броуновского движения была создана А. Эйнштейном в 1905 г.
Экспериментально теория Эйнштейна была подтверждена в опытах французского физика Ж. Перрена, проведенных в 1908–1911 гг.
Слайд 12Причина броуновского движения
Броуновские частицы движутся под влиянием беспорядочных ударов молекул.
Из-за
хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга.
В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую
В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую
Слайд 13Диффузия
Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в
друга.
Слайд 15Относительная молекулярная масса
Относительная молекулярная масса простого или сложного вещества есть отношение
массы его молекулы к части массы атома 12С (углерод).
Слайд 16Один моль вещества
1 Моль — это количество вещества, содержащее столько молекул, атомов, ионов,
электронов или других структурных единиц, сколько содержится атомов в 12 граммах изотопа 12С (углерод).
Слайд 17Постоянная Авогадро
Количество структурных единиц, содержащихся в одном моле вещества определяет число Авогадро
NA= 6,023
·1023моль−1
Слайд 18Количество вещества
Количество вещества, содержащегося в теле, определяется числом молекул (или атомов)
в этом теле.
Слайд 24Идеальный газ
а) Собственный объем молекул газа пренебрежимо мал по сравнению с
объемом сосуда (разреженность).
б) Между молекулами отсутствуют силы взаимодействия.
в) Столкновение молекул газа между собой и со стенками сосуда абсолютно упругие.
б) Между молекулами отсутствуют силы взаимодействия.
в) Столкновение молекул газа между собой и со стенками сосуда абсолютно упругие.
Слайд 30Распределение Максвелла молекул идеального газа по скоростям
Вид распределения молекул газа по
скоростям для каждого газа зависит от рода газа (m) и от параметра состояния (Т).
Давление P и объём газа V на распределение молекул не влияют.
Слайд 31Термодинамические параметры
параметры состояния
температура, плотность, давление, объем, удельное электрическое сопротивление и другие
физические величины:
- однозначно определяющие термодинамическое состояние системы;
- не учитывающие молекулярное строение тел;
- описывающие макроскопическое строение тел.
Слайд 32Уравнение Менделеева - Клапейрона
Физическое состояние массы газа определяется тремя термодинамическими параметрами:
давлением р, объемом V и температурой Т.
Между этими параметрами существует определенная связь, называемая уравнением состояния
Между этими параметрами существует определенная связь, называемая уравнением состояния
Слайд 33Уравнение Менделеева – Клапейрона
Уравнение состояния позволяет определить одну из величин, если
известны две другие
Зная уравнение состояния можно предсказать как будет протекать процесс при определенных внешних условиях
Зная уравнение состояния можно определить, как меняется состояние системы, если она совершает работу или получает теплоту от окружающих тел.
Зная уравнение состояния можно предсказать как будет протекать процесс при определенных внешних условиях
Зная уравнение состояния можно определить, как меняется состояние системы, если она совершает работу или получает теплоту от окружающих тел.
Слайд 34Газовые законы
Газовыми законами называются количественные зависимости между двумя макроскопическими параметрами при
фиксированном значении третьего параметра
Слайд 35Изопроцессы
Изопроце́ссы — термодинамические процессы, во время которых количество вещества и ещё одна из
физических величин — параметров состояния: давление, объём, температура — остаются неизменными.
Слайд 44Способы изменения
внутренней энергии
Внутреннюю энергию можно изменить:
За счет совершения механической
работы над телом
Без совершения работы – теплообмен
Без совершения работы – теплообмен
Слайд 46Теплопроводность
Теплопроводность - это способ теплопередачи, при котором тепло передается от более
нагретой части тела, к менее нагретым, без перемещения вещества.
Слайд 47Особенности
Может происходить в твердых, жидких газообразных веществах;
Лучше всего проводят тепло твердые
тела, а из твердых – металлы;
Газы проводят тепло хуже чем жидкости;
Чем выше температура нагревателя, тем быстрее передается тепло от одной части тела к другой.
Газы проводят тепло хуже чем жидкости;
Чем выше температура нагревателя, тем быстрее передается тепло от одной части тела к другой.
Слайд 48Конвекция
Конвекция - это способ теплопередачи, при котором тепло передается от нагревателя
восходящими струями газа
Слайд 49Особенности
Конвекция может наблюдаться только в жидкостях и газах;
Конвекция происходит быстрее в
газах, чем в жидкостях при прочих равных условиях;
Чем больше площадь поверхности нагретого тела, тем больше жидкости или газа вовлекается в процесс конвекции;
Чем выше температура нагревателя, тем интенсивнее конвекция.
Чем больше площадь поверхности нагретого тела, тем больше жидкости или газа вовлекается в процесс конвекции;
Чем выше температура нагревателя, тем интенсивнее конвекция.
Слайд 50Лучистый теплообмен
Лучистый теплообмен - это способ передачи тепла от нагревателя посредством
испускания лучей.
Слайд 51Особенности
Чем выше температура источника тепла, тем излучение больше;
Чем больше площадь поверхности,
тем больше энергии излучает тело при прочих равных условиях;
При одинаковых температурах и площадях поверхности излучает больше тот нагреватель, который имеет черную поверхность;
Излучение может распространяться в твердых, жидких и газообразных средах, а также в вакууме.
При одинаковых температурах и площадях поверхности излучает больше тот нагреватель, который имеет черную поверхность;
Излучение может распространяться в твердых, жидких и газообразных средах, а также в вакууме.
Слайд 53Термодинамика
В основе термодинамики лежат 3 фундаментальных закона, называемых началами термодинамики, установленных
на основании обобщения большой совокупности опытных фактов.
Слайд 54Нулевое (или общее) начало термодинамики
Замкнутая система независимо от начального состояния в
конце концов приходит к состоянию термодинамического равновесия и самостоятельно выйти из него не может.
Слайд 55Первое начало термодинамики
Закон сохранения энергии в применении к термодинамическим системам.
Количество теплоты,
полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
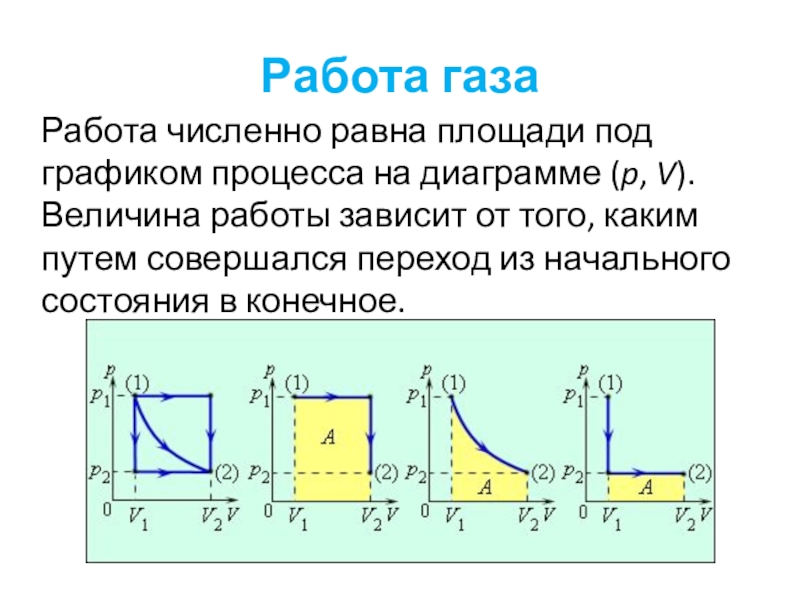
Слайд 57Работа газа
Работа численно равна площади под графиком процесса на диаграмме (p,
V). Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное.
Слайд 58Количество теплоты
Количество теплоты- количественная мера изменения внутренней энергии при теплообмене
Слайд 59Второе начало термодинамики
Накладывает ограничения на направление термодинамических процессов, запрещая самопроизвольную передачу
тепла от менее нагретых тел к более нагретым.