- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку физики по теме Основные понятия МКТ
Содержание
- 1. Презентация к уроку физики по теме Основные понятия МКТ
- 2. Зачем нужно изучать природу и строение вещества?
- 3. Чтобы создавать требуемые материалы, необходимы знания о
- 4. Гипотеза о дискретном строении вещества.Гипотеза о том,
- 5. Согласно гипотезе о прерывистом (дискретном) строении вещества,
- 6. Любая гипотеза должна быть подтверждена теми или
- 7. Наиболее простым подтверждением существования отдельных частиц вещества
- 8. Слайд 8
- 9. Роль диффузии в природе и технике.В природе
- 10. Самым убедительным аргументом в пользу дискретности служит
- 11. Аналогичное движение наблюдал в 1827 г. английский
- 12. Можно легко объяснить броуновское
- 13. Экспериментальные подтверждения дискретного строения вещества.Французский химик Ж.
- 14. Если мы измерим объём V капли масла
- 15. Создание в 1981 г. В Швейцарии первого
- 16. Взаимодействие частиц вещества.То, что частицы вещества взаимно
- 17. Очень важно понять, что силы притяжения и
- 18. Притяжения и отталкивания частиц определяют их взаимное
- 19. Размеры и число частиц.Размеры атомов малы и
- 20. Твёрдое, жидкое и газообразное состояния вещества.В трёх
- 21. Газы занимают весь предоставленный объём из-за хаотичности
- 22. Слайд 22
Зачем нужно изучать природу и строение вещества? Любой инструмент, применяемый человеком, требует материала с соответствующими свойствами. Например, для ножниц, ножей, бритв нужны стойкие твёрдые материалы; для подушек, матрацев – мягкие, для окон, посуды – прозрачные, для
Слайд 2Зачем нужно изучать природу и строение вещества?
Любой инструмент, применяемый человеком,
требует материала с соответствующими свойствами. Например, для ножниц, ножей, бритв нужны стойкие твёрдые материалы; для подушек, матрацев – мягкие, для окон, посуды – прозрачные, для фундаментов зданий – устойчивые к различным погодным условиям.
Слайд 3Чтобы создавать требуемые материалы, необходимы знания о природе и строении вещества.
Но не только для этого!
Знания о веществе помогут ответить на множество вопросов. Например: почему идёт дождь? Почему магнит притягивает железную пластинку? Как возникает молния?
Как работает телевизор, микроволновая печь? И так далее.
Знания о веществе помогут ответить на множество вопросов. Например: почему идёт дождь? Почему магнит притягивает железную пластинку? Как возникает молния?
Как работает телевизор, микроволновая печь? И так далее.
Слайд 4Гипотеза о дискретном строении вещества.
Гипотеза о том, что вещество имеет прерывистое
строение, т.е. состоит из отдельных частиц, была высказана около 2500 лет назад древнегреческим учёным Демокритом.
Эта гипотеза была результатом наблюдений за целым рядом явлений: испарением воды, стиранием лезвий ножа плуга при длительной работе, распространением запахов, разбиванием волн на мелкие брызги, выветриванием скал и т.д.
Эта гипотеза была результатом наблюдений за целым рядом явлений: испарением воды, стиранием лезвий ножа плуга при длительной работе, распространением запахов, разбиванием волн на мелкие брызги, выветриванием скал и т.д.
Слайд 5Согласно гипотезе о прерывистом (дискретном) строении вещества, все тела (твёрдые, жидкие,
газообразные) состоят из мельчайших частиц – атомов.
К началу 21 века было известно 116 различных видов атомов (химических элементов), 92 из которых существуют в природе.
Атомы могут образовывать устойчивые соединения – молекулы. Например, молекула воды образована из атомов кислорода и водорода.
А вот примеры других молекул:
К началу 21 века было известно 116 различных видов атомов (химических элементов), 92 из которых существуют в природе.
Атомы могут образовывать устойчивые соединения – молекулы. Например, молекула воды образована из атомов кислорода и водорода.
А вот примеры других молекул:
Н2О
О2
Н2
Не
Слайд 6Любая гипотеза должна быть подтверждена теми или иными наблюдениями физических явлений
или опытов.
Самым надёжным подтверждением гипотезы о дискретном строении вещества было бы непосредственное наблюдение атомов или молекул. Но если увидеть невооружённым глазом атомы и молекулы вещества невозможно, то это вовсе не означает, что вещество является сплошным. Например: дерево в сотне метров от нас кажется нам большим зелёным сплошным телом, но, подойдя близко, мы видим, что «пустого» пространства в нём значительно больше, чем заполненного веществом (сучьев и листьев).
Самым надёжным подтверждением гипотезы о дискретном строении вещества было бы непосредственное наблюдение атомов или молекул. Но если увидеть невооружённым глазом атомы и молекулы вещества невозможно, то это вовсе не означает, что вещество является сплошным. Например: дерево в сотне метров от нас кажется нам большим зелёным сплошным телом, но, подойдя близко, мы видим, что «пустого» пространства в нём значительно больше, чем заполненного веществом (сучьев и листьев).
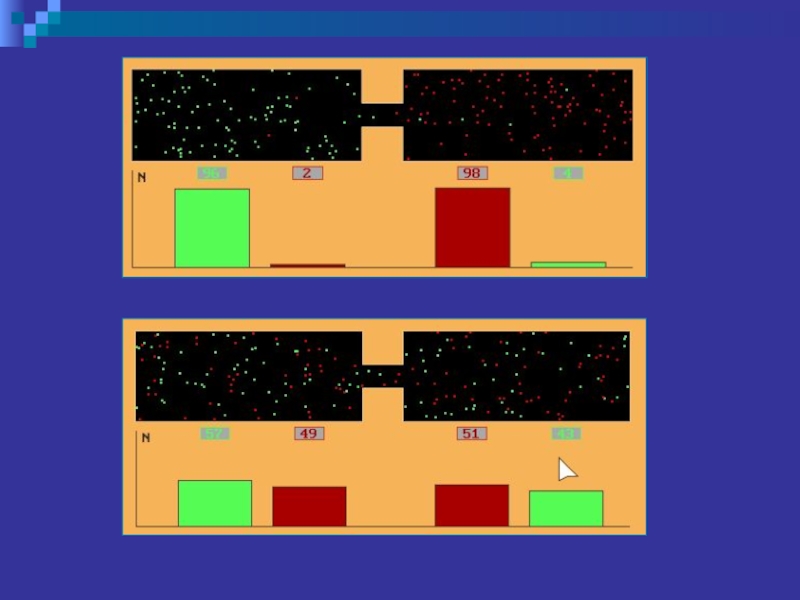
Слайд 7Наиболее простым подтверждением существования отдельных частиц вещества служит явление диффузии, т.е.
явление самопроизвольного проникновения одного вещества в другое.
Отметим две особенности диффузии.
Диффузия быстро проходит в газах (рис.1, а, б) (вспомните распространение запахов), несколько медленнее – в жидкостях (рис.2, а, б) и очень медленно – в твёрдых телах.
Скорость диффузии значительно возрастает с ростом температуры.
Отметим две особенности диффузии.
Диффузия быстро проходит в газах (рис.1, а, б) (вспомните распространение запахов), несколько медленнее – в жидкостях (рис.2, а, б) и очень медленно – в твёрдых телах.
Скорость диффузии значительно возрастает с ростом температуры.
Рис.1, а, б.
Рис.2, а, б.
Слайд 9Роль диффузии в природе и технике.
В природе – это непрерывное перемешивание
газов в земной атмосфере, не позволяющее более тяжёлым газам собираться в низинах. Это минерализация воды, т.е. растворение в ней различных минеральных веществ.
В технике диффузия используется для получения металлов с заданными свойствами, в первую очередь стали и сплавов алюминия, широко применяемых в авиации. На диффузии основаны процессы пайки, сварки, склеивания материалов и т.д.
В технике диффузия используется для получения металлов с заданными свойствами, в первую очередь стали и сплавов алюминия, широко применяемых в авиации. На диффузии основаны процессы пайки, сварки, склеивания материалов и т.д.
Слайд 10Самым убедительным аргументом в пользу дискретности служит наблюдение так называемого броуновского
движения.
Понаблюдайте в солнечный день за «пляской» пылинок в воздухе, которые совершают беспорядочное непрерывное движение в разных направлениях.
Понаблюдайте в солнечный день за «пляской» пылинок в воздухе, которые совершают беспорядочное непрерывное движение в разных направлениях.
Слайд 11Аналогичное движение наблюдал в 1827 г. английский ботаник Р.Броун, рассматривая под
микроскопом мелкие частицы цветочной пыльцы в воде. Каждая частица совершала причудливое зигзагообразное движение. Такое хаотическое (беспорядочное) движение получило в физике название броуновского.
Слайд 12 Можно легко объяснить броуновское движение, если предположить, что:
вода
и воздух состоят из молекул;
молекулы воды и газов, входящих в состав воздуха, движутся беспорядочно и сталкиваются с частицами пыльцы (пылинками), причём с разных сторон число таких столкновений разное.
Броуновское движение не только доказывает факт существования молекул вещества. Оно указывает на главную особенность их поведения – непрерывное и хаотичное (непредсказуемое) движение.
О непрерывности и хаотичности движения частиц вещества говорит и диффузия. Хаотически движутся не только частицы жидкостей и газов, но и твёрдых тел, в которых броуновское движение невозможно.
Вывод: диффузия и броуновское движение свидетельствуют о непрерывном и хаотическом движении атомов и молекул в веществах.
молекулы воды и газов, входящих в состав воздуха, движутся беспорядочно и сталкиваются с частицами пыльцы (пылинками), причём с разных сторон число таких столкновений разное.
Броуновское движение не только доказывает факт существования молекул вещества. Оно указывает на главную особенность их поведения – непрерывное и хаотичное (непредсказуемое) движение.
О непрерывности и хаотичности движения частиц вещества говорит и диффузия. Хаотически движутся не только частицы жидкостей и газов, но и твёрдых тел, в которых броуновское движение невозможно.
Вывод: диффузия и броуновское движение свидетельствуют о непрерывном и хаотическом движении атомов и молекул в веществах.
Слайд 13Экспериментальные подтверждения дискретного строения вещества.
Французский химик Ж. Л. Пруст путём очень
точных измерений показал, что отношение масс простых веществ, из которых состоит данное сложное вещество, всегда постоянно. Например: в любой воде масса кислорода всегда в 8 раз больше массы водорода.
Эти результаты были подтверждены в работах английского химика Д. Дальтона, что и привело к выводу об объединении атомов в молекулы.
Дискретность строения вещества подтверждают и опыты по измерению толщины тонких плёнок масла, растекающегося по ровной горизонтальной поверхности (обычно – поверхности воды).
Эти результаты были подтверждены в работах английского химика Д. Дальтона, что и привело к выводу об объединении атомов в молекулы.
Дискретность строения вещества подтверждают и опыты по измерению толщины тонких плёнок масла, растекающегося по ровной горизонтальной поверхности (обычно – поверхности воды).
Слайд 14Если мы измерим объём V капли масла и площадь поверхности S,
по которой она растекалась, то можем узнать толщину плёнки h.
Так как V=Sh, то h=V/S.
Если бы вещество было сплошным, то масляное пятно могло бы иметь любую (даже бесконечно малую) толщину. Если вещество состоит из частиц, то толщина пятна не может быть меньше, чем поперечник частицы. Измерения показали, что толщина слоя масла была во всех опытах одинакова и равна 4 · 10-8 см.
Заметьте, что эти результаты не только подтвердили существование молекул, но и позволили оценить их диаметр, который оказался чрезвычайно мал.
Структуру вещества и размеры частиц определяют также с помощью рентгеновских лучей (рентгеноструктурный анализ).
Так как V=Sh, то h=V/S.
Если бы вещество было сплошным, то масляное пятно могло бы иметь любую (даже бесконечно малую) толщину. Если вещество состоит из частиц, то толщина пятна не может быть меньше, чем поперечник частицы. Измерения показали, что толщина слоя масла была во всех опытах одинакова и равна 4 · 10-8 см.
Заметьте, что эти результаты не только подтвердили существование молекул, но и позволили оценить их диаметр, который оказался чрезвычайно мал.
Структуру вещества и размеры частиц определяют также с помощью рентгеновских лучей (рентгеноструктурный анализ).
Слайд 15Создание в 1981 г. В Швейцарии первого зондового микроскопа позволило получить
изображения дискретной структуры поверхностей кристаллов и измерить расстояния между атомами.
За изобретение такого уникального микроскопа, дающего возможность «видеть» атомы и молекулы, его создателям Г. Биннингу и Х. Рореру в 1986 г. Была присуждена Нобелевская премия по физике.
В результате многочисленных подтверждений гипотезы о дискретном строении вещества и её дальнейших уточнений была создана молекулярно-кинетическая теория строения вещества.
За изобретение такого уникального микроскопа, дающего возможность «видеть» атомы и молекулы, его создателям Г. Биннингу и Х. Рореру в 1986 г. Была присуждена Нобелевская премия по физике.
В результате многочисленных подтверждений гипотезы о дискретном строении вещества и её дальнейших уточнений была создана молекулярно-кинетическая теория строения вещества.
Слайд 16Взаимодействие частиц вещества.
То, что частицы вещества взаимно притягиваются друг к другу,
подтверждается простейшими фактами. Несмотря на непрерывное движение частиц вещества, окружающие нас тела (дома, деревья, автомобили) не распадаются на отдельные частицы.
Простые факты убеждают нас в том, что частицы веществ могут не только притягиваться, но и отталкиваться друг от друга. Вспомните, как трудно даже незначительно сжать воду в шприце.
Простые факты убеждают нас в том, что частицы веществ могут не только притягиваться, но и отталкиваться друг от друга. Вспомните, как трудно даже незначительно сжать воду в шприце.
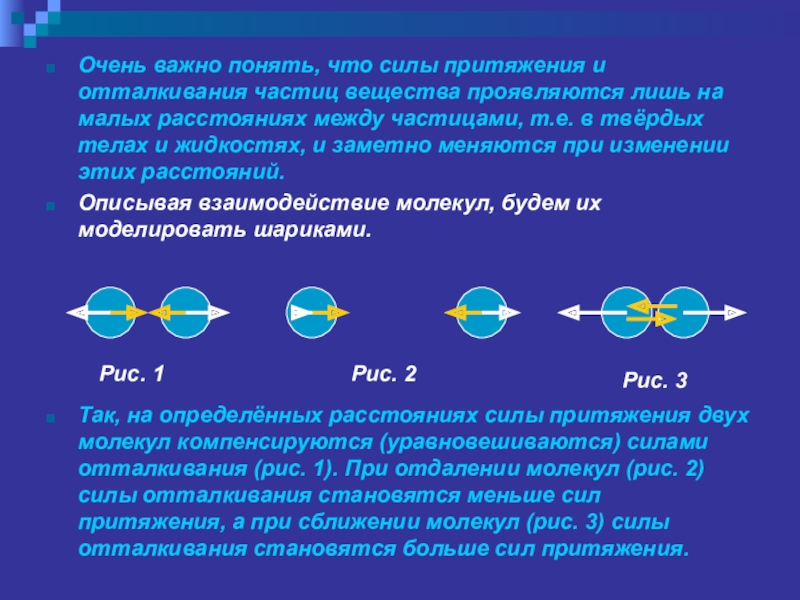
Слайд 17Очень важно понять, что силы притяжения и отталкивания частиц вещества проявляются
лишь на малых расстояниях между частицами, т.е. в твёрдых телах и жидкостях, и заметно меняются при изменении этих расстояний.
Описывая взаимодействие молекул, будем их моделировать шариками.
Так, на определённых расстояниях силы притяжения двух молекул компенсируются (уравновешиваются) силами отталкивания (рис. 1). При отдалении молекул (рис. 2) силы отталкивания становятся меньше сил притяжения, а при сближении молекул (рис. 3) силы отталкивания становятся больше сил притяжения.
Описывая взаимодействие молекул, будем их моделировать шариками.
Так, на определённых расстояниях силы притяжения двух молекул компенсируются (уравновешиваются) силами отталкивания (рис. 1). При отдалении молекул (рис. 2) силы отталкивания становятся меньше сил притяжения, а при сближении молекул (рис. 3) силы отталкивания становятся больше сил притяжения.
Рис. 1
Рис. 2
Рис. 3
Слайд 18Притяжения и отталкивания частиц определяют их взаимное расположение в веществе.
А от
взаимного расположения частиц существенно зависят свойства веществ.
Так, глядя на прозрачный очень твёрдый алмаз (бриллиант) и на мягкий чёрный графит (из него изготавливают стержни простых карандашей), мы не догадываемся, что оба вещества состоят из совершенно одинаковых атомов углерода. Просто в графите эти атомы расположены иначе, чем в алмазе.
Так, глядя на прозрачный очень твёрдый алмаз (бриллиант) и на мягкий чёрный графит (из него изготавливают стержни простых карандашей), мы не догадываемся, что оба вещества состоят из совершенно одинаковых атомов углерода. Просто в графите эти атомы расположены иначе, чем в алмазе.
Слайд 19Размеры и число частиц.
Размеры атомов малы и примерно равны 10-8 см.
Размеры
молекул зависят от числа и расположения входящих в их состав атомов.
Число частиц (атомов, молекул) в данном теле является конечным.
В газах число частиц в единице объёма примерно в 1000 раз меньше, чем в жидкостях и твёрдых телах.
Из-за непрерывного хаотического движения частиц (атомов, молекул) можно говорить только о среднем расстоянии между ними.
Число частиц (атомов, молекул) в данном теле является конечным.
В газах число частиц в единице объёма примерно в 1000 раз меньше, чем в жидкостях и твёрдых телах.
Из-за непрерывного хаотического движения частиц (атомов, молекул) можно говорить только о среднем расстоянии между ними.
Слайд 20Твёрдое, жидкое и газообразное состояния вещества.
В трёх этих состояниях может быть
одно и то же вещество, например лёд, вода, пар.
В трёх этих состояниях может находиться и азот, и кислород, и металлы.
Газ не сохраняет ни объёма, ни формы, а занимает весь предоставленный ему объём.
Жидкость принимает форму сосуда, в который она налита, но сохраняет постоянным объём.
Твёрдые тела сохраняют свой объём и форму.
В трёх этих состояниях может находиться и азот, и кислород, и металлы.
Газ не сохраняет ни объёма, ни формы, а занимает весь предоставленный ему объём.
Жидкость принимает форму сосуда, в который она налита, но сохраняет постоянным объём.
Твёрдые тела сохраняют свой объём и форму.
Слайд 21Газы занимают весь предоставленный объём из-за хаотичности движения и отсутствия сил
притяжения молекул.
Сохранение объёма жидкости говорит о наличии сил притяжения между её частицами.
Отсутствие текучести (сохранение формы) твёрдых тел указывает на то, что притяжение их частиц сильнее, чем частиц жидкости.
Интенсивность движения частиц во всех трёх состояниях вещества увеличивается при нагревании.
Физики для точной оценки степени нагретости тела используют физическую величину – температуру.
Температура тела связана с энергией движения молекул. Эта энергия тем больше, чем больше скорость молекул. Чем больше скорость молекул, тем выше температура тела.
Сохранение объёма жидкости говорит о наличии сил притяжения между её частицами.
Отсутствие текучести (сохранение формы) твёрдых тел указывает на то, что притяжение их частиц сильнее, чем частиц жидкости.
Интенсивность движения частиц во всех трёх состояниях вещества увеличивается при нагревании.
Физики для точной оценки степени нагретости тела используют физическую величину – температуру.
Температура тела связана с энергией движения молекул. Эта энергия тем больше, чем больше скорость молекул. Чем больше скорость молекул, тем выше температура тела.