- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку 10 класс:Уравнение состояния газа
Содержание
- 1. Презентация к уроку 10 класс:Уравнение состояния газа
- 2. Оценивание!«5»- 6-7б«4»- 4-5б«3»- 3б
- 3. Критерии оценивания
- 4. Проанализируйте слайдыСформулируйте тему, цель и задачи урока
- 5. Слайд 5
- 6. Слайд 6
- 7. ??? (1834 – 1907)Крупнейший химик мира, физик, педагог
- 8. Дмитрий Иванович Менделеев (1834 – 1907)Крупнейший химик мира, физик, педагог
- 9. Во всем мне хочется дойти до самой сути…
- 10. Сформулируйте тему, цель и задачи урока
- 11. Тема урока: « Уравнение состояния газа»
- 12. Цель урока:Вывести зависимость между макроскопическими параметрами, характеризующими состояние газа.
- 13. Задачи урока:1.Повторить величины характеризующие газ.2.Установить зависимость
- 14. Оцените 1этап урока :
- 15. ВСПОМНИМ ФОРМУЛЫр = nkTm = ρVNA
- 16. Оцените 2этап урока :
- 17. ОБЪЕДИНИМ ПАРАМЕТРЫ p, V, T Объединим
- 18. R=8,31 Дж / (моль·К)NA k = RУниверсальная газоваяпостоянная - R
- 19. Уравнение Менделеева – Клайперона
- 20. ИСТОРИЧЕСКАЯ СПРАВКАУравнение, устанавливающее связь между давлением, объёмом
- 21. Уравнение состояния идеального газаСостояние газа данной массы
- 22. Уравнение состояния позволяет:1.Определить одну из макроскопических величин
- 23. Еще две полезные формулы pV =
- 24. Приступаем к решению задач
- 25. НОРМАЛЬНЫЕ УСЛОВИЯ1. Давление равно атмосферному р=1атм= 1,013·10
- 26. ЗАДАЧАДано:
- 27. ЗАДАЧАДано:
- 28. ЗАДАЧАДано:
- 29. Решаем самостоятельно!!!При температуре 10ºС и давлении
- 30. Дано:
- 31. Самостоятельная работа. Заполните таблицу
- 32. Проверим таблицу
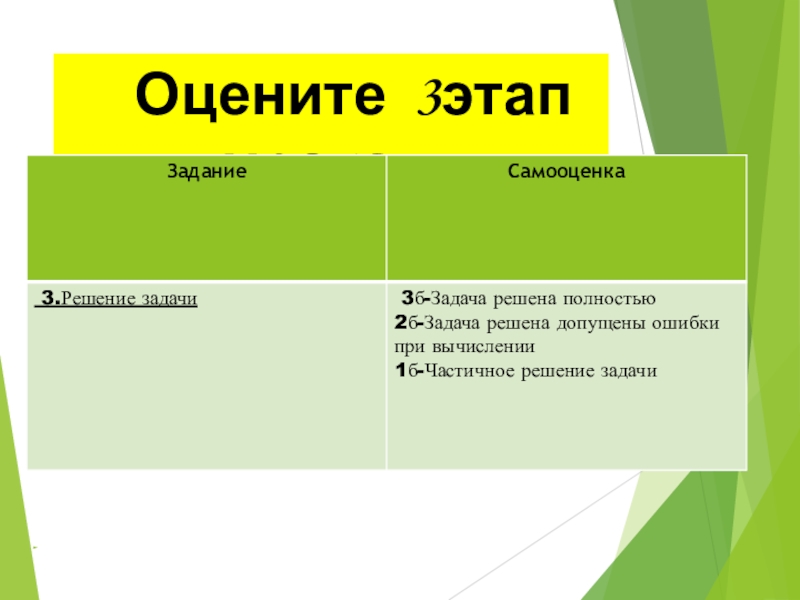
- 33. Оцените 3этап урока :
- 34. Подводим итоги!«5»- 6-7б«4»- 4-5б«3»- 3б
- 35. ДОМАШНЕЕ ЗАДАНИЕ §§ 66-67.Стр.224-225 оформить задачи стр.225
- 36. Рефлексия
- 37. Спасибо за внимание!
Оценивание!«5»- 6-7б«4»- 4-5б«3»- 3б
Слайд 12 Цель урока:
Вывести зависимость между макроскопическими параметрами, характеризующими состояние газа.
Слайд 13 Задачи урока:
1.Повторить величины характеризующие газ.
2.Установить зависимость между величинами характеризующие газ.(Уравнение
состояния газа)
3.Применить уравнение состояния газа для расчёта задач.
3.Применить уравнение состояния газа для расчёта задач.
Слайд 15ВСПОМНИМ ФОРМУЛЫ
р = nkT
m = ρV
NA = 6·10²³моль - число
Авогадро
k = 1,38·10 Дж/К - постоянная Больцмана
– 23
– 1
Слайд 17ОБЪЕДИНИМ ПАРАМЕТРЫ p, V, T
Объединим три формулы:
1)
2) 3)
Получим: заменим R = kNA
R = 1,38·10 ·6·10 = 8,3 Дж/моль·К – универсальная газовая постоянная
Получим: заменим R = kNA
R = 1,38·10 ·6·10 = 8,3 Дж/моль·К – универсальная газовая постоянная
р = nkT
-23
23
Слайд 20ИСТОРИЧЕСКАЯ СПРАВКА
Уравнение, устанавливающее связь между давлением, объёмом и температурой, было получено
французским физиком Бенуа Клайпероном. его впервые использовал Д.И. Менделеев, поэтому оно называется уравнение
Менделеева - Клайперона
Менделеева - Клайперона
Слайд 21Уравнение состояния идеального газа
Состояние газа данной массы характеризуется тремя параметрами:
р
- Давлением
V - Объёмом
T - температурой
V - Объёмом
T - температурой
Слайд 22Уравнение состояния позволяет:
1.Определить одну из макроскопических величин ( P,V,T)
2.Определить, как протекают
в системе различные процессы.
3.Определить, как изменяется состояние системы, если она совершает работу или получает теплоту от окружающих тел.
3.Определить, как изменяется состояние системы, если она совершает работу или получает теплоту от окружающих тел.
Слайд 23Еще две полезные формулы
pV = νRT
где ν
– количество вещества (моль)
ρ – плотность газа (кг/м³)
От чего зависит плотность газа?
ρ – плотность газа (кг/м³)
От чего зависит плотность газа?
УРАВНЕНИЕ СОСТОЯНИЯ
Слайд 25НОРМАЛЬНЫЕ УСЛОВИЯ
1. Давление равно атмосферному
р=1атм= 1,013·10 Па ≈10 Па
2.
Температура равна 0ºС
Т = 273К
Задача: найти объём 1моля газа при нормальных условиях
Т = 273К
Задача: найти объём 1моля газа при нормальных условиях
5
5
Слайд 29 Решаем самостоятельно!!!
При температуре 10ºС и давлении 100 кПа воздух занимает
объём 5л. Каким будет объём данной массы воздуха при давлении 80кПа и температуре 60ºС?
Слайд 30Дано: СИ
Решение
t1 = 10ºC 283К
p1 = 100кПа 10 Па
V1 = 5л 0,005м³
t2 = 60ºC 333ºС
p2 = 80кПа 8·10 Па
V2 - ?
t1 = 10ºC 283К
p1 = 100кПа 10 Па
V1 = 5л 0,005м³
t2 = 60ºC 333ºС
p2 = 80кПа 8·10 Па
V2 - ?
Проверяем решение!!!
5
4
Слайд 35ДОМАШНЕЕ ЗАДАНИЕ
§§ 66-67.
Стр.224-225 оформить задачи
стр.225 задачи 1-5
«4-5»
Выполнение письменной работы на gmail.com
СПАСИБО ЗА УРОК!