факторов, влияющих на скорость коррозии.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к Исследовательскому проекту Изучение процесса возникновения коррозии в металлах (химия, физика)
Содержание
- 1. Презентация к Исследовательскому проекту Изучение процесса возникновения коррозии в металлах (химия, физика)
- 2. Коррозия – разрушение металлов и
- 3. Закономерности коррозии: Если соединены два
- 4. Вред коррозии :Вызывает серьезные экологические последствия: утечка
- 5. Защита от коррозии Одним из наиболее распространенных
- 6. Организация
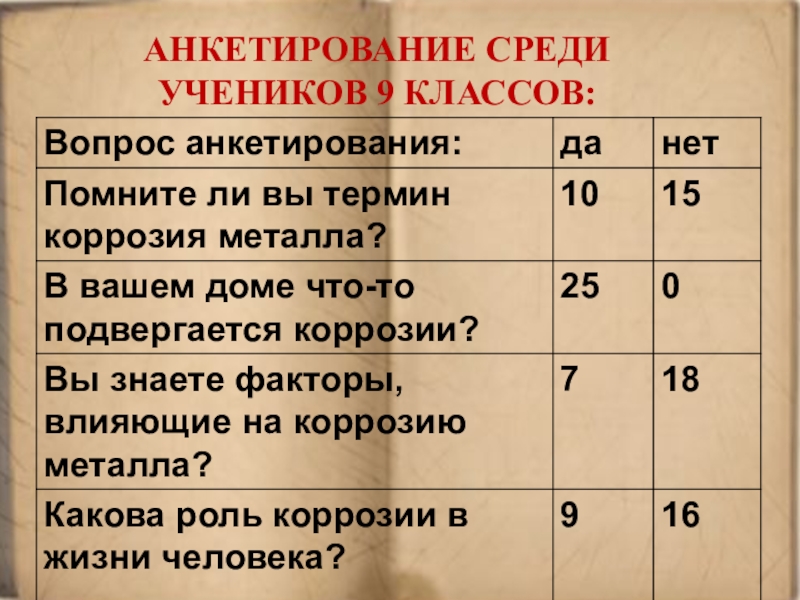
- 7. Анкетирование среди учеников 9 классов:
- 8. Приборы для опыта:Ход работы:1.Перед началом эксперимента изделие
- 9. Начало исследования. В течение 5 дней я
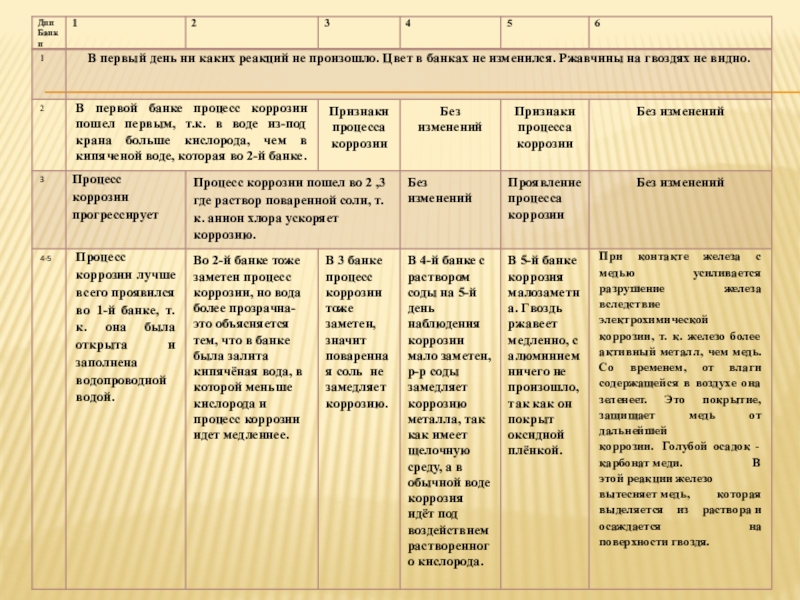
- 10. ПЕРВЫЙ ДЕНЬ ИССЛЕДОВАНИЯ
- 11. ВТОРОЙ ДЕНЬ ИССЛЕДОВАНИЯ
- 12. ТРЕТИЙ ДЕНЬ ИССЛЕДОВАНИЯ
- 13. ЧЕТВЕРТЫЙ ДЕНЬ ИССЛЕДОВАНИЯ
- 14. Коррозия металла
- 15. Слайд 15
- 16. ВыводыФакторы, влияющие на скорость коррозии: Наличие кислорода,
- 17. Рекомендации:Используй средства защиты от ржавчиныЗаржавевший металл можно
- 18. Спасибо за внимание!!!
Коррозия – разрушение металлов и сплавов под воздействием окружающей среды. Состоит из двух процессов: химического – это отдача электронов и
Слайд 2
Коррозия – разрушение металлов и сплавов под воздействием окружающей
среды.
Состоит из двух процессов: химического – это отдача электронов и электрического – это перенос электронов.
Состоит из двух процессов: химического – это отдача электронов и электрического – это перенос электронов.
Слайд 3Закономерности коррозии:
Если соединены два разных металла, то коррозии подвергается
только более активный, и пока он полностью не разрушится, менее активный защищён.
Скорость коррозии тем больше, чем дальше друг от друга в ряду напряжений расположены соединённые металлы.
Скорость коррозии тем больше, чем дальше друг от друга в ряду напряжений расположены соединённые металлы.
Слайд 4Вред коррозии :
Вызывает серьезные экологические последствия: утечка нефти, газа, других химических
продуктов.
Недопустима во многих отраслях промышленности: авиационной, химического, нефтяного и атомного машиностроения.
Отрицательно влияет на жизнь и здоровье людей.
Недопустима во многих отраслях промышленности: авиационной, химического, нефтяного и атомного машиностроения.
Отрицательно влияет на жизнь и здоровье людей.
Слайд 5Защита от коррозии
Одним из наиболее распространенных способов защиты металлов от
коррозии является нанесение на их поверхность защитных пленок: лака, краски, эмали.
Широко распространенным способом защиты металлов от коррозии является покрытие их слоем других металлов.
Покрывающие металлы сами корродируют с малой скоростью, так как покрываются плотной оксидной пленкой. Производят покрытие цинком, никелем, хромом и др.
Широко распространенным способом защиты металлов от коррозии является покрытие их слоем других металлов.
Покрывающие металлы сами корродируют с малой скоростью, так как покрываются плотной оксидной пленкой. Производят покрытие цинком, никелем, хромом и др.
Слайд 8Приборы для опыта:
Ход работы:
1.Перед началом эксперимента изделие из железа (гвозди) промываю
с мылом, для удаления слоя масла, который защищает их поверхность от ржавления. Когда гвозди высохнут, зачищаю их поверхность наждачной бумагой и помою кипяченой водой.
2.Пронумеровываю сосуды.
3.Наблюдаю за процессами и реакциями в банках в течение пяти дней и заполняю таблицу, делаю выводы.
2.Пронумеровываю сосуды.
3.Наблюдаю за процессами и реакциями в банках в течение пяти дней и заполняю таблицу, делаю выводы.
Слайд 9Начало исследования. В течение 5 дней я проверяла и записывала результаты.
За это время банки и их содержимое изменяли свой вид. Опыт был заложен 17.01.2017 года.
1день проверки-18.01.2017года
2 день проверки-19.01.2017года
5 день проверки-21.01.2017года
Емкости заполнены:
1б. –холодная вода из-под крана.
2 б.- горячая кипячёная вода.
3 б. – холодная вода из-под крана с 2 ст. ложками поваренной соли.
4б.- холодная вода из-под крана с 2 ст. ложками соды.
5б.-холодная вода из-под крана с 2 ст. ложками поваренной соли и алюминиевой проволокой.
6б.-холодная вода из-под крана с 2 ст. ложками соды и медной проволокой.
Опускаю в каждую банку железный гвоздь.
1день проверки-18.01.2017года
2 день проверки-19.01.2017года
5 день проверки-21.01.2017года
Емкости заполнены:
1б. –холодная вода из-под крана.
2 б.- горячая кипячёная вода.
3 б. – холодная вода из-под крана с 2 ст. ложками поваренной соли.
4б.- холодная вода из-под крана с 2 ст. ложками соды.
5б.-холодная вода из-под крана с 2 ст. ложками поваренной соли и алюминиевой проволокой.
6б.-холодная вода из-под крана с 2 ст. ложками соды и медной проволокой.
Опускаю в каждую банку железный гвоздь.
Слайд 16Выводы
Факторы, влияющие на скорость коррозии:
Наличие кислорода, растворенного в воде (для
электрохимической коррозии). Чем больше кислорода, тем быстрее происходит процесс коррозии.
Для гальванической пары скорость коррозии тем больше, чем дальше металлы находятся друг от друга в электрохимическом ряду напряжений.
Влияние среды:
а) наличие аниона хлора CI- усиливает коррозию, особенно с менее активным металлом – медью.
б) наличие гидроксил иона OH- ослабляет коррозию, т.е. ее скорость уменьшается.
в) в чистой воде процесс коррозии идёт медленнее, так как вода слабый электролит.
г) температурный фактор увеличивает скорость коррозии.
Для гальванической пары скорость коррозии тем больше, чем дальше металлы находятся друг от друга в электрохимическом ряду напряжений.
Влияние среды:
а) наличие аниона хлора CI- усиливает коррозию, особенно с менее активным металлом – медью.
б) наличие гидроксил иона OH- ослабляет коррозию, т.е. ее скорость уменьшается.
в) в чистой воде процесс коррозии идёт медленнее, так как вода слабый электролит.
г) температурный фактор увеличивает скорость коррозии.
Слайд 17Рекомендации:
Используй средства защиты от ржавчины
Заржавевший металл можно использовать для строительных работ
Заржавевшее
железо- неплохая подкормка растениям.
Металлические изделия – сырьё для металлургических предприятий.
Металлические изделия – сырьё для металлургических предприятий.