- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химической экологии: Глобальные циклы брома и йода
Содержание
- 1. Презентация по химической экологии: Глобальные циклы брома и йода
- 2. Общая характеристика брома Бром (лат. Bromum), Вг, химический
- 3. Историческая справкаБром был открыт в 1825 году
- 4. Физические и химические свойства Бром - единственный неметалл,
- 5. В воде бром растворим лучше других галогенов
- 6. Распространение в природе В земной коре -
- 7. Бром мигрирует в виде легко растворимых соединений,
- 8. Получение и применение Исходным сырьем для получения
- 9. Бром (а также – пары брома)– токсичное
- 10. Бром применяют довольно широко:как исходный продукт для
- 11. Влияние на организм человека В тканях и
- 12. Признаки избытка брома:воспаления и высыпания на коже;
- 13. Бромный цикл Бром наиболее опасен для озонового
- 14. Общая характеристика йода Йод (Jodum), I (встречается
- 15. Историческая справка Йод открыл в 1811 году
- 16. Физические и химические свойства Йод – твердый,
- 17. С металлами йод при легком нагревании энергично
- 18. Распространение и круговорот йода в природе в
- 19. Получение йода переработка природных накопителей йода -
- 20. Слайд 20
- 21. Применение йода В медицинеВ аналитической химии и
- 22. Биологическое влияние йода на организм человекаВ организме
- 23. Пониженная активность щитовидной железы – гипотиреоз, может
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
- 27. Слайд 27
- 28. Спасибо за внимание!
Общая характеристика брома Бром (лат. Bromum), Вг, химический элемент VII группы периодической системы Менделеева. Бром – галоген, химически активный неметалл, с атомным номером 35 и молекулярной массой 79,904.
Слайд 2Общая характеристика брома
Бром (лат. Bromum), Вг, химический элемент VII группы периодической системы
Менделеева.
Бром – галоген, химически активный неметалл, с атомным номером 35 и молекулярной массой 79,904.
Бром – галоген, химически активный неметалл, с атомным номером 35 и молекулярной массой 79,904.
Слайд 3Историческая справка
Бром был открыт в 1825 году французским химиком А.Баларом, который,
действуя хлором на водный раствор, полученный после промывания золы морских водорослей, выделил темно-бурую дурно пахнущую жидкость.
Новому элементу дали название бром (от греч. bromos – зловоние).
Новому элементу дали название бром (от греч. bromos – зловоние).
Слайд 4Физические и химические свойства
Бром - единственный неметалл, жидкий при комнатной температуре.
Простое вещество представляет собой красно-бурую жидкость с неприятным запахом, пары брома имеют желто-бурый цвет
При температуре -7,25°C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском.Кипит бром при температуре +59,2°C.
При температуре -7,25°C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском.Кипит бром при температуре +59,2°C.
Слайд 5В воде бром растворим лучше других галогенов (3,58 г/100 г Н2О
при 20°С) - "бромная вода".
Бром - сильный окислитель. Так, он окисляет сульфиты и тиосульфаты в водных растворах до сульфатов, нитриты до нитратов, аммиак до свободного азота.
Например,
3Br2 + 8NH3 = N2 + NH4Br
Бром вытесняет иод из его соединений, но сам вытесняется хлором и фтором.
Br2+ 2KI = I2+ 2KBr.
Cl2 + 2NaBr = Br2 + 2NaCl.
Бром - сильный окислитель. Так, он окисляет сульфиты и тиосульфаты в водных растворах до сульфатов, нитриты до нитратов, аммиак до свободного азота.
Например,
3Br2 + 8NH3 = N2 + NH4Br
Бром вытесняет иод из его соединений, но сам вытесняется хлором и фтором.
Br2+ 2KI = I2+ 2KBr.
Cl2 + 2NaBr = Br2 + 2NaCl.
Слайд 6Распространение в природе
В земной коре - 0,37·10–4 % (примерно 50-е место);
Бромистые соли
(NaBr, KBr, MgBr2) встречаются в отложениях хлористых солей:
в поваренной соли до 0,03 % Вr;
в калийных солях - до 0,3% Вr);
в морской воде (0,065 % Вr), рапе соляных озер (до 0,2% Вr) и подземных рассолах, обычно связанных с соляными и нефтяными месторождениями (до 0,1% Вr).
в растениях - в среднем 7·10-4 %.
в животных - 1·10-4 %
в поваренной соли до 0,03 % Вr;
в калийных солях - до 0,3% Вr);
в морской воде (0,065 % Вr), рапе соляных озер (до 0,2% Вr) и подземных рассолах, обычно связанных с соляными и нефтяными месторождениями (до 0,1% Вr).
в растениях - в среднем 7·10-4 %.
в животных - 1·10-4 %
Слайд 7Бром мигрирует в виде легко растворимых соединений, очень редко образуя твердые
минеральные формы, представленные:
бромиритом (AgBr);
эмболитом Ag (смешанный хлорид и бромид серебра)й и одэмболитом Ag (Cl, Вr, I).
бромиритом (AgBr);
эмболитом Ag (смешанный хлорид и бромид серебра)й и одэмболитом Ag (Cl, Вr, I).
Слайд 8Получение и применение
Исходным сырьем для получения брома служат морская вода, озерные
и подземные рассолы и щелока калийного производства, содержащие бром в виде бромид-иона Вr- (от 65 г/м3 в морской воде до 3-4 кг/м3 и выше в щелоках калийного производства).
Слайд 9Бром (а также – пары брома)– токсичное и ядовитое вещество.При работе
с бромом следует пользоваться защитной спецодеждой, противогазом, перчатками.
ПДК паров брома 0,5 мг/м3. Уже при содержании брома в воздухе в концентрации около 0,001% (по объему) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях — спазмы дыхательных путей, удушье. При попадании в организм токсическая доза составляет 3 г, летальная — от 35 г.
ПДК паров брома 0,5 мг/м3. Уже при содержании брома в воздухе в концентрации около 0,001% (по объему) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях — спазмы дыхательных путей, удушье. При попадании в организм токсическая доза составляет 3 г, летальная — от 35 г.
Слайд 10Бром применяют довольно широко:
как исходный продукт для получения ряда бромистых солей
и органических производных;
применяют в фотографии, как светочувствительное вещество;
при производстве ряда красителей;
как инсектициды (бромистый метил и некоторые другие соединения брома);
для создания антипиренов - добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам;
используют при химических анализах для определения веществ;
в медицине (бромиды натрия, калия, аммония) при лечении неврозов, истерии, повышенной раздражительности, бессонницы, гипертонической болезни, эпилепсии и хорее.
при изготовлении боевых отравляющих веществ
применяют в фотографии, как светочувствительное вещество;
при производстве ряда красителей;
как инсектициды (бромистый метил и некоторые другие соединения брома);
для создания антипиренов - добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам;
используют при химических анализах для определения веществ;
в медицине (бромиды натрия, калия, аммония) при лечении неврозов, истерии, повышенной раздражительности, бессонницы, гипертонической болезни, эпилепсии и хорее.
при изготовлении боевых отравляющих веществ
Слайд 11Влияние на организм человека
В тканях и органах взрослого человека бром содержится
в количестве 200-300 мг.Этот элемент найден в различных секретах (слезах, слюне, поте, молоке, желчи).
В крови здорового человека содержание брома колеблется от 0,11 до 2,00 мг% .
Суточная потребность здорового организма в броме – не более 0,8-1 г.
Основными поставщиками брома являются орехи (миндаль, фундук, арахис), бобовые (фасоль, горох и чечевица), пшеница и макаронные изделия из твёрдых сортов пшеницы, ячневая крупа, молочные продукты, водоросли и практически все виды морской рыбы.
В крови здорового человека содержание брома колеблется от 0,11 до 2,00 мг% .
Суточная потребность здорового организма в броме – не более 0,8-1 г.
Основными поставщиками брома являются орехи (миндаль, фундук, арахис), бобовые (фасоль, горох и чечевица), пшеница и макаронные изделия из твёрдых сортов пшеницы, ячневая крупа, молочные продукты, водоросли и практически все виды морской рыбы.
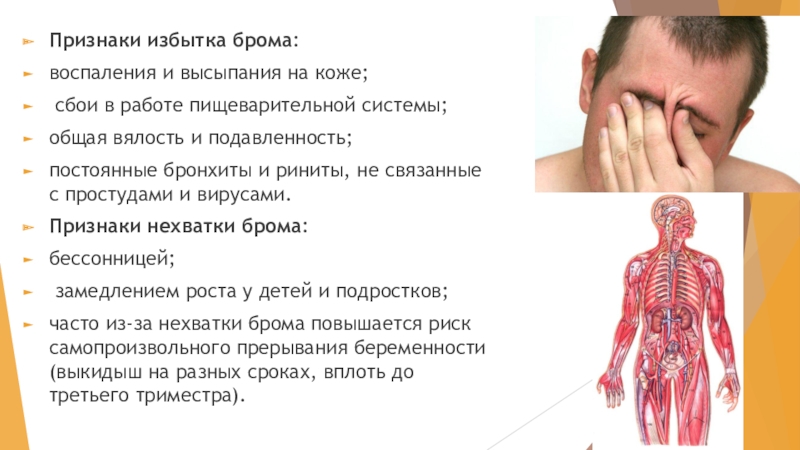
Слайд 12Признаки избытка брома:
воспаления и высыпания на коже;
сбои в работе пищеварительной
системы;
общая вялость и подавленность;
постоянные бронхиты и риниты, не связанные с простудами и вирусами.
Признаки нехватки брома:
бессонницей;
замедлением роста у детей и подростков;
часто из-за нехватки брома повышается риск самопроизвольного прерывания беременности (выкидыш на разных сроках, вплоть до третьего триместра).
общая вялость и подавленность;
постоянные бронхиты и риниты, не связанные с простудами и вирусами.
Признаки нехватки брома:
бессонницей;
замедлением роста у детей и подростков;
часто из-за нехватки брома повышается риск самопроизвольного прерывания беременности (выкидыш на разных сроках, вплоть до третьего триместра).
Слайд 13Бромный цикл
Бром наиболее опасен для озонового слоя. Однако, влияние этого цикла
на озоновый слой меньше, чем влияние других циклов. Это связано с меньшими концентрациями брома в стратосфере. Основными источниками брома в стратосфере являются бромсодержащие органические соединения, так называемые галоны, используемые для тушения пожаров. Галоны устойчивы в тропосфере, имеют большое время жизни и, попадая в стратосферу, разлагаются под действием жесткого ультрафиолетового излучения.
Br + O3 → BrO + O2
BrO + BrO → 2Br + O2
BrO + ClO → Br + Cl + O2
Br + O3 → BrO + O2
BrO + BrO → 2Br + O2
BrO + ClO → Br + Cl + O2
Слайд 14Общая характеристика йода
Йод (Jodum), I (встречается так же символ J) –
химический элемент VII группы периодической системы Д.И. Менделеева. Относится к галогенам, так же как и бром. Атомный (порядковый) номер – 53, относительная атомная масса –126,90447
Слайд 15Историческая справка
Йод открыл в 1811 году французский химик Б. Куртуа. Нагревая
маточный рассол золы морских водорослей с концентрированной серной кислотой, он наблюдал выделение фиолетового пара (отсюда название йод - от греч. iodes, ioeides - похожий цветом на фиалку, фиолетовый), который конденсировался в виде темных блестящих пластинчатых кристаллов.
В 1813-1814 годах французский химик Ж. Л. Гей-Люссак и английский химик Г. Дэви доказали элементарную природу йода.
В 1813-1814 годах французский химик Ж. Л. Гей-Люссак и английский химик Г. Дэви доказали элементарную природу йода.
Слайд 16Физические и химические свойства
Йод – твердый, при нормальных условиях, неметалл. Представляет
собой серовато – черные с металлическим блеском пластинки или сростки кристаллов со своеобразным (характерным запахом).
Плотность йода 4,94 г/см3, tпл 113,5°C, tкип184,35 °С.
Конфигурация внешних электронов атома йода 5s25p5. B соответствии с этим йод проявляет в соединениях переменную валентность (степень окисления): -1 (в HI, KI), +1 (в HIO, KIO), +3 (в ICl3), +5 (в HIO3, KIO3) и +7 (в HIO4, KIO4).
Плотность йода 4,94 г/см3, tпл 113,5°C, tкип184,35 °С.
Конфигурация внешних электронов атома йода 5s25p5. B соответствии с этим йод проявляет в соединениях переменную валентность (степень окисления): -1 (в HI, KI), +1 (в HIO, KIO), +3 (в ICl3), +5 (в HIO3, KIO3) и +7 (в HIO4, KIO4).
Слайд 17С металлами йод при легком нагревании энергично взаимодействует, образуя иодиды.
Hg +
I2 = HgI2
Сероводород H2S, тиосульфат натрия Na2S2O3 и другие восстановители восстанавливают его до I- .
I2 + H2S = S + 2HI
В горячих водных растворах щелочей образуются иодид и иодат.
3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O
Сероводород H2S, тиосульфат натрия Na2S2O3 и другие восстановители восстанавливают его до I- .
I2 + H2S = S + 2HI
В горячих водных растворах щелочей образуются иодид и иодат.
3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O
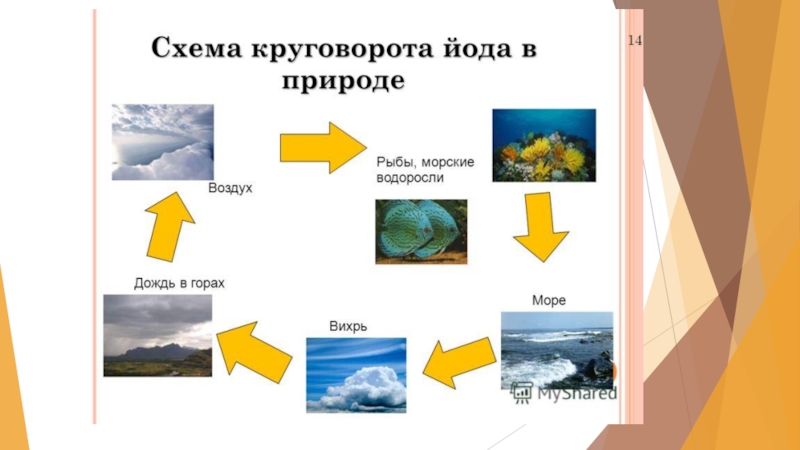
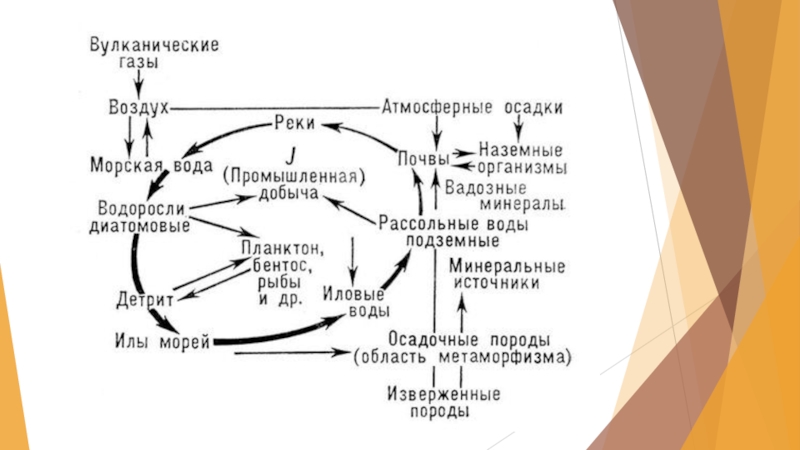
Слайд 18Распространение и круговорот йода в природе
в земной коре 4·10-5% по массе.
Основным резервуаром йода для биосферы служит Мировой океан (в 1 л в среднем содержится 5·10-5г йода).
в почвах около 3·10-4%
в растениях около 2·10-5%.
В поверхностных питьевых водах йода мало (от 10-7 до 10-9 %). В приморских областях количество йода в 1 м3 воздуха может достигать 50 мкг, в континентальных и горных - составляет 1 или даже 0,2 мкг.
морские водоросли - фукус, ламинария, филлофора, накапливают до 1% йода, некоторые губки - до 8,5% (в скелетном веществе спонгине).
Слайд 19Получение йода
переработка природных накопителей йода - морских водорослей и получение йода
из их золы.
Получение йода из отходов селитряного производства – маточных растворов натриевой селитры, содержащей до 0,4% йода в виде йодата и йодида натрия.
Получение йода в природных йодсодержащих растворов, например, воды некоторых соленых озер или попутных (буровых) нефтяных вод, содержащих обычно 20-40 мг/л йода в виде йодидов (местами 1 литр этих вод содержит свыше 100 мг йода).
Ионитный способ, основанный на избирательном поглощении йода особыми химическими соединениями – высокомолекулярными ионообменными смолами
Получение йода из отходов селитряного производства – маточных растворов натриевой селитры, содержащей до 0,4% йода в виде йодата и йодида натрия.
Получение йода в природных йодсодержащих растворов, например, воды некоторых соленых озер или попутных (буровых) нефтяных вод, содержащих обычно 20-40 мг/л йода в виде йодидов (местами 1 литр этих вод содержит свыше 100 мг йода).
Ионитный способ, основанный на избирательном поглощении йода особыми химическими соединениями – высокомолекулярными ионообменными смолами
Слайд 21Применение йода
В медицине
В аналитической химии и органическом синтезе,
В фотографии и
кинопромышленности (приготовление специальных фотоэмульсий и фотопластинок).
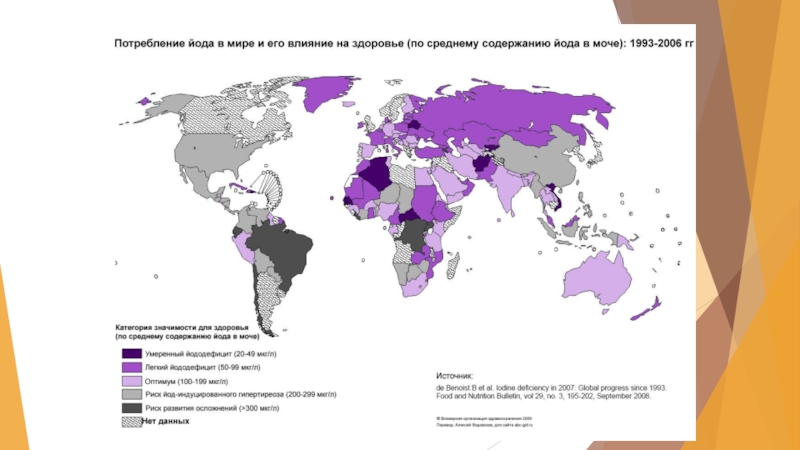
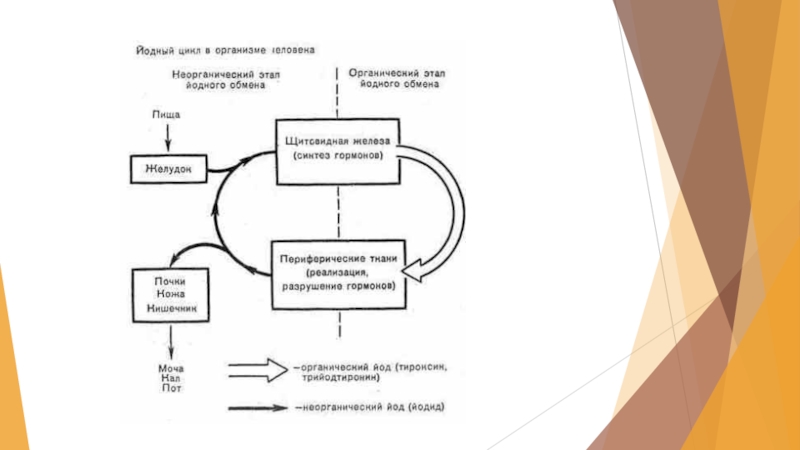
Слайд 22Биологическое влияние йода на организм человека
В организме человека содержится от 20
до 35 мг йода.
Суточная потребность в йоде человека и животных - около 3 мкг на 1 кг массы (возрастает при беременности, усиленном росте, охлаждении)
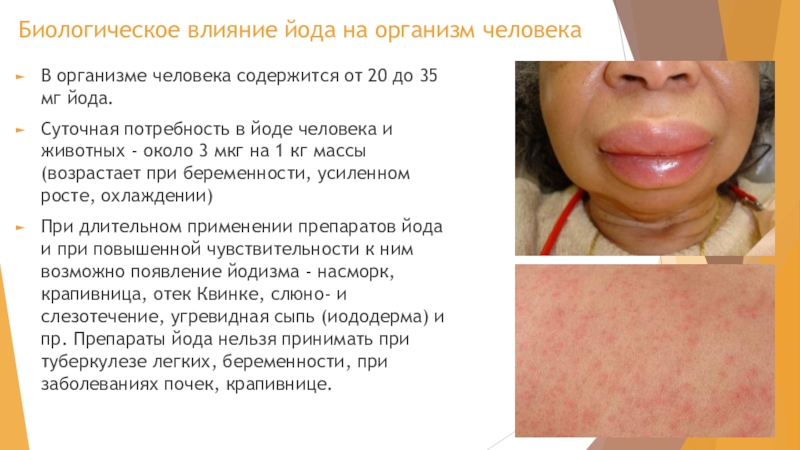
При длительном применении препаратов йода и при повышенной чувствительности к ним возможно появление йодизма - насморк, крапивница, отек Квинке, слюно- и слезотечение, угревидная сыпь (иододерма) и пр. Препараты йода нельзя принимать при туберкулезе легких, беременности, при заболеваниях почек, крапивнице.
Суточная потребность в йоде человека и животных - около 3 мкг на 1 кг массы (возрастает при беременности, усиленном росте, охлаждении)
При длительном применении препаратов йода и при повышенной чувствительности к ним возможно появление йодизма - насморк, крапивница, отек Квинке, слюно- и слезотечение, угревидная сыпь (иододерма) и пр. Препараты йода нельзя принимать при туберкулезе легких, беременности, при заболеваниях почек, крапивнице.
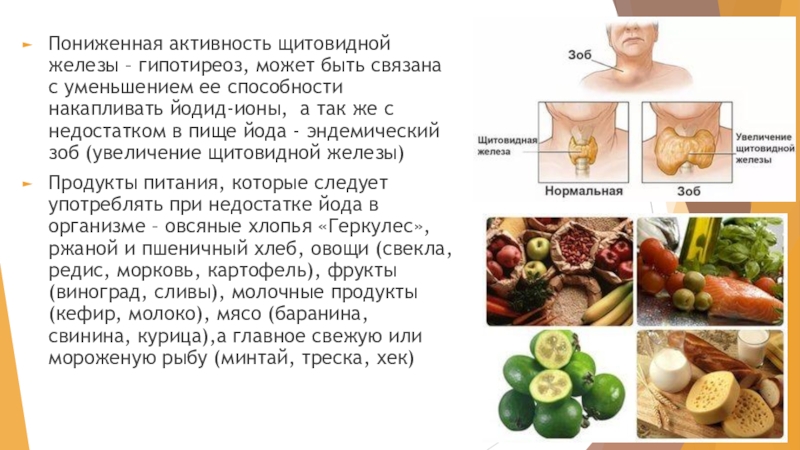
Слайд 23Пониженная активность щитовидной железы – гипотиреоз, может быть связана с уменьшением
ее способности накапливать йодид-ионы, а так же с недостатком в пище йода - эндемический зоб (увеличение щитовидной железы)
Продукты питания, которые следует употреблять при недостатке йода в организме – овсяные хлопья «Геркулес», ржаной и пшеничный хлеб, овощи (свекла, редис, морковь, картофель), фрукты (виноград, сливы), молочные продукты (кефир, молоко), мясо (баранина, свинина, курица),а главное свежую или мороженую рыбу (минтай, треска, хек)
Продукты питания, которые следует употреблять при недостатке йода в организме – овсяные хлопья «Геркулес», ржаной и пшеничный хлеб, овощи (свекла, редис, морковь, картофель), фрукты (виноград, сливы), молочные продукты (кефир, молоко), мясо (баранина, свинина, курица),а главное свежую или мороженую рыбу (минтай, треска, хек)