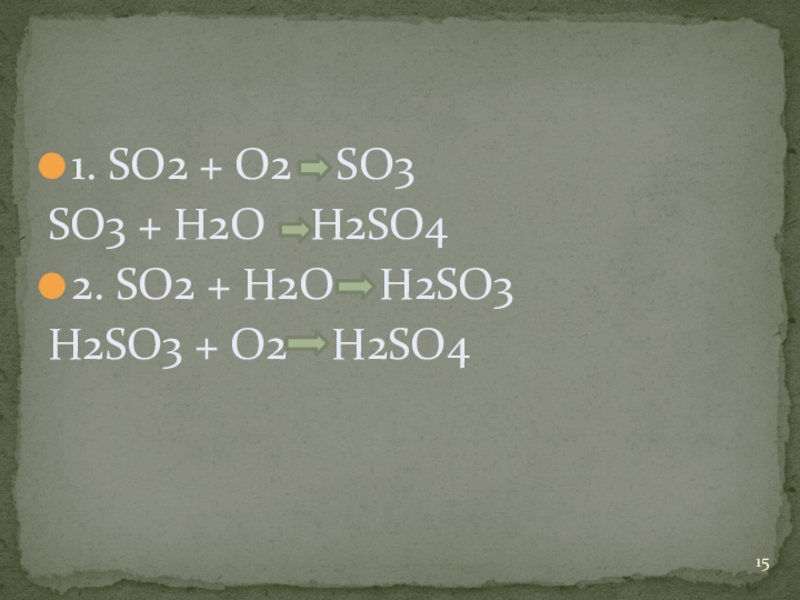- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Кислотные осадки для учебной дисциплины Экологические основы природопользования
Содержание
- 1. Кислотные осадки для учебной дисциплины Экологические основы природопользования
- 2. pH – показатель кислотности.pH=7 – нейтральная средаpH>7 – щелочная средаpH
- 3. В норме водородный показатель (рН) атмосферных осадков,
- 4. В составе нормальных осадков, помимо воды, присутствует
- 5. Впервые термин «кислотные дожди» был введен в
- 6. Кислотные дожди естественного происхождения – постоянное явление
- 7. Причиной кислотных осадков являются:выбросы предприятий металлургии,
- 8. В результате сжигания ископаемого топлива в
- 9. Хотя окись азота NО и образуется в
- 10. При высокотемпературном сгорании природного топлива происходят реакции
- 11. В результате выбросов окислов азота ежегодно в
- 12. Под действием световой энергии диоксид азота распадается
- 13. Воздействие фотохимических окислителей на паренхимные
- 14. Соединяясь с частицами воды, оксиды серы и
- 15. 1. SO2 + O2 SO3SO3 +
- 16. До определенного времени проблема кислотных дождей считалась
- 17. В 30% случаев кислотные дожди являются азотными.
- 18. Соляные кислотные дожди – редкость. Например, в
- 19. Несмотря на то, что сигнал тревоги Роберта
- 20. Первыми жертвами кислотных дождей стали водоемы -
- 21. В конце 70-х годов в местечке Уилинг
- 22. Реакция организмов пресных водоемов на понижение кислотности (рН)
- 23. Почвы менее восприимчивы к подкислению, нежели водоемы,так как обладают буферными свойствами.
- 24. Слайд 24
- 25. Закисление почв осадками приводит к вымыванию питательных
- 26. По версии Книги рекордов Гиннеса, самый кислый
- 27. Чем опасно такое явление для экосистем? Кислотный
- 28. Кислая дождевая вода разрушает туф, мрамор, мел
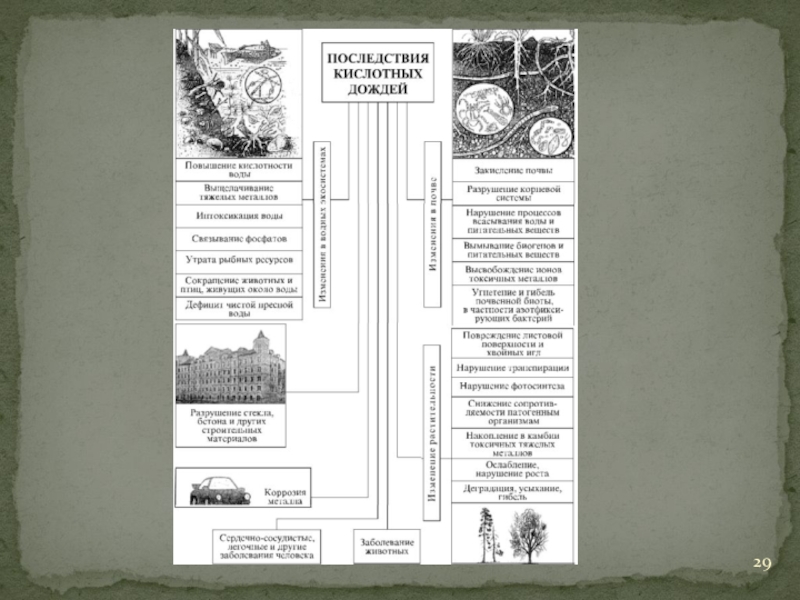
- 29. Слайд 29
- 30. Впервые кислотные дожди, как негативный экологический
- 31. Сейчас в большинстве стран мира действуют национальные
pH – показатель кислотности.pH=7 – нейтральная средаpH>7 – щелочная средаpH
Слайд 3В норме водородный показатель (рН) атмосферных осадков, выпадающих в твёрдом или
жидком состоянии, составляет 5,6–5,7. Будучи слабокислым раствором, такая вода не причиняет вреда окружающей среде. Кислотные осадки могут выпадать не только в виде дождя, но и снега, града тумана и т.д.
Слайд 4В составе нормальных осадков, помимо воды, присутствует угольная кислота. Она является
результатом взаимодействия Н2О с углекислым газом. Распространённые компоненты кислотных осадков – слабые растворы азотной и серной кислоты. Изменение состава в сторону понижения рН происходит вследствие взаимодействия атмосферной влаги с окислами азота и серы. Реже окисление осадков происходит под влиянием фторводорода или хлора. В первом случае в составе дождевой воды присутствует плавиковая кислота, во втором – соляная.
Слайд 5Впервые термин «кислотные дожди» был введен в употребление британским химиком Робертом
Энгусом Смитом более века назад (1872 г.). Занимаясь вопросами загрязнение города Манчестера, Смит доказал, что дым и пары содержат вещества, вызывающие серьезные изменения в химическом составе дождя, и что эти изменения можно заметить не только вблизи источника их выделения, но и «в полях, на большом расстоянии от него». Он также открыл некоторые виды вредных воздействий кислотных дождей: обесцвечивание тканей, коррозию металлических поверхностей, разрушение строительных материалов и гибель растительности.
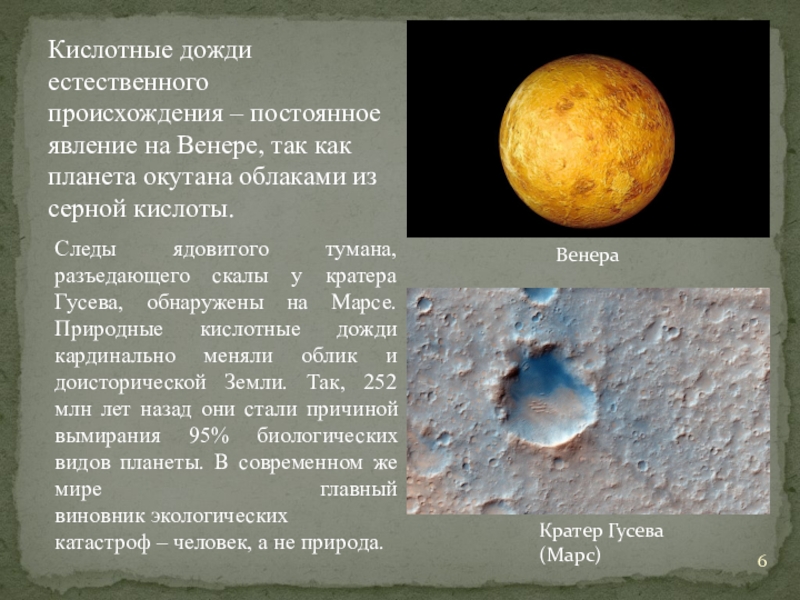
Слайд 6Кислотные дожди естественного происхождения – постоянное явление на Венере, так как
планета окутана облаками из серной кислоты.
Следы ядовитого тумана, разъедающего скалы у кратера Гусева, обнаружены на Марсе. Природные кислотные дожди кардинально меняли облик и доисторической Земли. Так, 252 млн лет назад они стали причиной вымирания 95% биологических видов планеты. В современном же мире главный виновник экологических катастроф – человек, а не природа.
Венера
Кратер Гусева (Марс)
Слайд 7 Причиной кислотных осадков являются:
выбросы предприятий металлургии, машиностроения и энергетики;
выделение метана
при выращивании риса;
выхлопы автотранспорта;
использование спреев, содержащих хлороводород;
сжигание органического топлива (мазута, угля, газа, дров);
угольная, газовая и нефтяная добыча;
удобрение почв азотсодержащими препаратами;
утечка фреона из кондиционеров и холодильников.
выхлопы автотранспорта;
использование спреев, содержащих хлороводород;
сжигание органического топлива (мазута, угля, газа, дров);
угольная, газовая и нефтяная добыча;
удобрение почв азотсодержащими препаратами;
утечка фреона из кондиционеров и холодильников.
Слайд 8
В результате сжигания ископаемого топлива в атмосферу земли поступают соединения
азота, серы, хлора и некоторые другие элементы. Среди них преобладают оксиды серы – SO2 и азота –NО2, N2O, N2O4, NO.
.
Слайд 9Хотя окись азота NО и образуется в довольно значительных количествах и
природе при лесных пожарах, однако высокие концентрации окислов азота в городах и окрестностях промышленных предприятий связаны с деятельностью человека. Оксиды азота образуются из-за того, что процесс горения происходит в воздухе, состоящем на 21% из кислорода и на 78% - из азота. При высоких температурах горения часть молекулярного азота окисляется до монооксида, который в воздухе немедленно вступает в реакцию с кислородом с образованием диоксида и тетраоксида. Исходно двуокись азота составляет лишь 10% выбросов всех окислов азота в атмосферу, однако в воздухе значительная часть окиси азота превращается в двуокись – гораздо более опасное соединение.
Слайд 10При высокотемпературном сгорании природного топлива происходят реакции двух типов, в результате
которых образуются окислы азота. К первому типу реакции относится реакция между кислородом воздуха и азотом, содержащимся в топливе (содержание азота в угле составляет и среднем около 1%, в нефти и газе 0,2 - 0,3%), ко второму тину - реакции между кислородом воздуха и азотом, содержащимся в воздухе.
Приблизительно 95% годового выброса окислов азота в атмосферу - это результат сжигания ископаемого топлива. Приблизительно 95% годового выброса окислов азота в атмосферу - это результат сжигания ископаемого топлива. Около 40% общего объема выбросов приходится на моторные виды транспорта, 30% — на сжигание топлива в топках тепло- и электростанций, 20% - на сжигание ископаемого топлива для осуществления различных производственных процессов в промышленности. Еще два источника выбросов - производство азотной кислоты и взрывчатых веществ — не связаны с процессом сжигания топлива.
Приблизительно 95% годового выброса окислов азота в атмосферу - это результат сжигания ископаемого топлива. Приблизительно 95% годового выброса окислов азота в атмосферу - это результат сжигания ископаемого топлива. Около 40% общего объема выбросов приходится на моторные виды транспорта, 30% — на сжигание топлива в топках тепло- и электростанций, 20% - на сжигание ископаемого топлива для осуществления различных производственных процессов в промышленности. Еще два источника выбросов - производство азотной кислоты и взрывчатых веществ — не связаны с процессом сжигания топлива.
Слайд 11В результате выбросов окислов азота ежегодно в атмосфере Земли образуется приблизительно
60 млн. тонн NO2. В атмосфере перекись азота вступает в реакцию с парами воды и образует азотную кислоту. Азотная кислота, в свою очередь, реагируя с различными веществами, образует нитраты, которые затем выпадают на землю с осадками и в виде минеральных аэрозолей. Основную роль играет реакция с аммиаком NН4 - главным продуктом естественного гниения органических веществ. В этой реакции образуется нитрат NH4 NO3 - аммонийная селитра. Помимо образования кислотных дождей, оксид азота в атмосфере участвует в фотохимических реакциях с образованием фотохимических окислителей.
Слайд 12Под действием световой энергии диоксид азота распадается на монооксид азота и
атом кислорода, а тот соединяется с молекулой кислорода, давая озон. Такой процесс спонтанно обратим.
NO2 NO + O2+ O2+ + O2 O3.
Озон, вступая в реакции с углеводородами, образует не менее вредные соединения – альдегиды. Озон, двуокись азота, и альдегиды называются фотохимическими загрязнителями воздуха, поскольку они образуются в ходе реакций, возбужденных солнечным светом. Все они очень токсичны и являются окислителями, т.е. способны окислять различные вещества, которые не может окислить кислород воздуха.
NO2 NO + O2+ O2+ + O2 O3.
Озон, вступая в реакции с углеводородами, образует не менее вредные соединения – альдегиды. Озон, двуокись азота, и альдегиды называются фотохимическими загрязнителями воздуха, поскольку они образуются в ходе реакций, возбужденных солнечным светом. Все они очень токсичны и являются окислителями, т.е. способны окислять различные вещества, которые не может окислить кислород воздуха.
Слайд 13 Воздействие фотохимических окислителей на паренхимные клетки нарушает биохимию физиологических
процессов в организме растений и животных, что в итоге может привести к самым различным патологиям, в том числе аллергическим и раку.
Двуокись азота ослабляет обоняние и ночное зрение; повышаются усилия, затраченные на дыхание; газообразная двуокись азота может связываться с гемоглобином, лишая его, таким образом, возможности доставлять кислород к тканям тела. Нитраты, содержащиеся в пище, могут присоединяться к гемоглобину, образуя метгемоглобин.
N2 + O2 NO + O2 NO2 и N2 O5
NO2 + H2O = 2 H NO3 + NH3 NH4 NO3.
Патологические эффекты сводятся к тому, что у людей, которые подвергаются воздействию высоких концентраций NО2, наблюдается катар верхних дыхательных путей, бронхиты, круп и воспаление легких. У таких людей отмечается также повышенная смертность от сердечных и раковых заболеваний.
Двуокись азота ослабляет обоняние и ночное зрение; повышаются усилия, затраченные на дыхание; газообразная двуокись азота может связываться с гемоглобином, лишая его, таким образом, возможности доставлять кислород к тканям тела. Нитраты, содержащиеся в пище, могут присоединяться к гемоглобину, образуя метгемоглобин.
N2 + O2 NO + O2 NO2 и N2 O5
NO2 + H2O = 2 H NO3 + NH3 NH4 NO3.
Патологические эффекты сводятся к тому, что у людей, которые подвергаются воздействию высоких концентраций NО2, наблюдается катар верхних дыхательных путей, бронхиты, круп и воспаление легких. У таких людей отмечается также повышенная смертность от сердечных и раковых заболеваний.
Слайд 14Соединяясь с частицами воды, оксиды серы и азота образуют серную (Н2SО4)
и азотную (HNОз) кислоты различной концентрации. Известно, что кислотность среды, определяемая водородным показателем (рН), является величиной, характеризующей концентрацию ионов водорода в растворе, и численно равна отрицательному десятичному логарифму этой концентрации: рН = - lg [H+].
Слайд 16До определенного времени проблема кислотных дождей считалась региональной, связанной главным образом
с развитием промышленности северного полушария. Однако высокие выбросы серы и азота в местах, где используются техногенные ископаемые, сделали проблему кислотных дождей международной. Выбросы промышленных предприятий могут переноситься воздушными потоками на многие тысячи километров и вызывать кислотные дожди в странах, которые находятся на больших расстояниях от источников загрязнения.
Слайд 17В 30% случаев кислотные дожди являются азотными. Осадки, в составе которых
преобладают аэрозоли азотистой и азотной кислоты, образуются по такому же принципу, что и серные. Попавшие в атмосферу оксиды азота реагируют с дождевой водой. Образовавшиеся в результате кислоты орошают почву, где распадаются на нитраты и нитриты.
Слайд 18Соляные кислотные дожди – редкость. Например, в США их доля от
общего числа аномальных осадков составляет 5%. Источник для формирования таких дождей – хлор. Он попадает в воздух при сжигании отходов или с выбросами химических предприятий. В атмосфере он взаимодействует с метаном. Получившийся в результате хлорводород, реагируя с водой, превращается в соляную кислоту. Кислотный дождь с плавиковой кислотой в составе образуется при растворении в воде фторводорода – вещества, выделяемого предприятиями стекольной и алюминиевой промышленности.
Слайд 19Несмотря на то, что сигнал тревоги Роберта Смита прозвучал около ста
лет назад, индустриальные государства долго игнорировали опасность кислотных осадков. И только в начале 50-х годов канадское правительство разработало программу изучения и мониторинга вод в озерах Новой Шотландии, где наблюдалось быстрое повышение кислотности. В 60-е годы Скандинавия сообщила об уменьшении косяков рыбы и даже ее полном исчезновении в некоторых озерах. В 1972 г. проблема кислотных дождей была впервые поднята Швецией на Конференции ООН по окружающей среде. С этого времени опасность глобального закисления окружающей среды превратилась в одну из наиболее острых проблем, обрушившихся на человечество.
Слайд 20Первыми жертвами кислотных дождей стали водоемы - озера и реки. Особенно
пострадали озера Скандинавии, северо-восток США, юго-восток Канады и юго-запад Шотландии. Во многом это связано с тем, что местные почвы и коренные породы не способны в должной мере нейтрализовать кислотные осадки. Повышение кислотности водоемов влечет за собой увеличение содержания алюминия, крайне токсичного для рыб (летальная доза - 0,2 мг/л). Попутно фосфаты, которые играют особую роль в развитии фитопланктона - кормовой базы многих рыб, соединяются с алюминием и становятся менее доступными для ихтиофауны водоемов. Особенно опасно подкисление для океанических мелководий, поскольку уменьшение массы фитопланктона Мирового океана ведет к разрыву пищевых цепей и может изменить экологическое равновесие в океанической экосистеме.
Слайд 21В конце 70-х годов в местечке Уилинг (США) в течение трёх
дней моросило влагой, что была на вкус, как сок лимона. Измерения рН показали: кислотность местных осадков превышает норму в 5 тысяч раз.
Слайд 23Почвы менее восприимчивы к подкислению, нежели водоемы,так как обладают буферными свойствами.
Слайд 25Закисление почв осадками приводит к вымыванию питательных веществ и высвобождению ионов
токсичных металлов. Как результат, разрушается корневая система растений, а в камбии накапливаются яды. Кислотный дождь, повреждая хвойные иглы и листовую поверхность, нарушает процесс фотосинтеза. Он способствует ослаблению и замедлению роста растений, вызывает их усыхание и гибель, провоцирует болезни у животных. Влажный воздух с частицами серы и сульфатов опасен для людей, страдающих дыхательными и сердечнососудистыми заболеваниями. Он может вызвать обострение астмы, отёк лёгких, повышает смертность от бронхитов.
Слайд 26По версии Книги рекордов Гиннеса, самый кислый из дождей выпал в
1982 году на американо-канадской границе – в районе Великих озёр. Показатель рН осадков составлял 2,83. Кислотные дожди стали настоящим бедствием для Китая. 80% жидких осадков, выпадающих в Поднебесной, имеют пониженный уровень рН. В 2006 году в стране были зафиксированы рекордно кислые дожди.
Слайд 27Чем опасно такое явление для экосистем? Кислотный дождь негативно влияет, прежде
всего, на озёра и реки. Для флоры и фауны водоёмов идеальной является нейтральная среда. Ни щелочная, ни кислая вода не способствуют биоразнообразию. О том, насколько опасны кислотные осадки для жизни в водоёмах, хорошо известно жителям озёрных краёв Шотландии, Канады, США, Скандинавии. Последствиями дождей там стали:
утрата рыбных ресурсов;
сокращение популяции птиц и животных, обитающих поблизости;
интоксикация воды;
выщелачивание тяжёлых металлов.
утрата рыбных ресурсов;
сокращение популяции птиц и животных, обитающих поблизости;
интоксикация воды;
выщелачивание тяжёлых металлов.
Слайд 28Кислая дождевая вода разрушает туф, мрамор, мел и известняк. Из стекла
и минеральных стройматериалов она выщелачивает как карбонаты, так и силикаты. Ещё быстрее осадки уничтожают металл: железо покрывается ржавчиной, на поверхности бронзы образуется патина. Проект по защите старинных зданий и скульптур от кислотных дождей действует в Афинах, Венеции, Риме. На грани исчезновения оказался «Большой Будда» в китайском Лэшане.
Слайд 30
Впервые кислотные дожди, как негативный экологический фактор, стали предметом обсуждения
мирового сообщества в 1972 году. Стокгольмская конференция, участниками которой были представители 20 государств, запустила процесс разработки глобального природоохранного проекта. Следующим важным шагом в борьбе с кислотными осадками стало подписание Киотского протокола (1997), рекомендующего ограничить выбросы в атмосферу.
Слайд 31Сейчас в большинстве стран мира действуют национальные экологические проекты, предполагающие разработку
правовой базы для защиты окружающей среды, внедрение очистных сооружений на предприятиях (установка воздушных, вакуумных, электрических фильтров). Для нормализации кислотности водоёмов применяют метод известкования.